Дисперсные системы (11-й класс). Дисперсные системы виды
2. Дисперсные системы.
5
2.1. Общие понятия и определения.
Дисперсными называют системы, состоящие из множества малых частиц, распределенных в жидкой, твердой или газообразной среде.
Понятие «дисперсный» происходит от лат. dispersus - раздробленный, рассеянный.
Для всех дисперсных систем характерны два основных признака: высокая раздробленность (дисперсность) и гетерогенность.
Гетерогенность дисперсных систем проявляется в том, что эти системы состоят из двух (или более) фаз: дисперсной фазы и дисперсионной среды. Дисперсная фаза - это раздробленная фаза. Она состоит из частиц нерастворимого тонкоизмельченного вещества, распределенных по всему объему дисперсионной среды.
Высокая дисперсность придает веществам новые качественные признаки: повышенную реакционную способность и растворимость, интенсивность окраски, светорассеяние и т. п. Большая поверхность раздела создает в этих системах большой запас поверхностной энергии, которая делает их термодинамически неустойчивыми, чрезвычайно реакционноспособными. В них легко протекают самопроизвольные процессы, приводящие к снижению запаса поверхностной энергии: адсорбция, коагуляция (слипание дисперсных частиц), образование макроструктур и т. п. Таким образом, самые важные и неотъемлемые черты всякой дисперсной системы - гегетрогенность и высокая дисперсность - полностью определяют свойства и поведение этих систем.
Классификацию дисперсных систем проводят на основе различных признаков, а именно: по размеру частиц, по агрегатному состоянию дисперсной фазы и дисперсионной среды, по характеру взаимодействия частиц дисперсной фазы между собой и со средой.
2.2. Классификация дисперсных систем
Классификация по размеру частиц (дисперсности)
Дисперсность D является основной характеристикой дисперсной системы и мерой раздробленности вещества. Математически дисперсность определяют как величину, обратную размеру частицы:
D = 1/а,
где а — размер частицы (диаметр или длина ребра), м-1.
С другой стороны, для характеристики степени раздробленности служит величина удельной поверхности Sуд. Удельную поверхность находят как отношение поверхности S частицы к ее объему V или массе т: Sуд = S/V или Sуд = S/m. Если удельную поверхность определяют по отношению к массе частицы раздробленного вещества, то ее размерность м2/кг, если же по отношению к объему, то размерность совпадает с размерностью дисперсности (м-1).
Физический смысл понятия «удельная поверхность» заключается в том, что это суммарная поверхность всех частиц, общий объем которых составляет 1м3 или общая масса которых равна 1 кг.
По дисперсности системы подразделяют на типы:
1) грубо-дисперсные (грубые взвеси, суспензии, эмульсии, порошки) с радиусом частиц 10-4 - 10-7 м;
2) коллоидно-дисперсные (золи) с размером частиц 10-7 - 10-9 м;
3) молекулярные и ионные растворы с размером частиц менее 10-9 м.
В коллоидных системах достигается высшая степень раздробления вещества, при которой еще сохраняются понятия «фаза» и «гетерогенность». Уменьшение размера частиц еще на порядок переводит системы в гомогенные молекулярные или ионные растворы.
Дисперсность влияет на все основные свойства дисперсных систем: кинетические, оптические, каталитические и т. д.
Свойства дисперсных систем сопоставлены в табл. 1.2.
Т а б л и ц а 1.2.Свойства дисперсных систем разных типов
| Грубодисперсные системы | Коллоидно-дисперсные системы | Молекулярные и ионные (истинные) растворы |
| Непрозрачные - отражают свет | Прозрачные опалесцирующие - рассеивают свет, дают конус Тиндаля | Прозрачные неопалесцирующие, конус Тиндаля не наблюдается |
| Частицы не проходят через фильтр | Частицы проходят через бумажный фильтр | Частицы проходят через бумажный фильтр |
| Частицы задерживаются ультрафильтрами | Частицы задерживаются ультрафильтрами | Частицы проходят через льтрафильтры |
| Гетерогенные | Гетерогенные | Гомогенные |
| Неустойчивы кинетически и термодинамически | Относительно устойчивы кинетически | Устойчивы кинет. и термодинамич.ки |
| Стареют во времени | Стареют во времени | Не стареют |
| Частицы видны в оптический микроскоп | Частицы видны в электрон. Микроскоп и ультрамикроскоп | Частицы не видны в современные микроскопы |
Помимо размера частиц большое значение для свойств дисперсных систем имеет геометрическая форма частиц. В зависимости от условий дробления вещества форма частиц дисперсной фазы может быть очень разнообразной. Один м3 исходного вещества принципиально возможно раздробить на кубики с длиной ребра l=10-8м, вытянуть в нить с сечением 10-8 х 10-8 м или расплющить в пластину (пленку) толщиной 10-8 м. В каждом из этих случаев система будет дисперсной со всеми присущими признаками.
Sуд = S/V = 6l2 / l3= 6 . 108 м-1
Для нитей Sуд = 4-108 м-1; для пленки Sуд = 2. 108 м -1.
Частицы кубической, шарообразной или близкой к ним неправильной формы характерны для многих коллоидных растворов - золей и более грубодисперсных систем – эмульсий.
Классификация по агрегатному состоянию фаз
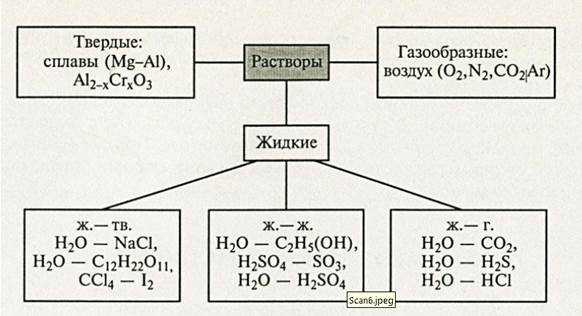
Наиболее распространена классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды. Каждая из этих фаз может быть в трех агрегатных состояниях: газообразном, жидком и твердом. Поэтому возможно существование восьми типов коллоидных систем (табл. 1.3). Система «газ в газе» не входит в это число, так как является гомогенной молекулярной, в ней отсутствуют границы раздела. Высокодисперсные коллоидные растворы, относящиеся к типу систем т/ж, носят название золей (от лат. solutio - раствор). Золи, у которых дисперсионной средой является вода, называют гидрозолями. Если дисперсионной средой служит органическая жидкость, коллоидный раствор носит название органозоля. Эти последние, в свою очередь, подразделяют на алкозоли, бензозоли, этерозоли и т.п., в которых дисперсионной средой являются соответственно спирт, бензол, эфир и т. д. В зависимости от агрегатного состояния дисперсионной среды различают лиозоли - золи с жидкой дисперсионной средой (от греч. lios — жидкость), аэрозоли - золи с газообразной дисперсионной средой, твердые золи - системы типа т/т. Грубодисперсные системы типа т/ж называют суспензиями, типа ж/ж – эмульсиями.
Таблица 2..2. Основные типы дисперсных систем
| Дисп фаза | Дисп.среда | Обознач. | Примеры |
| Газ | Газ | Не существ. | |
| Жидкость | » | ж/г | Туман, облака, аэрозоли жидких лекарств |
| Твердое тело | » | т/г | Дым, пыль, порошки, аэрозоли твердых лекарств |
| Газ | Жидкость | г/ж | Пены, газовые эмульсии |
| Жидкость | « | ж/ж | Эмульсии (молоко, лекарственные эмульсии) |
| Твердое тело | « | т/ж | Суспензии, коллоидные растворы |
| Газ | Твердое тело | г/т | Твердые пены, хлеб, пемза, силикагель, активные угли |
| Жидкость | « | ж/т | Жемчуг, капиллярные системы, цементный камень, гели |
| Твердое тело | « | | Цветные стекла, минералы, сплавы |
Классификация по отсутствию или наличию взаимодействия между частицами дисперсной фазы
По кинетическим свойствам дисперсной фазы все дисперсные системы можно подразделить на два класса: свободно-дисперсные, в которых частицы дисперсной фазы не связаны между собой и могут свободно перемещаться (лиозоли, аэрозоли, суспензии, эмульсии), и связно-дисперсные, в которых одна из фаз структурно закреплена и не может перемещаться свободно. К этому классу относят гели и студни, пены, капиллярно-пористые тела (диафрагмы), твердые растворы и др.
Классификация по степени взаимодействия дисперсной фазы с дисперсионной средой
Для характеристики взаимодействия между веществом дисперсной фазы и жидкой дисперсионной средой служат понятия «лиофильность» и «лиофобность». Под взаимодействием фаз дисперсных систем подразумевают процессы сольватации (гидратации), т. е. образование сольватных (гидратных) оболочек из молекул дисперсионной среды вокруг частиц дисперсной фазы. Системы, в которых сильно выражено взаимодействие частиц дисперсной фазы с растворителем, называют лиофильными (по отношению к воде — гидрофильными). Если частицы дисперсной фазы состоят из вещества, слабо взаимодействующего со средой, системы являются лиофобными (по отношению к воде — гидрофобными). Термин «лиофильный» происходит от греч. 1уо - растворяю и philia - любовь; «лиофобный» от 1уо - растворяю и phobia - ненависть, что означает «не любящий растворения». Хорошо сольватирующиеся лиофильные дисперсные системы образуются путем самопроизвольного диспергирования. Такие системы термодинамически устойчивы. Примерами таких систем являются дисперсии некоторых глин и поверхностно-активных веществ (ПАВ), растворы высокомолекулярных веществ (ВМВ).
У гидрофобных золей частицы состоят из труднорастворимых соединений, отсутствует или слабо выражено сродство дисперсной фазы к растворителю. Такие частицы плохо сольватированы. Гидрофобные золи являются основным классом коллоидных растворов, у которых ярко выражены гетерогенность и высокая удельная поверхность.
studfiles.net
Дисперсные системы. Определение. Классификация.
Коллоидная химия
Дисперсные системы. Определение. Классификация.
Растворы
В предыдущем параграфе мы говорили о растворах. Здесь коротко напомним об этом понятии.
Растворами называют однородные (гомогенные) системы, состоящие из двух и более компонентов.
Гомогенная система – это однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела).
Такое определение раствора не вполне корректно. Оно скорее относится к истинным растворам.
В тоже время существуют ещё коллоидные растворы, которые являются не гомогенными, а гетерогенными, т.е. состоят из разных фаз, разделённых поверхностью раздела.
Для того чтобы достичь большей чёткости в определениях используют другой термин – дисперсные системы.
Перед рассмотрением дисперсных систем немного расскажем об истории их изучения и о появления такого термина как коллоидные растворы.
История вопроса
Ещё в 1845 г. химик Франческо Сельми, исследуя свойства различных растворов, заметил, что биологические жидкости – сыворотка и плазма крови, лимфа и другие – резко отличаются по своим свойствам от обычных истинных растворов, и поэтому такие жидкости были им названы псевдорастворами.
Коллоиды и кристаллоиды
Дальнейшие исследования в этом направлении, проводившиеся с 1861 г. английским учёным Томасом Грэмом, показали, что одни вещества, быстро диффундирующие и проходящие через растительные и животные мембраны, легко кристаллизуются, другие же обладают малой способностью к диффузии, не проходят через мембраны и не кристаллизуются, а образуют аморфные осадки.
Первые Грэм назвал кристаллоидами, а вторые – коллоидами (от греческого слова kolla – клей и eidos – вид) или клееподобными веществами.
В частности, было выявлено, что вещества, способные к образованию аморфных осадков, как, например, альбумин, желатин, гуммиарабик, гидроокиси железа и алюминия и некоторые другие вещества, диффундируют в воде медленно по сравнению со скоростью диффузии таких кристаллических веществ, как поваренная соль, сернокислый магний, тростниковый сахар и др.
В таблице ниже приведены коэффициенты диффузии D для некоторых кристаллоидов и коллоидов при 18С.
Глюкоза | 180 | 57,0 | Пепсин | 35000 | 7,0 |
Рафиноза | 504 | 35,5 | Яичный альбумин | 45000 | 5,9 |
Из таблицы видно, что между молекулярным весом и коэффициентом диффузии существует обратная зависимость.
Кромме того у кристаллоидов была обнаружена способность не только быстро диффундировать, но и диализироваться, т.е. проходить через мембранны, в противоположность коллоидам, имеющим больший размер молекул и поэтому медленно диффундирующим и не проникающим через мембраны.
В качестве мембран используют стенки бычьего пузыря, целлофан, плёнки из железисто-синеродистой меди и т.д.
На основании сделанных наблюдений Грэм установил, что все вещества могут быть подразделены на кристаллоиды и коллоиды.
Русские не согласны
Против такого строго разделения химических веществ возражал профессор Киевского университета И.Г. Борщёв (1869). Мнение Борщёва позднее было подтвеждено исследованиями другого русского учёного Веймарна, который доказал, что одно и то же вещество в зависимости от условий может проявлять свойства коллоидов или кристаллоидов.
Так, например, раствор мыла в воде обладает свойствами коллоида, а мыло, растворённое в спирте, проявляет свойства истинных растворов.
Точно также кристаллические соли, например, поваренная соль, растворённая в воде, даёт истинный раствор, а в бензоле – коллоидный раствор и т.п.
Гемоглобин же или яичный альбумин, обладающие свойствами коллоидов, могут быть получены в кристаллическом состоянии.
Д.И. Менделеев полагал, что любое вещество, в зависимости от условий и природы среды, может проявлять свойства коллоида. В настоящее время любое вещество можно получить в коллоидном состоянии.
Таким образом, нет оснований подразделять вещества на два обособленных класса – на кристаллоиды и коллоиды, а можно говорить о коллоидном и кристаллоидном состоянии вещества.
Под коллоидным состоянием вещества подразумевается определённая степень его раздробленности или дисперсности и нахождении коллоидных частиц во взвешенном состоянии в растворителе.
Наука, изучающая физико-химические свойства гетерогенных высокодисперсных и высокомолекулярных систем называется коллоидной химией.
Дисперсные системы
Если одно вещество, находящееся в раздробленном (диспергированном) состоянии, равномерно распределено в массе другого вещества, то такую систему называют дисперсной.
В таких системах раздробленное вещество принято называть дисперсной фазой, а среду, в которой она распределена, - дисперсионной средой.
Так, например, система, представляющая собой взмученную глину в воде, состоит из взвешенных мелких частиц глины – дисперсной фазы и воды – дисперсионной среды.
Дисперсные (раздробленные) системы являются гетерогенными.
Дисперсные системы, в отличие от гетерогенных с относительно крупными, сплошными фазами, называют микрогетерогенными, а коллоиднодисперсные системы называют ультрамикрогетерогенными.
Классификация дисперсных систем
Классификацию дисперсных систем чаще всего производят исходя из степени дисперсности или агрегатного состояния дисперсной фазы и дисперсионной среды.
Классификация по степени дисперсности
Все дисперсные системы по величине частиц дисперсной фазы можно разделить на следующие группы:
Микроскопическая дисперсность(суспензии, эмульсии) | 10-2 - 10-4 |
Коллоидная дисперсность | 10-5 - 10-7 |
Молекулярная дисперсность | 10-8 - 10-9 |
Ионная дисперсность | 10-10 |
Для справки прводим единицы размеров в системе СИ: 1 м (метр) = 102 см (сантиметра) = 103 мм (миллиметра) = 106 мкм (микрометра) = 109 нм (нанометра). Иногда применяют другие единицы – мк (микрон) или ммк (миллимикрон), причём: 1 нм = 10-9 м =10-7 см = 1 ммк; 1 мкм = 10-6 м = 10-4 см = 1 мк.
Грубодисперсные системы.
Эти системы содержат в качестве дисперсной фазы наиболее крупные частицы диаметром от 0,1 мк и выше. К этим системам относятся суспензии и эмульсии.
Суспензиями называют системы, в которых твёрдое вещество находится в жидкой дисперсионной среде, например, взвесь крахмала, глины и др. в воде.
Эмульсиями называют дисперсионные системы двух несмешивающихся жидкостей, где капельки одной жидкости во взвешенном состоянии распределены в объёме другой жидкости. Например, масло, бензол, толуол в воде или капельки жира (диаметром от 0,1 до 22 мк) в молоке и др.
Коллоидные системы.
Они имеют размеры частиц дисперсной фазы от 0,1 мк до 1 ммк (или от 10-5 до 10-7 см). Такие частицы могут проходить через поры фильтровальной бумаги, но не проникают через поры животных и растительных мембран.
Коллоидные частицы при наличии у них электрического заряда и сольватно-ионных оболочек остаются во взвешенном состоянии и без изменения условий очень долго могут не выпадать в осадок.
Примерами коллоидных систем могут служить растворы альбумина, желатина, гуммиарабика, коллоидные растворы золота, серебра, сернистого мышьяка и др.
Молекулярно-дисперсные системы.
Такие системы имеют размеры частиц, не превышающие 1ммк. К молекулярно-дисперсным системам относятся истинные растворы неэлектролитов.
Ионно-дисперсные системы.
Это растворы различных электролитов, как, например, солей, оснований и т.д., распадающихся на соответствующие ионы, размеры которых весьма малы и выходят далеко за пределы 10-8 см.
Уточнение по повду представления истинных растворов как дисперсных системах. Из приведённой здесь классификации видно, что любой раствор (как истинный, так и коллоидный) можно представить как дисперсную среду. Истинные и коллоидные растворы будут различаться размерами частиц дисперсных фаз. Но выше мы писали о гомогенности истинных растворов, а дисперсионные системы гетерогенны. Как разрешить это противоречие? Если говорить о структуре истинных растворов, то их гомогенность будет относительной. Структурные единицы истинных растворов (молекулы или ионы) значительно меньше частиц коллоидных растворов. Поэтому, можно сказать, что по сравнению с коллоидными растворами и взвесями, истинные растворы гомогенны. Если же говорить о свойствах истинных растворов, то их нельзя в полной мере называть дисперсными системами, поскольку обязательным существованием дисперсных систем является взаимная нерастворимость диспергированного вещества и дисперсионной среды. В коллоидных растворах и грубых взвесях дисперсная фаза и дисперсионная среда практически не смешиваются и не реагируют друг с другом химически. Этого совсем нельзя сказать об истинных растворах. В них при растворении вещества смешиваются и даже взаимодействуют друг с другом. По этой причине коллоидные растворы резко отличаются по свойствам от истинных растворов.
Размеры некоторых молекул, частиц, клеток.
Атом водорода | 0,01 |
Ион натрия | 0,26 |
Молекула спирта | 0,5 |
Молекула гемоглобина | 3,5 |
Молекулы крахмала | 5,0 |
Частицы коллоидного золота | 2 - 130 |
Вирусы | 10 - 300 |
Хромосомы | 200 - 3500 |
Зёрна крахмала | 7000 |
Бактерии | 400 - 15000 |
Эритроциты | 7500 |
По мере изменения размеров частиц от наиболее крупных к мелким и обратно будут соответственно меняться и свойства дисперсных систем. При этом коллоидные системы занимают как бы промежуточное положение между грубыми взвесями и молекулярно-дисперсными системами.
Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды.
Пены – это дисперсия газа в жидкости, причём в пенах жидкость вырождается до тонких плёнок, разделяющих отдельные пузырьки газа.
Эмульсиями называют дисперсные системы, в которых одна жидкость раздроблена другой, нерастворяющей её жидкостью (например вода в жире).
Суспензиями называют низкодисперсные системы твёрдых частиц в жидкостях.
Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем:
Газообразная | Газообразная | Дисперсная система не образуется |
Газообразная | Жидкая | Газовые эмульсии и пены |
Газообразная | Твёрдая | Пористые тела: поролон пемза |
Жидкая | Газообразная | Аэрозоли: туманы, облака |
Жидкая | Жидкая | Эмульсии: нефть, крем, молоко, маргарин, масло |
Жидкая | Твёрдая | Капилярные системы: Жидкость в пористых телах, грунт, почва |
Твёрдая | Газообразная | Аэрозоли (пыли, дымы), поршки |
Твёрдая | Жидкая | Суспензии: пульпа, ил, взвесь, паста |
Твёрдая | Твёрдая | Твёрдые системы: сплавы, бетон |
Золи – другое название коллоидных растворов.
Коллоидные растворы иначе называют золями (от латинского solutus – растворённый).
Дисперсные системы с газообразной дисперсионной средой называют аэрозолями. Туманы представляют собой аэрозоли с жидкой дисперсной фазой, а пыль и дым – аэрозоли с твёрдой дисперсной фазой. Дым более высокодисперсная система, чем пыль.
Дисперсные системы с жидкой дисперсионной средой называют лизолями (от греческого «лиос» – жидкость).
В зависимости от растворителя (дисперсионной среды), т.е. воды, спирта бензола или эфира и т.д., различают гидрозоли, алкозоли, бензоли, этерозоли и т.д.
Связнодисперсные системы. Гели.
Дисперсные системы могут быть свободнодисперсными и связнодисперсными в зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы.
К свободнодисперсным системам относятся аэрозоли, лизоли, разбавленные суспензии и эмульсии. Они текучи. В этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести.
На рисунках выше изображены свободно-дисперсные системы: На рисунках а, б, в изображены корпускулярно-дисперсные системы: а,б - монодисперсные системы, в - полидисперсная система, На рисунке г изображена волокнисто-дисперсная система На рисунке д изображена плёночно-дисперсная система
Связнодисперсные системы – твердообразны. Они возникают при контакте частиц дисперсной фазы, приводящем к образованию структуры в виде каркаса или сетки.
Такая структура ограничивает текучесть дисперсной системы и придаёт ей способность сохранять форму. Подобные структурированные коллоидные системы называются гелями.
Переход золя в гель, происходящий в результате понижения устойчивости золя, называют гелеобразованием (или желатинированием).
На рисунках а, б, в изображены связнодисперсные системы: а - гель, б - коагулят с плотной структурой, в - коагулят с рыхлой - "арочной" структурой На рисунках г, д изображены капилярнодисперсные системы
Порошки (пасты), пены – примеры связнодисперсных систем.
Почва, образовавшаяся в результате контакта и уплотнения дисперсных частиц почвенных минералов и гумусовых (органических) веществ, также представляет собой связнодисперсную систему.
Сплошную массу вещества могут пронизывать поры и капиляры, образующие капилярнодисперсные системы. К ним относятся, например, древесина, кожа, бумага, картон, ткани.
Лиофильность и лиофобность
Общей характеристикой коллоидных растворов является свойство их дисперсной фазы взаимодействовать с дисперсионной средой. В этом отношении различают два типа золей:
1. Лиофобные (от греческого phobia – ненависть) и
2. Лиофильные (от греческого philia – любовь).
У лиофобных золей частицы не имеют сродства к растворителю, слабо с ним взаимодействуют и образуют вокруг себя тонкую оболочку из молекул растворителя.
В частности, если дисперсионной средой является вода, то такие системы называются гидрофобными, например, золи металлов железа, золота, сернистого мышьяка, хлористого серебра и т.д.
В лиофильных системах между диспергированным веществом и растворителем имеется сродство. Частицы дисперсной фазы, в этом случае, приобретают более объёмную оболочку из молекул растворителя.
В случае водной дисперсионной среды такие системы называются гидрофильными, как, например, растворы белка, крахмала, агар-агара, гуммиарабика и др.
Коагуляция коллоидов. Стабилизаторы.
Вещество на границе раздела фаз.
Все жидкости и твёрдые тела ограничены внешней поверхностью, на которой они соприкасаются с фазами другого состава и структуры, например, с паром, другой жидкостью или твёрдым телом.
Свойства вещества в этой межфазовой поверхности, толщиной в несколько поперечников атомов или молекул, отличаются от свойств внутри объёма фазы.
Внутри объёма чистого вещества в твёрдом, жидком или газообразном состоянии любая молекула окружена себе подобными молекулами.
В пограничном слое молекулы находятся во взаимодействии или с другим числом молекул (другим в сравнении с взаимодействием внутри объёма вещества).
Это происходит, например, на границе жидкости или твёрдого тела с их паром. Либо в пограничном слое молекулы вещества взаимодействуют с молекулами другой химической природы, например, на границе двух взаимно малорастворимых жидкостей.
В результате различия в характере взаимодействия внутри объёма фаз и на границе фаз возникают силовые поля, связанные с этой неравномерностью. (Подробнее об этом в параграфе Поверхностное натяжение жидкости.)
Чем больше различие в напряжённости межмолекулярных сил, действующих в каждой из фаз, тем больше потенциальная энергия межфазовой поверхности, кратко называемой поверхностной энергией.
Поверхностное натяжение Для оценки поверхностной энергии пользуются такой величиной, как удельная свободная поверхностная энергия. Она равна работе затрачиваемой на образование единицы площади новой поверхности раздела фаз (при условии постоянной температуры). В случае границы двух конденсированных фаз эту величину называют пограничным натяжением. Когда говорят о границе жидкости с её парами, то эту величину называют поверхностным натяжением.
Коагуляция коллоидов
Все самопроизвольные процессы происходят в направлении уменьшения энергии системы (изобарного потенциала).
Аналогично, на границе раздела фаз самопроизвольно происходят процессы в направлении уменьшения свободной поверхностной энергии.
Свободная энергия тем меньше, чем меньше поверхность раздела фаз.
А поверхность раздела фаз, в свою очередь, связана со степенью дисперсности растворённого вещества. Чем выше дисперсность (мельче частицы дисперсной фазы), тем больше поверхность раздела фаз.
Таким образом, в дисперсных системах всегда существуют силы, приводящие к уменьшению суммарной поверхности раздела фаз, т.е. к укрупнению частиц. Поэтому происходит слияние мелких капель в туманах, дождевых облаках и эмульсиях – агрегация высокодисперсных частиц в более крупные образования.
Всё это приводит к разрушению дисперсных систем: туманы и дождевые облака проливаются дождём, эмульсии расслаиваются, коллоидные растворы коагулируют, т.е. разделяются на осадок дисперсной фазы (коагулят) и дисперсионную среду или в случае вытянутых частиц дисперсной фазы, превращаются в гель.
Способность раздробленных систем сохранять присущую им степень дисперсности называется агрегативной устойчивостью.
Стабилизаторы дисперсных систем
Как было сказано ранее, дисперсные системы принципиально термодинамически неустойчивы. Чем выше дисперсность, тем больше свободная поверхностная энергия, тем больше склонность к самопроизвольному уменьшению дисперсности.
Поэтому для получения устойчивых, т.е. длительно сохраняющихся суспензий, эмульсий, коллоидных растворов, необходимо не только достигнуть заданной дисперсности, но и создать условия для её стабилизации.
Ввиду этого устойчивые дисперсные системы состоят не менее чем из трёх компонентов: дисперсной фазы, дисперсионной среды и третьего компонента – стабилизатора дисперсной системы.
Стабилизатор может иметь как ионную, так и молекулярную, часто высокомолекулярную, природу.
Ионная стабилизация золей лиофобных коллоидов связана с присутствием малых концентраций электролитов, создающих ионные пограничные слои между дисперсной фазой и дисперсионной средой.
Высокомолекулярные соединения (белки, полипептиды, поливиниловый спирт и другие), добавляемые для стабилизации дисперсных систем, называют защитными коллоидами.
Адсорбируясь на границе раздела фаз, они образуют в поверхностном слое сетчатые и гелеобразные структуры, создающие структурно-механический барьер, который препятствует объединению частиц дисперсной фазы.
Структурно-механическая стабилизация имеет решающее значение для стабилизации взвесей, паст, пен, концентрированных эмульсий.
xn----7sbb4aandjwsmn3a8g6b.xn--p1ai
Дисперсные системы
В окружающем нас мире чистые вещества встречаются крайне редко, в основном большинство веществ на земле и в атмосфере – это разнообразные смеси, содержащие более двух компонентов. Частицы размером примерно от 1 нм (несколько молекулярных размеров) до 10 мкм называются дисперсными (лат. dispergo – рассеивать, распылять). Разнообразные системы (неорганические, органические, полимерные, белковые), в которых хотя бы одно из веществ находится в виде таких частиц, называются дисперсными. Дисперсные - это гетерогенные системы, состоящие из двух или более фаз с сильно развитой поверхностью раздела между ними или смесь, состоящая как минимум из двух веществ, которые совершенно или практически не смешиваются друг с другом и не реагируют друг с другом химически. Одна из фаз – дисперсная фаза – состоит из очень мелких частиц, распределенных в другой фазе – дисперсионной среде.
Дисперсная система
По агрегатному состоянию дисперсные частицы могут быть твердыми, жидкими, газообразными, во многих случаях имеют сложное строение. Дисперсионные среды также бывают газообразными, жидкими и твердыми. В виде дисперсных систем существует большинство реальных тел окружающего нас мира: морская вода, грунты и почвы, ткани живых организмов, многие технические материалы, пищевые продукты и др.
Классификация дисперсных систем
Несмотря на многочисленные попытки предложить единую классификацию этих систем, она до сих пор отсутствует. Причина заключена в том, что в любой классификации принимаются в качестве критерия не все свойства дисперсных систем, а только какое-нибудь одно из них. Рассмотрим наиболее распространенные классификации коллоидных и микрогетерогенных систем.
В любой области знаний, когда приходится сталкиваться со сложными объектами и явлениями, для облегчения и установления определенных закономерностей целесообразно классифицировать их по тем или иным признакам. Это относится и к области дисперсных систем; в разное время для них были предложены различные принципы классификации. По интенсивности взаимодействия веществ дисперсионной среды и дисперсной фазы различают лиофильные и лиофобные коллоиды. Ниже кратко изложены другие приемы классификации дисперсных систем.
Классификация по наличию или отсутствию взаимодействия между частицами дисперсной фазы. Согласно этой классификации дисперсные системы делят на свободнодисперсные и связнодисперсные; классификация применима к коллоидным растворам и к растворам высокомолекулярных соединений.
К свободнодисперсным системам относят типичные коллоидные растворы, суспензии, взвеси, разнообразные растворы высокомолекулярных соединений, которые обладают текучестью, как обычные жидкости и растворы.
К связнодисперсным относят так называемые структурированные системы, в которых в результате взаимодействия между частицами возникает пространственная ажурная сетка-каркас, и система в целом приобретает свойство полутвердого тела. Например, золи некоторых веществ и растворы высокомолекулярных соединений при понижении температуры или с ростом концентрации выше известного предела, не претерпевая внешне каких-либо изменений, утрачивают текучесть — желатинируют (застудневают), переходят в состояние геля (студня). Сюда же можно отнести концентрированные пасты, аморфные осадки.
Классификация по дисперсности. Физические свойства вещества не зависят от размеров тела, но при высокой степени измельчения становятся функцией дисперсности. Например, золи металлов обладают различной окраской в зависимости от степени измельчения. Так, коллоидные растворы золота предельно высокой дисперсности имеют пурпурный цвет, менее дисперсные — синий, еще менее —зеленый. Есть основания полагать, что и другие свойства золей одного и того же вещества меняются по мере измельчения: Напрашивается естественный критерий классификации коллоидных систем по дисперсности, т. е. разделение области коллоидного состояния (10-5—10-7см) на ряд более узких интервалов. Такая классификация была в свое время предложена, но она оказалась бесполезной, так как коллоидные системы практически всегда полидисперсны; монодисперсные встречаются очень редко. К тому же степень дисперсности может меняться во времени, т. е. зависит от возраста системы.
studfiles.net
Дисперсные системы
В окружающем нас мире чистые вещества встречаются крайне редко, в основном большинство веществ на земле и в атмосфере – это разнообразные смеси, содержащие более двух компонентов. Частицы размером примерно от 1 нм (несколько молекулярных размеров) до 10 мкм называются дисперсными (лат. dispergo – рассеивать, распылять). Разнообразные системы (неорганические, органические, полимерные, белковые), в которых хотя бы одно из веществ находится в виде таких частиц, называются дисперсными. Дисперсные - это гетерогенные системы, состоящие из двух или более фаз с сильно развитой поверхностью раздела между ними или смесь, состоящая как минимум из двух веществ, которые совершенно или практически не смешиваются друг с другом и не реагируют друг с другом химически. Одна из фаз – дисперсная фаза – состоит из очень мелких частиц, распределенных в другой фазе – дисперсионной среде.
Дисперсная система
По агрегатному состоянию дисперсные частицы могут быть твердыми, жидкими, газообразными, во многих случаях имеют сложное строение. Дисперсионные среды также бывают газообразными, жидкими и твердыми. В виде дисперсных систем существует большинство реальных тел окружающего нас мира: морская вода, грунты и почвы, ткани живых организмов, многие технические материалы, пищевые продукты и др.
Классификация дисперсных систем
Несмотря на многочисленные попытки предложить единую классификацию этих систем, она до сих пор отсутствует. Причина заключена в том, что в любой классификации принимаются в качестве критерия не все свойства дисперсных систем, а только какое-нибудь одно из них. Рассмотрим наиболее распространенные классификации коллоидных и микрогетерогенных систем.
В любой области знаний, когда приходится сталкиваться со сложными объектами и явлениями, для облегчения и установления определенных закономерностей целесообразно классифицировать их по тем или иным признакам. Это относится и к области дисперсных систем; в разное время для них были предложены различные принципы классификации. По интенсивности взаимодействия веществ дисперсионной среды и дисперсной фазы различают лиофильные и лиофобные коллоиды. Ниже кратко изложены другие приемы классификации дисперсных систем.
Классификация по наличию или отсутствию взаимодействия между частицами дисперсной фазы. Согласно этой классификации дисперсные системы делят на свободнодисперсные и связнодисперсные; классификация применима к коллоидным растворам и к растворам высокомолекулярных соединений.
К свободнодисперсным системам относят типичные коллоидные растворы, суспензии, взвеси, разнообразные растворы высокомолекулярных соединений, которые обладают текучестью, как обычные жидкости и растворы.
К связнодисперсным относят так называемые структурированные системы, в которых в результате взаимодействия между частицами возникает пространственная ажурная сетка-каркас, и система в целом приобретает свойство полутвердого тела. Например, золи некоторых веществ и растворы высокомолекулярных соединений при понижении температуры или с ростом концентрации выше известного предела, не претерпевая внешне каких-либо изменений, утрачивают текучесть — желатинируют (застудневают), переходят в состояние геля (студня). Сюда же можно отнести концентрированные пасты, аморфные осадки.
Классификация по дисперсности. Физические свойства вещества не зависят от размеров тела, но при высокой степени измельчения становятся функцией дисперсности. Например, золи металлов обладают различной окраской в зависимости от степени измельчения. Так, коллоидные растворы золота предельно высокой дисперсности имеют пурпурный цвет, менее дисперсные — синий, еще менее —зеленый. Есть основания полагать, что и другие свойства золей одного и того же вещества меняются по мере измельчения: Напрашивается естественный критерий классификации коллоидных систем по дисперсности, т. е. разделение области коллоидного состояния (10-5—10-7см) на ряд более узких интервалов. Такая классификация была в свое время предложена, но она оказалась бесполезной, так как коллоидные системы практически всегда полидисперсны; монодисперсные встречаются очень редко. К тому же степень дисперсности может меняться во времени, т. е. зависит от возраста системы.
studfiles.net
Дисперсные системы (11-й класс)
Разделы: Химия
|
Предложите не менее пяти вопросов по обозначенной теме, на которые бы вы хотели получить ответы. |
Изучив тему урока, вы узнаете:
- что такое дисперсные системы?
- какими бывают дисперсные системы?
- какими свойствами обладают дисперсные системы?
- значение дисперсных систем.
Приложение 1
| Можно изучать каждую дисперсную систему по отдельности, но лучше их классифицировать, выделить общее, типичное и это запомнить. Для этого нужно определить, по каким признакам это сделать. Найдите в тексте, предложенный Вам для изучения признак классификации, изучите его. Создайте кластер, указав признаки и свойства дисперсных систем, приведите к нему примеры. |
Чистые вещества в природе встречаются очень редко. Кристаллы чистых веществ – сахара или поваренной соли, например, можно получить разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещество внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
В природе чаще всего встречаются смеси различных веществ. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы. Такие системы мы будем называть дисперсными.
Дисперсной называется система, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме другого.
Вещество распадается на ионы, молекулы, атомы, значит “дробится” на мельчайшие частицы. “Дробление” > диспергирование, т.е. вещества диспергируют до разных размеров частиц видимых и невидимых.
Вещество, которое присутствует в меньшем количестве, диспергирует и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсной средой. Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называются гетерогенными (неоднородными).
И дисперсную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях – твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсной среды и дисперсной фазы можно выделить 9 видов таких систем.
ТаблицаПримеры дисперсных систем
| Дисперсионная среда | Дисперсная фаза | Примеры некоторых природных и бытовых дисперсных систем |
| Газ | Газ | Всегда гомогенная смесь (воздух, природный газ) |
| Жидкость | Туман, попутный газ с капельками нефти, карбюраторная смесь в двигателях автомобилей (капельки бензина в воздухе), аэрозоли | |
| Твердое вещество | Пыли в воздухе, дымы, смог, самумы (пыльные и песчаные бури), аэрозоли | |
| Жидкость | Газ | Шипучие напитки, пены |
| Жидкость | Эмульсии. Жидкие среды организма (плазма крови, лимфа, пищеварительные соки), жидкое содержимое клеток (цитоплазма, кариоплазма) | |
| Твердое вещество | Золи, гели, пасты (кисели, студни, клеи). Речной и морской ил, взвешенные в воде; строительные растворы | |
| Твердое вещество | Газ | Снежный наст с пузырьками воздуха в нем, почва, текстильные ткани, кирпич и керамика, поролон, пористый шоколад, порошки |
| Жидкость | Влажная почва, медицинские и косметические средства (мази, тушь, помада и т. д.) | |
| Твердое вещество | Горные породы, цветные стекла, некоторые сплавы |
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся на грубодисперсные (взвеси) с размерами частиц более 100 нм и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система – раствор. Она однородна, поверхности раздела между частицами и средой нет.
Дисперсные системы и растворы очень важны в повседневной жизни и в природе. Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета – наш общий дом – Земля; без клеток не было бы живых организмов и т.д.
ВЗВЕСИ
Взвеси – это дисперсные системы, в которых размер частицы фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсная среда легко разделяются отстаиванием, фильтрованием. Такие системы разделяются на:
- Эмульсии (и среда, и фаза – нерастворимые друг в друге жидкости). Из воды и масла можно приготовить эмульсию длительным встряхиванием смеси. Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т.д.
- Суспензии ( среда – жидкость, фаза – нерастворимое в ней твердое вещество).Чтобы приготовить суспензию , надо вещество измельчить до тонкого порошка, высыпать в жидкость и хорошо взболтать. Со временем частица выпадут на дно сосуда. Очевидно, чем меньше частицы, тем дольше будет сохраняться суспензия. Это строительные растворы, взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде – планктон, которым питаются гиганты – киты, и т.д.
- Аэрозоли взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различаются пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний – взвесь капелек жидкости в газе. Например: туман, грозовые тучи – взвесь в воздухе капелек воды, дым – мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига – клинкера. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающих изо рта больного гриппом, также вредные аэролози. Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопление облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, лечение дыхательных путей (ингаляция) – примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли – туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.
КОЛЛОИДНЫЕ СИСТЕМЫ
Коллоидные системы (в переводе с греческого “колла” – клей, “еидос” вид клееподобные) – это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсная среда в таких системах отстаиванием разделяются с трудом.
Из курса общей биологии вам известно, что частицы такого размера можно обнаружить при помощи ультрамикроскопа, в котором используется принцип рассеивания света. Благодаря этому коллоидная частица в нем кажется яркой точкой на темном фоне.
Их подразделят на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок – кариоплазма, содержимое органоидов и вакуолей). И живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки и т.д.) Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия (“растворимого стекла”) с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (III) в горячей воде.
Характерное свойство коллоидных растворов – их прозрачность. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля. Более крупные, чем в истинном растворе, частицы дисперсной фазы золя отражают свет от своей поверхности, и наблюдатель видит в сосуде с коллоидным раствором светящийся конус. В истинном растворе он не образуется. Аналогичный эффект, но только для аэрозольного, а не жидкого коллоида, вы можете наблюдать в лесу и в кинотеатрах при прохождении луча света от киноаппарата через воздух кинозала.
Пропускание луча света через растворы;
а – истинный раствор хлорида натрия; б – коллоидный раствор гидроксида железа (III).
Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Это объясняется тем, что вещества в коллоидном, т.е., в мелкораздробленном, состоянии обладают большой поверхностью. На этой поверхности адсорбируются либо положительно, либо отрицательно заряженные ионы. Например, кремниевая кислота адсорбирует отрицательные ионы SiO32-, которых в растворе много вследствие диссоциации силиката натрия:
Частицы же с одноименными зарядами взаимно отталкиваются и поэтому не слипаются.
Но при определенных условиях может происходить процесс коагуляции. При кипячении некоторых коллоидных растворов происходит десорбция заряженных ионов, т.е. коллоидные частицы теряют заряд. Начинают укрупняться и оседают. Тоже самое наблюдается при приливании какого-либо электролита. В этом случае коллоидная частица притягивает к себе противоположно заряженный ион и ее заряд нейтрализуется.
Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок – наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. При этом раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (клей, яичный белок) или при изменении кислотно-щелочной среды раствора.
2. Гели или студни представляют собой студенистые осадки, образующиеся при коагуляции золей. К ним относят большое количество полимерных гелей, столь хорошо известные вам кондитерские, косметические и медицинские гели (желатин, холодец, мармелад, торт “Птичье молоко”) и конечно же бесконечное множество природных гелей: минералы (опал), тела медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и т.д. Историю развития на Земле можно одновременно считать историей эволюции коллоидного состояния вещества. Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление называют синерезисом.
Выполните лабораторные опыты по теме (групповая работа, в группе по 4 человека).
Вам выдан образец дисперсной системы. Ваша задача: определить какая дисперсная система вам выдана.
Выдано учащимся: раствор сахара, раствор хлорода железа (III), смесь воды и речного песка, желатин, раствор хлорида алюминия, раствор поваренной соли, смесь воды и растительного масла.
Инструкция по выполнению лабораторного опыта
- Рассмотрите внимательно выданный вам образец (внешнее описание). Заполните графу № 1 таблицы.
- Перемешайте дисперсную систему. Понаблюдайте за способностью осаждаться.
Осаждается или расслаивается в течении несколько минут или с трудом в течении продолжительного времени, или не осаждаются. Заполните графу № 2 таблицы.
Если вы не наблюдаете осаждение частиц, исследуйте его на процесс коагуляции. Отлейте немного раствора в две пробирки и добавьте в одну 2–3 капли желтой кровяной соли и в другую 3–5 капель щелочи, что наблюдаете?
- Пропустите дисперсную систему через фильтр. Что наблюдаете? Заполните графу № 3 таблицы. (Отфильтруйте немного в пробирку).
- Пропустите через раствор луч света фонарика на фоне темной бумаги. Что наблюдаете? (можно наблюдать эффект Тиндаля)
- Сделайте вывод: что это за дисперсная система? Что является дисперсной средой? Что является дисперсной фазой? Каковы размеры частиц в нем? (графа №5).
| Внешний вид и видимость частиц | Способность осаждаться и способность к коагуляции | Способность задерживаться фильтрами | Наблюдение эффекта Тинделя | Название дисперной системы. Размеры частиц. |
| № 1 | № 2 | № 3 | № 4 | № 5 |
|
|
| Напишите синквейн (пятистишье), в котором выразите свое отношение к изученному материалу. |
Правила написания синквейна:
- В первой строчке одним словом (обычно существительным) называется тема.
- Вторая строчка – это описание этой темы двумя прилагательными.
- Третья строчка – это три глагола (или глагольные формы), называющие самые характерные действия предмета.
- Четвертая строчка – это фраза из четырех слов, показывающая личное отношение к теме.
- Последняя строка – это синоним темы, подчеркивающий её суть.
| Дома: Какие дисперсные системы перед Вами? Напишите эссе: “Какое значение имеют они для жизни человека?” |
Лето 2008 г. Вена. Шенбрунн.
Лето 2008 г. Нижегородская область.
Облака и их роль в жизни человека Вся окружающая нас природа – организмы животных и растений, гидросфера и атмосфера, земная кора и недра представляют собой сложную совокупность множества разнообразных и разнотипных грубодисперсных и коллоидных систем. Развитие коллоидной химии связано с актуальными проблемами различных областей естествознания и техники. На представленной картинке представлены облака – один из видов аэрозолей коллоидных дисперсных систем. В изучении атмосферных осадков метеорология опирается на учение об аэродисперсных системах. Облака нашей планеты представляют собой такие же живые сущности, как вся природа, которая нас окружает. Они имеют огромное значение для Земли, так как являются информационными каналами. Ведь облака состоят из капиллярной субстанции воды, а вода, как известно, очень хороший накопитель информации. Круговорот воды в природе приводит к тому, что информация о состоянии планеты и настроении людей накапливается в атмосфере, и вместе с облаками передвигается по всему пространству Земли. Облака – удивительное творение природы, которое доставляет человеку радость, эстетическое удовольствие. Краснова Мария, 11-й «Б» класс |
Р.S. Огромное спасибо Першиной О.Г., учителю химии МОУ гимназия “Дмитров”, на уроке работали с найденной презентацией, и она дополнялась нашими примерами.
xn--i1abbnckbmcl9fb.xn--p1ai
Классификация дисперсных систем — Мегаобучалка
Дисперсные системы.
Дисперсные системы широко распространены в природе и с давних времен используются человеком в его жизнедеятельности. Практически любой живой организм либо представляет собой дисперсную систему, либо содержит их в различных формах.
Пример: свободнодисперсные системы (нет сплошных жестких структур - золи): кровь, лимфа, желудочный и кишечный соки, спинномозговая жидкость и т.д.
связнодисперсные системы (есть жесткие пространственные структуры - гели): протоплазма, мембраны клеток, мышечное волокно, хрусталик глаза и т.д.
Дисперсные системы активно применяют в медицине, это в первую очередь коллоидные растворы, аэрозоли, кремы, мази. Биохимические процессы в организме протекают в дисперсных системах. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биожидкости (дисперсные системы) участвуют в транспорте питательных веществ (жиров, аминокислот, кислорода), лекарственных препаратов к органам и тканям, а также в выведении из организма метаболитов (мочевины, билирубина, углекислого газа).
Знание закономерностей физико-химических процессов в дисперсных системах важно будущим врачам как для изучения медико-биологических и клинических дисциплин, так и для более глубокого понимания процессов, протекающих в организме, и сознательного изменения их в желаемом направлении.
Дисперсные системы – это многокомпонентные системы, в которых одни вещества в виде мелких частиц распределены в другом веществе. Вещество, которое распределяется, называется дисперсной фазой. Вещество, в котором распределяется дисперсная фаза, называется дисперсионной средой.
Пример: водный раствор глюкозы
молекулы глюкозы – дисперсная фаза
вода – дисперсионная среда
Дисперсность – величина, характеризующая размер взвешенных частиц в дисперсных системах. Она обратна диаметру частиц дисперсной фазы. Чем меньше размер частиц, тем больше дисперсность.
Классификация дисперсных систем.
Дисперсные системы классифицируют по пяти признакам.
1. По степени дисперсности:
· грубодисперсные
Д = 104 – 106 м–1, характеризуются неустойчивостью, непрозрачностью.
Пример: суспензии, эмульсии, пены, взвеси.
· коллоидно-дисперсные
Д = 107 – 109 м–1, могут быть прозрачными и мутными, обладать устойчивостью и быть неустойчивыми.
Пример: коллоидные растворы, растворы высокомолекулярных соединений.
· молекулярно-дисперсные и ионно-дисперсные
Д = 1010 – 1011 м–1, характеризуются прозрачностью и устойчивостью.
Пример: растворы низкомолекулярных соединений.
2. По наличию физической поверхности раздела между дисперсной фазой и дисперсионной средой:
· гомогенные (однофазные системы, граница раздела отсутствует.
Пример: растворы низкомолекулярных и высокомолекулярных соединений.
· гетерогенные
существует граница раздела между дисперсной фазой и дисперсионной средой.
Пример: коллоидные растворы и грубодисперсные системы.
3. По характеру взаимодействия между дисперсной фазой и дисперсионной средой:
· лиофильные
между дисперсной фазой и дисперсионной средой существует сродство.
Пример: все гомогенные системы.
· лиофобные
между дисперсной фазой и дисперсионной средой слабое взаимодействие или отсутствует.
Пример: все гетерогенные системы.
4. По агрегатному состоянию дисперсной фазы и дисперсионной среды:
| дисп.фаза дисп.среда | газообразная | твердая | жидкая |
| газообразная | смесь газов (воздух) | табачный дым пыль мучная, космическая аэрозоли | туман пар облака |
| жидкая | растворенный в крови CO2, O2, N2, пены минеральные воды фруктовые газированные напитки | коллоидные растворы суспензии растворы ВМС растворы НМС | эмульсии: молоко масло сливочное маргарин кремы мази нефть |
| твердая | твердые пены (пенопласт, активированный уголь) ионообменные смолы молекулярные сита | сплавы металла цветные стекла, хрусталь драгоценные камни (рубин, аметист) суппозитории (лечебные свечи) | кристаллогидраты минералы с жидкими включениями (жемчуг, опал) влажные почвы |
5. По природе дисперсионной среды:
| среда | название | примеры |
| вода | гидрозоли | гидрозоль серебра, гидрозоль Fe(OH)3 |
| спирт | алказоли | алказоль хлорида натрия |
| бензол | бензозоли | бензозоль натрия |
| эфир | этерозоли | водорастворимые вещества в эфире |
| воздух | аэрозоли | распыленные лекарственные вещества |
Истинные растворы.
Истинный раствор – это гомогенная лиофильная дисперсная система с размерами частиц 10–10 – 10–11 м.
Истинные растворы – это однофазные дисперсные системы, они характеризуются большой прочностью связи между дисперсной фазой и дисперсионной средой. Истинный раствор сохраняет гомогенность неопределенно долгое время. Истинные растворы всегда прозрачны. Частицы истинного раствора не видны даже в электронный микроскоп. Истинные растворы хорошо диффундируют.
Компонент, агрегатное состояние которого не изменяется при образовании раствора, называют растворителем (дисперсионная среда), а другой компонент – растворенным веществом (дисперсная фаза).
При одинаковом агрегатном состоянии компонентов растворителем считается компонент, количество которого в растворе преобладает.
В растворах электролитов вне зависимости от соотношения компонентов электролиты рассматриваются как растворенные вещества.

Истинные растворы подразделяются:
· по типу растворителя: водные и неводные
· по типу растворенного вещества: растворы солей, кислот, щелочей, газов и т.д.
· по отношению к электрическому току: электролиты и неэлектролиты
· по концентрации: концентрированные и разбавленные
· по степени достижения предела растворимости: насыщенные и ненасыщенные
· с термодинамической точки зрения: идеальные и реальные
· по агрегатному состоянию: газообразные, жидкие, твердые
Истинные растворы бывают:
· ионно-дисперсные (дисперсная фаза – гидратированные ионы): водный раствор NaCl
· молекулярно-дисперсные (дисперсная фаза – молекулы): водный раствор глюкозы
Ионы каждый в отдельности или совместно выполняют определённые функции в организме. Решающая роль в переносе воды в организме принадлежит ионам Na+ и Cl–, т.е участвуют в водно-солевом обмене. Ионы электролитов участвуют в процессах поддержания постоянства осмотического давления, установления кислотно-щелочного равновесия, в процессах передачи нервных импульсов, в процессах активации ферментов.
С позиции живых систем наибольший интерес представляют растворы, в которых растворителем является вода.
В ней растворяется огромное число веществ. Она не только растворитель, который обеспечивает молекулярное рассеяние веществ по всему организму. Она также является участником многих химических и биохимических процессов в организме. Например, гидролиза, гидратации, набухания, транспорта питательных и лекарственных веществ, газов, антител и т.п.
В организме происходит непрерывный обмен воды и растворённых в ней веществ. Вода составляет основную массу любого живого существа. Её содержание в теле человека меняется с возрастом: у эмбриона человека – 97%, у новорождённого – 77%, у взрослых мужчин – 61%, у взрослых женщин – 54%, у стариков старше 81 года – 49,8%. Большая часть воды в организме находится внутри клеток (70%), около 23% – межклеточной воды, а остальная (7%) – находится внутри кровеносных сосудов и в составе плазмы крови.
Всего в организме 42 л воды. В сутки поступает в организм и выводится из него 1,5 – 3 л воды. Это нормальный водный баланс организма.
Главный путь выведения воды из организма – почки. Потеря 10 – 15% воды опасна, а 20 – 25% смертельна для организма.
Важнейшей характеристикой раствора является его концентрация.
Способы выражения концентрации растворов:
1. Массовая доля w(х) – величина, равная отношению массы растворённого вещества m(x) к массе раствора m(p-p)
w (x) = × 100%
2. Молярная концентрация раствора с(х) – величина, равная отношению количества вещества n(х), содержащегося в растворе, к объёму этого раствора V(р-р).
с(х) = [моль/л], где n(х) = [моль]
Миллимолярный раствор – раствор с молярной концентрацией равной 0,001 моль/л
Сантимолярный раствор – раствор с молярной концентрацией равной 0,01 моль/л
Децимолярный раствор – раствор с молярной концентрацией равной 0,1 моль/л
3. Молярная концентрация эквивалента с( x) – величина, равная отношению количества вещества эквивалента n( x) в растворе к объёму этого раствора.
c( x) = [моль/л], где n( x) = [моль], а М( x) = × М(x)
Эквивалент – это реальная или условная частица вещества х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной ОВР – одному электрону.
Число эквивалентностиz и фактор эквивалентности f = . Фактор эквивалентности показывает, какая доля реальной частицы вещества х эквивалентна одному иону водорода или одному электрону. Число эквивалентности z равно для:
а) кислот – основности кислоты h3SO4z = 2.
б) оснований – кислотности основания Aℓ(OH)3z = 3.
в) солей – произведению степени окисления (с.о.) металла на число его атомов в молекуле Fe2(SO4)3z = 2 × 3 = 6.
г) окислителей – числу присоединенных электронов
Mn+7 + 5ē → Mn+2z = 5
д) восстановителей – числу отданных электронов
Fe+2 – 1ē → Fe+3z = 1
4. Моляльная концентрация b(x) – величина, равная отношению количества вещества к массе растворителя (кг)
b(x) = = [моль/кг]
5. Молярная доля c(xi) равна отношению количества вещества данного компонента к суммарному количеству всех компонентов раствора
c(xi)=
Формулы взаимосвязи концентраций:
с( x) = c(x) × z
w(x) = × 100%
У растворов имеется ряд свойств, которые не зависят от природы растворенного вещества, а зависят только от его концентрации. Наиболее важным является осмос.
Благодаря осмосу через мембраны клеток органов и тканей осуществляется сложный процесс обмена веществ организма с внешней средой.
Диффузия – процесс самопроизвольного выравнивания концентрации в единице объема.
Осмос – односторонняя диффузия молекул растворителя через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
раствор растворитель
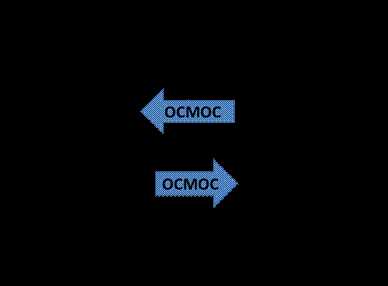
Перенос растворителя через мембрану обусловлен осмотическим давлением. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя. Обратный осмос имеет место при фильтрации плазмы крови в артериальной части капилляра и в почечных клубочках.
Осмотическое давление – давление, которое нужно приложить к раствору, чтобы осмос прекратился.
Уравнение Вант-Гоффа: Росм = cRT×103
Осмотическое давление крови: 780 – 820 кПа
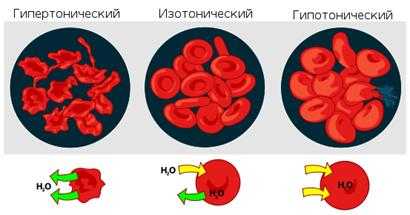
Все растворы, с точки зрения осмотических явлений, можно разделить на 3 группы:
· Изотонические растворы – растворы, имеющие одинаковые осмотические давления и осмолярные концентрации. Примеры: желчь, раствор NaCl (w=0,9%, с=0,15 моль/л), раствор глюкозы (w=7%, с=0,3 моль/л)
Осмолярная концентрация (осмолярность) – суммарное количество вещества всех кинетически активных частиц, содержащихся в 1 литре раствора. сосм, осмоль/л
Осмоляльная концентрация (осмоляльность) – суммарное количество вещества всех кинетически активных частиц, содержащихся в 1 кг растворителя. bосм, осмоль/кг
Для разбавленных растворов осмолярная концентрация совпадает с осмоляльной концентрацией. сосм ≈ bосм
· Гипертонический раствор – раствор с более высокой концентрацией растворенных веществ, следовательно, с более высоким осмотическим давлением по сравнению с другим раствором и способный при наличии проницаемых мембран вытягивать из него воду. Примеры: кишечный сок, моча.
· Гипотонический раствор – раствор с более низкой концентрацией растворенных веществ, следовательно, с более низким осмотическим давлением по сравнению с другим раствором и способный при наличии проницаемых мембран терять воду. Примеры: слюна, пот.
Животные и растительные клетки отделены от окружающей среды мембраной. При помещении клетки в различные по осмолярным концентрациям или давлениям растворы будут наблюдаться следующие явления:
· плазмолиз – уменьшение клетки в объеме. При этом клетку помещают в гипертонический раствор. Разность осмотических давлений вызывает перемещение растворителя из клетки в гипертонический раствор.
· лизис – увеличение клетки в объеме. При этом клетку помещают в гипотонический раствор. Разность осмотических давлений вызывает перемещение растворителя в клетку. В случае разрыва эритроцитарных мембран и перехода гемоглобина в плазму явление называется гемолизом.
· изоосмия – объем клетки не изменяется. При этом клетку помещают в изотонический раствор.
С помощью осмотических явлений поддерживается водно-солевой обмен в организме человека. Осмос – это основа механизма работы почек. Изотонический (физиологический) раствор NaCl (0,9%) используется при больших кровопотерях. Гипертонический раствор NaCl (10%) используют при накладывании марлевых повязок на гнойные раны.
Онкотическое давление – это часть осмотического давления, создаваемого белками.
В плазме крови человека составляет лишь около 0,5 % осмотического давления (0,03—0,04 атм или 2,5 – 4,0 кПа). Тем не менее, онкотическое давление играет важнейшую роль в образовании межклеточной жидкости, первичной мочи и др. Стенка капилляров свободно проницаема для воды и низкомолекулярных веществ, но не для белков. Скорость фильтрации жидкости через стенку капилляра определяется разницей между онкотическим давлением белков плазмы и гидростатическим давлением крови, создаваемым работой сердца. На артериальном конце капилляра солевой раствор вместе с питательными веществами переходит в межклеточное пространство. На венозном конце капилляра процесс идёт в противоположном направлении, поскольку венозное давление ниже онкотического давления. В результате в кровь переходят вещества, отдаваемые клетками. При заболеваниях, сопровождающихся уменьшением концентрации в крови белков (особенно альбуминов), онкотическое давление снижается, и это может явиться одной из причин накопления жидкости в межклеточном пространстве, в результате чего развиваются отёки.
 |
megaobuchalka.ru
Виды дисперсных систем - Справочник химика 21
| Таблица 7.1. Состав и виды дисперсных систем |
Внешний вид дисперсных систем и видимость частиц [c.82]
Дисперсии жидкостей в жидкостях называются эмульсиями, а газов в жидкостях — пенами дисперсии твердых и жидких частиц в газах называются аэрозолями. Свойства этих видов дисперсных систем описаны в главе седьмой. [c.24]
Коллоидные системы представляют собой частный вид дисперсных систем. К коллоидным относятся системы со сравнительно высокой степенью дисперсности размер частиц составляет от 10 до 2000 А. Таким образом, коллоидные системы по степени дисперсности частиц должны быть помещены между грубодисперсными системами и молекулярно-дисперсными, т. е. истинными растворами (в последних растворенное вещество находится в растворителе в виде отдельных молекул или ионов). В коллоидных системах частицы не могут быть обнаружены с помощью обычного микроскопа. Таким образом, коллоидные системы являются системами гетерогенными (точнее — микрогетерогенными), так как частицы дисперсной фазы составляют самостоятельную фазу, обладающую некоторой поверхностью, отделяющей ее от дисперсионной среды. Вследствие малого размера частиц общая поверхность их в коллоидных системах очень велика и составляет десятки, сотни и тысячи квадратных метров на грамм дисперсной фазы. Очень сильное развитие этой поверхности раздела и обусловливает особенности в свойствах, присущие коллоидным системам. [c.504]
Эмульсии — дисперсные системы, образованные двумя не смешивающимися между собой жидкостями, и пены, в которых дисперсная фаза — газ -- распределена в жидкой дисперсионной среде, по ряду свойств весьма близки друг к другу, вследствие чего эти два вида дисперсных систем обычно рассматриваются совместно. Общность многих свойств эмульсий и пен находит свое отражение и в применяющейся терминологии часто название эмульсия применяется только для разбавленных систем, независимо от того будут ли частицы дисперсной фазы являться жидкостью или газом (газовые эмульсии). [c.158]
Истинные растворы, т. е. полностью однородные системы, следует отличать от коллоидных растворов — одного из видов дисперсных систем, обладающих микрогетерогенностью (гл. 8). [c.170]
Виды дисперсных систем, с точки зрения наличия или отсутствия структуры [c.153]
Нефтяные масла рассматриваются в виде дисперсных систем. При этом установлено, что в зависимости от способа получения и соответственно вязкости масел, дистиллятных, остаточных, компаундированных в них образуются структурные элементы различного строения [ 10]. Наличием межмолекулярных взаимодействий между компонентами смесей парафино-нафтеновых и тяжелых ароматических углеводородов объясняется неподчинением правилу аддитивности таких их свойств, как диэлектрическая проницаемость и экстинкция. В некоторых работах [И] показано, что бензольное кольцо является специфическим центром межмолекулярных взаимодействий за счет чего ароматические углеводороды в растворах образуют ассоциаты, состав и устойчивость которых зависит от химического строения взаимодействующих молекул. В маслах и топливах обнаружены явления самоассоциации ароматических углеводородов и ассоциации их с присадками [ 12]. [c.35]
Чтобы было ясно, насколько важным является этот вид дисперсных систем, приведем примеры аэрозолей. Космическое пространство, атмосфера Земли, воздух, которым мы дышим, — все это аэрозоли. Аэрозоли возникают естественным путем, образуются искусственно и сопутствуют промышленному производству. [c.286]
При обобщении полученных закономерностей и распространении нх на другие виды дисперсных систем мы стремились не выходить за пределы имеющихся экспериментальных данных, исходя из того, что всякая истина распространенная за пределы ее действительной применимости, может быть доведена до абсурда [396]. [c.169]
Коллоидные растворы представляют собой частный вид дисперсных систем. По степени дисперсности твердых веществ, находящихся в воде, их принято делить на грубодисперсные, коллоидные и истинно растворенные. Средний размер частиц в таких системах находится в следующих пределах [c.74]
Подробные исследования агрегативной устойчивости газовых эмульсий в вязких полимерных жидкостях выполнены в работах [24, 25, 27, 161, 162], в которых показано, что устойчивость этих видов дисперсных систем в первую очередь зависит от прочности поверхностной адсорбционной пленки полимера на границе раз- [c.88]
Подробно процессы перераспределения частиц по размерам вследствие явлений молекулярного переноса (диффузионного массообмена) рассмотрены почти исключительно на примере трех видов дисперсных систем — суспензий, эмульсий и аэрозолей [24, 25, 54, 163—167]. Другие виды дисперсных систем, в том числе газовые эмульсии, в этом отношении почти не изучены. [c.90]
Коллоидные системы можно рассматривать как частный вид дисперсных систем. Дисперсными системами называют такие, в которых одно вещество распределено в среде другого вещества в виде очень мелких частиц (хотя и не всегда таких мелких, как в коллоидных системах). Термины дисперсная фаза и дисперсионная среда могут применяться и в этом более общем случае. [c.350]
К отдельным видам дисперсных систем относятся суспензии и эмульсии. [c.235]
Коллоидный раствор (или золь) — один из видов дисперсных систем. Это такая дисперсная система, в которой дисперсионной средой является жидкость, а дисперсная фаза состоит из мельчайших частичек, имеющих размеры от 0,001 до 0,1 х. Коллоидный раствор есть дву фазная система. [c.236]
Если смешать два веш,ества таким образом, что одно из них будет равномерно распределено в другом в виде отдельных частиц, то образуется система, которая называется дисперсной. Дисперсные системы могут быть образованы из вещества различного агрегатного состояния твердого и жидкого, жидкого и газообразного, газообразного и твердого, жидкого и жидкого и т. д. Всего может образоваться девять различных видов дисперсных систем из числа сочетаний пар трех агрегатных состояний. [c.145]
Дисперсными системами называют такие, в которых одно вещество распределено в среде другого вещества в виде очень мелких частиц (хотя и не всегда таких мелких, как в коллоидных системах). Термины дисперсная фаза и дисперсионная среда могут применяться и в этом более общем случае. Коллоидные системы можно рассматривать как частный вид дисперсных систем. Следовательно, коллоидные системы являются системами гетерогенными. В коллоидных системах дисперсная фаза бывает равномерно распределена по всему объему дисперсионной среды в виде частиц настолько малого размера, что они не могут быть обнаружены не только невооруженным глазом, но и с помощью обычного микроскопа. [c.387]
В зависимости от агрегатного состояния дисперсионной среды и дисперсной фазы выделяют следующие основные виды дисперсных систем [c.244]
Виды дисперсных систем [c.23]
Основные виды дисперсных систем, содержащих твердые фазы, и образующихся в них структур [c.54]
Как следует из сравнительного рассмотрения основных видов дисперсных систем, отличающихся концентрацией и размером частиц дисперсной фазы, каждая из них характеризуется комплексом специфических свойств, что и определяет специфику управления этими свойствами. [c.52]
С учетом изложенного все виды дисперсных систем, отличающихся концентрацией и размером частиц дисперсной фазы, можно было бы разделить по дисперсности на три основные группы коллоидно-дисперсные (б м), микрогетерогенные, со- [c.52]
Главная отличительная особенность вибрации как одного из видов механических воздействий — возможность передачи большого импульса энергии системе при малой амплитуде ее смещения за период колебаний. Именно поэтому вибрация нашла широкое применение в самых различных областях современной техники и технологии, в том числе при переработке различных видов дисперсных систем как метод интенсификации ряда технологических процессов. [c.85]
Поэтому целесообразно в обобщенном виде сформулировать основы этих методов, учитывая при этом, что в предыдущих главах для каждого из рассмотренных видов дисперсных систем (по типу контактов и агрегатному состоянию) были определены условия регулирования структурно-реологических свойств, а также определены параметры, соответствующие оптимальному уровню разрушения структуры [c.299]
В зависимости от дисперсиости твердой фазы суспензии подразделяют на грубые (диаметр частиц более 100 мкм), тонкие (от 100 до 0,5 мкм) и мути (от 0,5 мкм до 100 нм). Иногда в эту классификацию включают золи (коллоидные растворы) с размерами частиц менее 100 нм, хотя по ряду специфических признаков они представляют качественно отличающийся вид дисперсных систем. [c.185]
Исходя из приведенного определения, можно отметить, что эмульсии представляют собой особьи вид дисперсных систем, обе фазы которыхявляются взаимно нерастворимыми или плохо растворимыми жидкостями. Этим обстоятельством обусловлено специфическое свойство эмульсий обра.зовывать системы со сферическими частицами дисперсной фа.зы в широком диапазоне ее концентраций (от 0.001 до 74 и более % масс.) и их способность к обращению фаз. Возможно получение так называемых высококонцентрированных эмульсий с содержанием дисперсной фазы выше 74% масс., в которых элементы внутренней фазы деформированы в различной формы многогранники, а дисперсионная среда выступает прослойкой между ними. Такие эмульсии по структуре и свойствам близки к пенам, поэтому они и получили название спумоидные (т.е. пенообразные) эмульсии. [c.12]
Формально суспензии от лиозолей (коллоидных растворов) отличаются только размерами частиц дисперсной фазы. Размеры твердых частиц в суспензиях (более 10 см) могут быть на несколько порядков больше, чем в лиозолях (10" -10" см). Это количественное различие обусловливает чрезвычайно важную особенность суспензий в большинстве суспензий частички твердой фазы не участвуют в броуновском движении. Поэтому свойства суспензий существенно отличаются от свойств коллоидных растворов их рассматривают как самостоятельный вид дисперсных систем. [c.194]
Таким образом, проведенный краткий анализ показывает, что переконденсационные процессы, приводящие к укрупнению частиц дисперсной фазы путем перетока вещества через дисперсионную среду от меньших частиц к более крупным, протекают в той или иной мере практически во всех видах дисперсных систем с различным агрегатным состоянием дисперсной фазы и дисперсионной среды. [c.18]
Газовые эмульсии — это пока малоизученный вид дисперсных систем, у которых дисперсная фаза — пузырьки газа, а дисперсионная среда — жидкость. Их свойства во многом отличаются от свойств как концентрированных газовых дисперсных систем — пен, так и обычных эмульсий типа жидкость в жидкости . Содержание газовой дисперсной фазы в газовых эмульсиях обычно составляет не более нескольких пропентов, редко достигая десятков процентов. В качестве примерного критерия отнесения дисперсной системы к газовым эмульсиям можно указать значительную толщину прослоек мелопределенной мере независимо друг от друга. Вследствие этого газовые эмульсии обладают текучестью, аналогичной текучести других жидкостей. [c.3]
Во всех видах дисперсных систем, содержащих частицы дисперсной фазы разных размеров, происходит перераспределение частиц по размерам, обусловленное диффузионным массообме-ном. Этн процессы носят название изотермической перегонки , переконденсации , оствальдова созревания и др. В основе их механизма лежит то обстоятельство, что давление паров мелких капель или растворимость мелких частиц дисперсной фазы больше, чем крупных. Действительно, приведенные ранее (раздел 1.3) термодинамические закономерности образования, роста и растворения частиц дисперсной фазы показывают, что частицы дисперсной фазы тем стабильнее, чем они крупнее. [c.89]
Реологические свойства газовых эмульсий, особенно при малом газосодержапии, во многом подобны свойствам других видов дисперсных систем и описываются аналогичными уравнениями. Однако эти зависимости справедливы только до тех пор, пока газовые пузырьки можно считать недеформируемыми шариками. [c.109]
Следует различать две разновидности дисперсных систем. Одна разновидность характерна тем, что в ее состав входят, главным образом, минеральные частицы. К такого рода системам относятся песчаные пульпы. Второй вид дисперсных систем содержит частицы преимущественно органического происхождения. К ним относятся осадки сточных вод, торфо масса, озерный ил, меловые суспензии и т. д. Системы органического происхож-. дения обладают способностью образования коллоидных растворов. Глинистые частицы хотя и минерального происхождения, но также часто образуют коллоидные растворы. [c.5]
chem21.info











