§2. Понятие о химическом эквиваленте и факторе эквивалентности. Эквивалент химия формулы
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Например, рассмотрим следующую реакцию:
h4PO4 + 2KOH ® K2HPO4 + 2h3O.
В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н+ (кислота проявляет основность 2). Тогда по определению эквивалентом h4PO4 будет являться условная частица 1/2h4PO4, т.к. если одна молекула h4PO4 предоставляет два иона Н+, то один ион Н+ дает половина молекулы h4PO4.
С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
|
fЭ (формульная единица вещества) º эквивалент |
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между h4PO4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
h4PO4 + 3KOH ® K3PO4 + 3h3O fЭ(h4PO4) = 1/3
h4PO4 + KOH ® KН2PO4 + h3O fЭ(h4PO4) = 1.
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 – Расчет фактора эквивалентности
|
Частица |
Фактор эквивалентности |
|
|
Элемент |
, где В(Э) – валентность элемента |
|
|
Простое вещество |
, где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента |
fЭ(h3) = 1/(2×1) = 1/2; fЭ(O2) = 1/(2×2) = 1/4; fЭ(Cl2) = 1/(2×1) = 1/2; fЭ(O3) = 1/(3×2) = 1/6 |
|
Оксид |
, где n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента |
fЭ(Cr2O3) = 1/(2×3) = 1/6; fЭ(CrO) = 1/(1×2) = 1/2; fЭ(h3O) = 1/(2×1) = 1/2; fЭ(P2O5) = 1/(2×5) = 1/10 |
|
Кислота |
, где n(H+) – число отданных в ходе реакции ионов водорода (основность кислоты) |
fЭ(h3SO4) = 1/1 = 1 (основность равна 1) или fЭ(h3SO4) = 1/2 (основность равна 2) |
|
Основание |
, где n(ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания) |
fЭ(Cu(OH)2) = 1/1 = 1 (кислотность равна 1) или fЭ(Cu(OH)2) = 1/2 (кислотность равна 2) |
|
Соль |
, где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка |
fЭ(Cr2(SO4)3) = 1/(2×3) = 1/6 (расчет по металлу) или fЭ(Cr2(SO4)3) = 1/(3×2) = 1/6 (расчет по кислотному остатку)
|
|
Частица в окислительно-восстановительных реакциях |
, где – число электронов, участвующих в процессе окисления или восстановления |
Fe2+ + 2® Fe0 fЭ(Fe2+) =1/2;
MnO4– + 8H+ + 5 ® ® Mn2+ + 4h3O fЭ(MnO4–) = 1/5 |
|
Ион |
, где z – заряд иона |
fЭ(SO42–) = 1/2 |
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl2, б) КНСО3, в) (MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl2 (средняя соль):
.
fЭ(ZnCl2) = 1/2, поэтому эквивалентом ZnCl2 является частица 1/2ZnCl2.
б) КНСО3 (кислая соль):
.
fЭ(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) (MgOH)2SO4 (основная соль):
.
fЭ( (MgOH)2SO4 ) = 1/2, поэтому эквивалентом (MgOH)2SO4 является частица 1/2(MgOH)2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества nэ. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
Молярная масса эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
|
МЭ(оксида) = МЭ(элемента) + МЭ(О) = МЭ(элемента) + 8 МЭ(кислоты) = МЭ(Н) + МЭ(кислотного остатка) = 1 + МЭ(кислотного остатка) МЭ(основания) = МЭ(Ме) + МЭ(ОН) = МЭ(Ме) + 17 МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка). |
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента ( или VЭ) – объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента. Размерность «л/моль». При н.у. получаем:
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам. Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
|
nэ(реагента1) = … = nэ(реагентаn) = nэ(продукта1) = … = nэ(продуктаn) |
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
где m1 и m2 – массы реагентов и (или) продуктов реакции, г;
, – молярные массы эквивалентов реагентов и (или) продуктов реакции, г/моль;
V1, V2 – объемы реагентов и (или) продуктов реакции, л;
,– молярные объемы эквивалентов реагентов и (или) продуктов реакции, л/моль.
Л.А. Яковишин
Химический эквивалент. Расчетные задачи
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
МОСКОВСКИЙ ЭНЕРГЕТИЧЕСКИЙ ИНСТИТУТ
(ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ)
В.К.Камышова, И.Л.Волчкова
Методическое пособие для студентов 1-го курса всех направлений
Москва Издательство МЭИ 2010
ВВЕДЕНИЕ
К началу XIX века произошел резкий прорыв в изучении количественных методов исследования веществ, что привело к новому фундаментальному изменению в естествознании вообще и в химии в частности.
Резкий прорыв в изучении количественных методов исследования веществ в началу XIX века привел к новому фундаментальному изменению в естествознании вообще и в химии в частности.
После открытия Лавуазье закона сохранения массы последовал целый ряд новых количественных закономерностей – стехиометрических законов.
Первым стехиометрическим законом стал закон эквивалентов, который сформулировал немецкий химик Иеремия Вениамин Рихтер в результате проведенных им в 1791-1798 г.г. опытов по изучению количеств веществ в реакциях нейтрализации и обмена, обобщенных в работе «Начальные основания стехиометрии или искусства измерения химических элементов». Первоначальная формулировка закона эквивалентов (термин «эквивалент» ввел в 1767 г. Г.Кевендиш) была следующей: «Если одно и то же количество какой либо кислоты нейтрализуется различными количествами двух оснований, то эти количества эквивалентны и нейтрализуются одинаковым количеством любой другой кислоты».
Открытый В.Рихтером закон подтвердил убеждения многих химиков в том, что химические соединения взаимодействуют не в произвольных, а в строго определенных количественных соотношениях.
Теоретическая часть
Понятие «химический эквивалент»
Химическим эквивалентом (Э(В)) (по рекомендациям ИЮПАК) называется условная или реальная частица, равная или в целое число раз меньшая соответствующей ей формульной единице*:
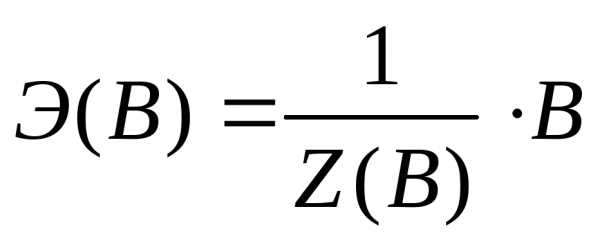
где В – формульная единица вещества: реально существующая частица, такая как атом (Cu, Na, C), молекула (N2, HCl, KOH, Al2(SO4)3, CO2), анионы (OH-, SO42-), катионы (Cu 2+, K+), радикалы (-NО2, С2Н5-), условные молекулы кристаллических веществ и полимеров, любые другие частицы вещества;
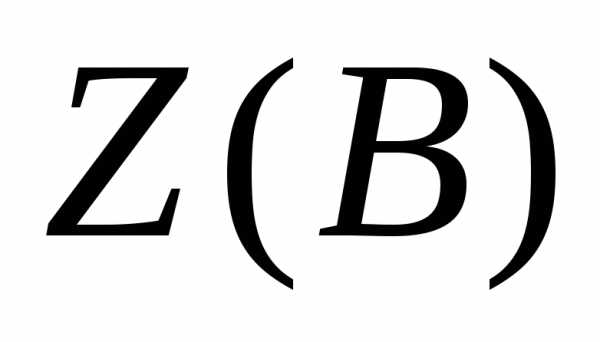 - эквивалентное число, показывающее какое число эквивалентов вещества В условно содержится в данной формульной единице этого вещества;
- эквивалентное число, показывающее какое число эквивалентов вещества В условно содержится в данной формульной единице этого вещества;
 = fэкв. - фактор эквивалентности.
= fэкв. - фактор эквивалентности.
Использование фактора эквивалентности как дробной величины менее удобно.
Эквивалентное число Z всегда больше или равно 1 и является безразмерной величиной; при Z=1 эквивалент соответствует формульной единице вещества.
Расчет эквивалентного числа различных формульных единиц представлен в таблице 1.1.
Величины эквивалентного числа, а, следовательно, и эквивалента зависят от химической реакции, в которой участвует данное вещество.
* ранее под химическим эквивалентом понимали количество вещества, которое присоединяет или замещает 1 моль атомов водорода в ходе реакции. Однако это понятие относится не к самому эквиваленту, а к количеству вещества эквивалента.
В обменных реакциях, например, в реакции нейтрализации фосфорной кислоты, эквивалентное число (эквивалент) кислоты меняется в зависимости от полноты протекания реакции:
для реакции h4PO4 + 3KOH → K3PO4 + 3h3O эквивалентное число Z(h4PO4)= =n(Н+)=3, т.к. в реакции участвуют три иона Н+ фосфорной кислоты, и эквивалентом h4PO4 будет являться условная частица 1/3h4PO4 (Э (h4PO4)= 1/3h4PO4).
Таблица 1.1. Расчет эквивалентного числа Z вещества.
| частица | эквивалентное число Z | Пример |
| Элемент | Z(Э) = В(Э), где В(Э) – валентность элемента | Z(S)h3SO4 = 6 Z(C)CO2 = 4 |
| Простое вещество | Z(в-ва) = n(Э)∙В(Э), где n(Э) – число атомов элемента В(Э) – валентность элемента | Z(O2) = 2∙2=4 Z(Cl2) = 2∙1=2 |
| Оксид | Z(Э2Ох) = n(Э)∙В(Э), где n(Э) – число атомов элемента В(Э) – валентность элемента | Z(Н2О) = 2∙1=2 Z(SО2) = 1∙4=4 Z(Al2О3) = 2∙3=6 |
| Кислота | Z(к-ты) = n(Н+), где n(Н+) – число отданных в ходе реакции ионов Н+ (основность кислоты) | Z(Н2SО4) = 1 – основность равна 1 Z(Н2SО4) = 2 – основность равна 2 |
| Основание | Z(осн-я) = n(ОН-), где n(ОН-) – число отданных в ходе реакции гидроксид ионов ОН- (кислотность основания) | Z(Са(ОН)2 = 1 – кислотность равна 1 Z(Са(ОН)2) =2 – кислотность равна 2 |
| Соль | Z(соли) = n(Ме)∙В(Ме) = n(А)∙В(А), где n(Ме), В(Ме) – число атомов металла и его валентность n(А), В(А) – число кислотных остатков и их валентность | Z(Na2SО4) = 2∙1=1∙2=2 Z(Al2(CO3)3) = 2∙3=3∙2=6 |
| Частица в ОВР | Z(частицы) = nе, где n е – число электронов, участвующих в процессе, на одну формульную единицу | SO42-+2H++ +2e→SO32-+h3O Z(SО42-)=2, Z(H+)=1 2Cl- - 2e→Cl2 Z(Cl-)=1, Z(Cl2)=2 |
| ион | Z(иона) = n, где n– заряд иона | Z(SО42-) = 2 |
В реакции h4PO4 + KOH → KН2PO4 + h3O замещается только один ион водорода Н+ и поэтому Z(h4PO4)=1, а эквивалентом кислоты является частица h4PO4 (Э(h4PO4)= 1h4PO4).
Эквивалентное число (эквивалент) элемента также может меняться в зависимости от вида соединения, в состав которого он входит. Например, в оксиде Cr2O3 эквивалентное число хрома Z(Cr)=3 и, следовательно, эквивалентом хрома является условная частица 1/3Cr, а в хромовой кислоте Н2CrО3 эквивалентное число хрома Z(Cr)=6, а эквивалент Э(Cr)=1/6Cr.
В обменных реакциях эквивалентное число (эквивалент) определяется стехиометрией реакции. Например,
Cr2(SO4)3 + 12KOH → 2K3[Cr(OH)6] + 3K2SO4
на одну формульную единицу Cr2(SO4)3 затрачивается 12 формульных единиц КОН. Следовательно, эквивалентное число Z(Cr2(SO4)3)=12, а Z(КОН)=1. Эквивалентом Cr2(SO4)3 будет являться условная частица 1/12 Cr2(SO4)3, а Э(КОН)=1КОН.
Для установления значений эквивалентных чисел Z(В) по уравнениям реакций обмена достаточно найти наименьшее общее кратное всех стехиометрических коэффициентов в уравнении реакции и разделить их на него. В рассматриваемом выше уравнении наименьшее общее кратное равно 12:
1/12Cr2(SO4)3 + KOH → 1/6K3[Cr(OH)6] + 1/4K2SO4
Для данной реакции эквивалентные числа равны: Z(Cr2(SO4)3)=12, Z(КОН)=1, Z(K3[Cr(OH)6])=6, а Z(K2SO4)=4.
В окислительно-восстановительных реакциях эквивалентные числа окислителя и восстановителя определяются числом электронов, которое принимает одна формульная единица окислителя или отдает одна формульная единица восстановителя.
Для окислительно-восстановительной реакции
K2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7h3O
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7h3O 6 1
2Cl- - 2e → Cl2 3
Эквивалентные числа определяют по числу электронов, участвующих в соответствующих полуреакциях, в расчете на одну формульную единицу Cr2O72-, Cr3+, Cl-, Cl2, то есть Z(Cr2O72-)=6, Z(Cr3+)=3, Z(Cl-)=1, Z(Cl2)=2. Соответственно эквивалентные числа веществ также будут равны: Z(К2Cr2O7)=6, Z(Cr Cl3)=3, Z(НCl)=1.
studfiles.net
формула и формулировка. Закон эквивалентов в химии :: SYL.ru
В конце XVIII века были получены эмпирическим путем многие законы химии. Ими можно было пользоваться и применять их на практике, но точное доказательство было получено лишь много десятилетий спустя. Одним из таких столпов современной химии стал закон эквивалентов, который напрямую связан с другими фундаментальными законами - законом сохранения массы и правилом кратных отношений.
Предыстория
Основанием для нового положения стал уже известный в конце XVIII века закон постоянного состава, позднее названный законом сохранения массы. Благодаря ему было выяснено, что различные химические вещества могут взаимодействовать не произвольно, а в строго определенных пропорциях. Поэтому в химическом лексиконе появились слово «эквивалентность». Новое понятие в переводе на русский язык означало «равноценность». Это был первый шаг к созданию правила, которое позднее стало известно как закон эквивалентов. Многочисленные эксперименты позднее неоднократно подтверждали теоретическую догадку.
Новое правило
Закон эквивалентов в химии несколько раз менял свою формулировку. В современных учебниках он записывается следующим образом:
- «Эквивалентом любого элемента считают такое его количество, которое может соединиться с одним молем водорода».
Такая формулировка закона эквивалентов универсальна и используется в школьной химии и в серьезных научных экспериментах. Например, для известного соединения HCl эквивалент хлора соответствует одному молю, в соединения h3S, h3O эквиваленты для серы и кислорода будут равны ½ моля и так далее. В соединениях вида HnX, где H – водород, X – другой химический элемент, n – количество водорода в молекуле, эквивалент элемента X всегда будет равен 1/n моль. Данный закон эквивалентов в химии распространяется и на простые вещества, в которых водород взаимодействует с одним элементом, и на соединения, в которых водород соседствует со множеством других атомов.
Эквивалентная масса
Выводом из нового закона стало новое понятие массы. Новый термин стал очень удобен для измерения изменения вещества в реакциях. Эквивалентной массой стали называть массу 1 эквивалента. Так, закон эквивалентов предсказывает массу другого элемента даже без лабораторных исследований. На приведенном примере соединения соляной кислоты эквивалентная масса хлора равна 34,45 г/моль. В соединении h3O эквивалентная масса кислорода будет равна 16 : 2 = 8 г/моль и так далее.
Как это можно вычислить
Эквивалентную массу можно высчитать методом анализа полученных соединений. Необязательно при этом исследуемое вещество соединять с водородом для вычисления эквивалентной массы. Закон эквивалентов подтверждает, что достаточно знать состав соединения данного элемента и эквивалентную массу другого элемента, с которым соединяется наш неизвестный образец. Примером нахождения эквивалента может служить следующая задача:
Соединение 3 г натрия с избытком хлора образовало 7,62 г поваренной соли (хлорида натрия). Узнайте эквивалентную массу натрия, если ЭCl = 35,45 г/моль.
Из условия задачи следует, что в продукте реакции – поваренной соли на 3 г натрия приходится 7,62 – 3 = 4,62 г хлора. Отсюда следует вывод:
ЭNa = 3 × 35,45 : 4,62 = 23 г/моль.
Молярная масса натрия легко определяется из таблицы Менделеева. Она равна 23 г/моль. Отсюда следует, что эквивалентная масса натрия равна одному молю.
Сложные элементы
Окружающая нас живая и неживая природа состоит из множества различных веществ, и большинство из них являются сложными. Поэтому часто эквиваленты определяются по-разному, в зависимости от того, из состава какого соседнего вещества они были получены. Но во всех исследуемых случаях различные эквиваленты относились друг к другу как целые малые числа. К примеру, достаточно взять такие известные соединения, как оксид и диоксид серы. Эквивалентные массы этого элемента, вычисленные вышеприведенным способом, дают значения 16 г/моль и 32 г/моль. Но соотношение этих значений сводится к простому виду 1:2.
Данное правило было выведено эмпирическим путем знаменитым английским химиком, врачом и естествоиспытателем Джоном Дальтоном. Учитель-самоучка, ставивший диковинные эксперименты поначалу приводил в испуг слуг и смешил соседей. Тем не менее, ставя свои незатейливые опыты, он подтвердил многие научные предположения. Закон кратных отношений был впервые сформулирован именно им.

Закон эквивалентов распространяется и на сложные соединения, в которых взаимодействуют несколько элементов. Понятие эквивалента для одного из элементов в сложном соединении перестает быть однозначным. Для таких соединений формулировка закона эквивалентов звучит немного иначе: "В качестве эквивалента сложного вещества используется такое его количество, которое будет участвовать в химической реакции без остатка с одним эквивалентом элемента или сложного соединения, либо же с одним эквивалентом водорода". 
Это правило используется повсеместно. Если убрать громоздкие определения, его можно свести к следующему положению: "Различные вещества могут вступать в реакции только в тех количествах, которые пропорциональны их эквивалентам".
Растворы
При изучении и составлении растворов все вышеперечисленные законы применимы в полной мере. Здесь роль эквивалента играет новая единица, которая носит название г/ эквивалент. Так называется количество вещества, одна частица которого (атом или ион) химически равноценна атому или иону водорода. Таким образом, закон эквивалентов для растворов звучит аналогично классическому определению.

Общий закон эквивалентов
Формула эквивалентов различных соединений в общем случае выглядит так:
- Э = Молярная масса / (число атомов элемента × валентность).
Как можно видеть, эквивалентность находится в прямой зависимости от молярной массы вещества и от его валентности. При наличии у химика информации об эквивалентах неизвестных элементов он может определить его способность вступать в химические реакции. При известном количестве грамм/эквивалентов вещества ученый может сразу сделать вывод о концентрации и свойствах того или иного раствора.
Стехиометрия
Количественному составу веществ и их соотношениям в соединениях посвящен отдельных раздел химии, называемых стехиометрией. Задачи этого раздела теоретической химии состоят в расчете количественных соотношений в соединениях. Для простых веществ это довольно просто, а для сложных – белков или вирусов, стехиометрические расчеты становятся очень трудной задачей.
www.syl.ru
1.2. Расчеты эквивалентов
Эквивалент (Э) - это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода (Н+) в ионообменных реакциях или одному электрону (е-) в окислительно-восстановительных реакциях.
Например, в реакции:
NaOH + HCl = NaCl + h3O
эквивалентом будет реальная частица - ион Na+, в реакции
Zn(OH)2 + 2HCl = ZnCl2 + 2h3O
эквивалентом будет являться условная (мнимая) частица 1/2Zn(OH)2.
Так же, как в случае молекул, атомов или ионов, эквивалент описывают с помощью химических формул. Например, гидроксид калия во всех обменных реакциях может присоединять один ион водорода, следовательно, эквивалентом гидроксида калия будет молекула КОН. Э={КОН}. Эквивалентом соляной кислоты в ионообменных реакциях будет НСl. Э={НСl}. Цинк может окисляться только до Zn2+, следовательно, в окислительно-восстановительных реакциях эквивалентом цинка будет условная величина, половина его атома или иона, Э=1/2{Zn}. Для фосфорной кислоты Э=1/3{Н3РО4}. Это химическая формула эквивалента.
Число, обозначающее, какая доля от реальной частицы эквивалентна одному иону водорода или одному электрону, получила название фактора эквивалентности, fЭ.
Так, в рассматриваемых случаях эквивалентом гидроксида калия будет молекула КОН и fЭ(КОН) = 1, fЭ(НСl) = 1, а эквивалентом иона Zn2+ будет половина иона Zn2+, fЭ(Zn) = 1/2.
Масса одного моля эквивалентов называется молярной массой эквивалентов вещества (эквивалентной массой) МЭ . Она рассчитывается, как произведение фактора эквивалентности на молярную массу вещества:
МЭ =fЭ∙М (г/моль) (1)
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей.
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента, VЭ, (или эквивалентный объем) - объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента.
Он измеряется в литрах и вычисляется (при н.у., Т0 = 273 К, Р0 = 760 мм рт. ст. или 101,3 кПа), как произведение фактора эквивалентности на молярный объем газа:
VЭ = fЭ∙Vм = fЭ∙22,4 (л) (2)
Физический смысл эквивалента заключается в том, что эквивалент характеризует реакционные возможности вещества: сколько именно ионов водорода или эквивалентных ему однозарядных частиц может использовать молекула (ион) вещества в ионообменных реакциях, или сколько именно электронов потребуется для превращения этой молекулы (иона) в окислительно-восстановительных реакциях (ОВР).
Максимальное содержание эквивалентов в молекуле вещества, как в ионообменных реакциях, так и в ОВР можно определить по формулам, рассматривая состав соединения.
Пример 1. В обменных реакциях при максимальном содержании эквивалентов в молекуле определить: а) фактор эквивалентности, fЭ; б) химическую формулу эквивалента, Э; в) молярную массу эквивалентов, МЭ, для следующих веществ из классов кислот, оснований и солей: Н3РО4, Са(ОН)2, Аl2(SО4)3
Решение: Для кислот, оснований и солей фактор эквивалентности в обменных реакциях при максимальном содержании эквивалентов в молекуле определяется по формуле: 1
fЭ = —— (3) n∙z
где n - число функциональных групп в молекуле,
z - абсолютная величина заряда функциональной группы.
Функциональными группами в кислотах являются ионы водорода, в основаниях - ионы гидроксила, в солях - ионы металла. Конечно, в кислых солях также ионы Н+, а в основных - ОН-, в зависимости от реакции. Таким образом:
для Н3РО4 а) fЭ = 1/3, б) Э = 1/3{Н3РО4},
в) МЭ = fЭ∙М(Н3РО4) = 1/3(3,0 + 31,0 + 4∙16,0) = 98,0/3 = 32,7 г/моль
для Са(ОН)2 а) fЭ = 1/2, б) Э = 1/2{Са(ОН)2},
в) МЭ = fЭ∙М(Са(ОН)2) = 1/2(40,1 + 2∙17,0) = 74,1/2 = 37,0 г/моль.
для Аl2(SО4)3 а) fЭ = 1/(2∙3) = 1/6, б) Э = 1/6{Аl2(SО4)3},
в) МЭ = fЭ∙М(Аl2(SО4)3) = 1/6(2∙27,0 + 3∙96,0) = 342/6 = 57,0 г/моль
Оксиды делятся на солеобразующие (кислотные, амфотерные, основные) и несолеобразующие. Для несолеобразующих (безразличных) оксидов СО, N2О, NО характерны окислительно-восстановительные реакции, (ОВР). В ОВР эквивалент всегда рассчитывается по изменению степени окисления.
Для солеобразующих оксидов в реакциях не ОВР фактор эквивалентности определяется по формуле (3) для кислот (оснований), ангидридом которых является данный оксид.
Пример 2. Определить в реакциях присоединения/разложения, не являющихся ОВР, а) фактор эквивалентности, fЭ; б) химическую формулу эквивалента, Э; в) молярную массу эквивалентов, МЭ, а для газов и г)объем моля эквивалентов, VЭ, при максимальном содержании эквивалентов в молекуле для следующих веществ из класса оксидов. СО2 - газ, СаО, Р2О5.
Решение: СО2 - кислотный оксид, является ангидридом двухосновной угольной кислоты Н2СО3, в соответствии с чем его фактор эквивалентности составляет 1/2.
а) fЭ = 1/2; б) Э = 1/2{СО2}, в) МЭ = fЭ∙МСО2 = 1/2 (12,0 + 2∙16,0) = 44,0/2 = 22,0 г/моль. Так как СО2 - газ, определяем еще объем моля эквивалентов (эквивалентный объем): г) VЭ = fЭ∙22,4 = 11,2 л.
СаО - основной оксид, являющийся ангидридом двухкис-лотного основания Са(ОН)2, в соответствии с чем его фактор эквивалентности составляет 1/2.
а) fЭ = 1/2, б) Э = 1/2{СаО}, в) МЭ = fЭ∙МСаО = 1/2(40,1 + 16,0) = 56,1/2 = 28,0 г/моль.
Р2О5 - кислотный оксид, дающий при взаимодействии с водой две молекулы трехосновной фосфорной кислоты Н3РО4. по реакции:
Р2О5 + 3Н2О = 2Н3РО4
Следовательно, одна молекула Р2О5эквивалентна 6 ионам водорода, в соответствии с чем, его фактор эквивалентности находится из формулы fЭ = 1/(2∙3) и составляет 1/6.
а) fЭ = 1/6, б) Э = 1/6{Р2О5},
в) МЭ = fЭ∙МР2О5 = 1/6(2∙31,0 + 5∙16,0) = 142/6 = 23,67 г/моль
Если дана конкретная реакция, то состав эквивалента следует определять из сопоставления начальных и конечных продуктов реакции.
В первую очередь следует определить, с каким типом реакции мы имеем дело: с окислительно-восстановительной реакцией (ОВР) или с не-ОВР. К последним относятся реакции, в которых не меняются степени окисления элементов, например, ионнообменные реакции и часть реакций разложения. Из определения эквивалента следует, что в зависимости от типа реакции, по разному определяется состав эквивалента вещества. В ионообменных реакциях (не-ОВР) надо рассматривать, сколько ионов водорода или эквивалентных ему частиц (Nа+, К+, ОН-, Сl- и т.д.) взаимодействует с рассматриваемым веществом. Напоминаем, что окислительно-восстановительными реакциями (ОВР), являются такие, в которых изменяются степени окисления (С.О.) элементов.
В ОВР для того, чтобы определить фактор эквивалентности и правильно записать химическую формулу эквивалента, надо определить С.О. окисляющегося или восстанавливающегося элемента в данном веществе до и после реакции и определить число электронов, перемещаемых в оболочке этого элемента. Согласно определению, эквивалент составит такую часть молекулы, которая приходится на 1 электрон. Никакого учета коэффициентов в реакциях при этом не требуется.
Пример 3. Определить: фактор эквивалентности, fЭ, химическую формулу эквивалента, Э, молярную массу эквивалентов, МЭ, и (для газов) молярный объем эквивалентов, VЭ, реагирующих веществ в следующих реакциях:
1. Аl(ОН)3 + 2НСl = АlОНСl2 + 2Н2О
2. 2Н2S(Г) + 3О2(Г) = 2SО2 + 2Н2О
Решение. Реакция 1 является ионообменной В ней Аl(ОН)3 превращается в АlОНСl2, т.е. в молекуле гидроксида алюминия замещаются два иона ОН-, каждый из которых эквивалентен одному иону водорода, на ионы Сl-. Следовательно, ее эквивалент в данной конкретной реакции составляет 1/2 молекулы Аl(ОН)3. fЭ=1/2; Э= 1/2{Аl(ОН)3}; МЭ = fЭ∙МАl(ОН)3 = 1/2(27,0 + 3∙17,0) = 39 г/моль.
Молекула НСl в любой ионообменной реакции может отдавать только 1 ион водорода Н+, следовательно, содержит 1 эквивалент. fЭ=1, Э = {НСl}. МЭ = fЭ∙МНСl = 1∙(1,0 + 35,5) = 36,5 г/моль.
Реакция 2 окислительно-восстановительная. В ней сера меняет свою С.О. от -2 (в Н2S) до +4 (в SО2). Перемещаются 6 электронов. Следовательно, в данной конкретной реакции молекула сероводорода содержит 6 эквивалентов. fЭ = 1/6, Э = 1/6{Н2S} МЭ = fЭ∙МН2S = 1/6(2,0 + 32,1) = 5,7 г/моль. Сероводород - газ. VЭ = fЭ∙22,4 = 3,73 л.
Кислород в реакции 2 меняет свою С.О. от 0 до -2. При этом у каждого атома кислорода перемещаются 2 электрона. В молекуле кислорода О2 неразрывно связаны 2 атома. Следовательно, молекула кислорода содержит 4 эквивалента. fЭ = 1/4, Э = ¼{О2} МЭ = fЭ∙МО2 = 1/4(2∙16) = 8 г/моль. Кислород - газ. VЭ = fЭ∙22,4 = 5,6 л.
Итак, обобщая вышеизложенный материал, расчет фактора эквивалентности для некоторых классов химических соединений можно представить в виде таблицы 1.
Таблица 1 - Расчет фактора эквивалентности
| Частица | Фактор эквивалентности | Примеры |
| Простое вещество | , где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента | fЭ(h3) = 1/(2×1) = 1/2; fЭ(O2) = 1/(2×2) = 1/4; fЭ(Cl2)= 1/(2×1) = 1/2; fЭ(O3) = 1/(3×2) = 1/6 |
| Оксид | , где n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента | fЭ(Cr2O3)=1/(2×3)= 1/6; fЭ(CrO) = 1/(1×2) = 1/2; fЭ(h3O) = 1/(2×1) = 1/2; fЭ(P2O5)=1/(2×5) = 1/10 |
| Кислота | , где n(H+) – число ионов водорода (основность кислоты) | fЭ(HCl) = 1/1 = 1 fЭ(h3SO4) = 1/2 fЭ(h4PO4) = 1/3 |
| Основание | , где n(ОH–) – число гидроксид-ионов (кислотность основания) | fЭ (KOH) = 1 fЭ (Cu(OH)2) = 1/2 |
| Соль | , где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка | fЭ(Cr2(SO4)3) = 1/(2 × 3) = 1/6(расчет по металлу) или fЭ(Cr2(SO4)3) = 1/(3 × 2) = 1/6(расчет по кислотному остатку) fЭ (ZnCl2) = 1/(1×2 ) =1/2 (расчет по металлу) fЭ (NaCl) = 1/(1 × 1 ) =1/2 (расчет по металлу) |
| Частица в окислительно-восстановительных реакциях | , где – число электронов, участвующих в процессе окисления или восстановления | Fe2+ + 2 → Fe0 fЭ(Fe2+) =1/2; MnO4–+8H++ 5 =Mn2+ + 4h3O fЭ(MnO4–) = 1/5 |
| Ион | ,где z – заряд иона | fЭ(SO42–) = 1/2 |
studfiles.net
§2. Понятие о химическом эквиваленте и факторе эквивалентности.
Одним из основных законов химии является закон эквивалентов:
Вещества вступают в химические реакции и образуются в результате химических реакций в количествах, пропорциональных их эквивалентам.
Закон эквивалентов широко используется для количественных расчетов, необходимых при проведении химических реакций, и математически может быть записан следующим образом : m1 : Э1 = m 2 : Э 2 (1),
где m1, m2 и Э1, Э2 соответственно массы и эквиваленты реагирующих веществ.
Для объемых отношений закон эквивалентов записывается таким образом:
N1V1=N2V2(2)
Преобразуя первое и второе выражение можем записать, что n 1 = n 2 где n- количество моль - эквивалентов реагирующих веществ, а это значит, что в точке эквивалентности количество моль-эквивалентов реагирующих и образующихся веществ равны. Для описания закона эквивалентов в химии широко используют понятие эквивалента и фактора эквивалентности.
Эквивалентом называют реальную или условную частицу вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции - одному электрону.
Например, в реакции:
аА + bB ↔ cC + dD
которую можно переписать в виде:
A + B ↔ C + D
условная частица В, равноценная одной частице А, является эквивалентом вещества В данной реакции.
Множитель f называют фактором эквивалентности вещества В и обозначают fэкв (В).
Фактор эквивалентности fэкв (Х) – число, обозначающее какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
fэкв (Х) = 1/z
Молярная масса эквивалента (размерность г/моль)- равна массе вещества, эквивалентной 1 молю водорода или 1 молю электронов в химической реакции. Численно равна эквиваленту вещества.
Молярная масса эквивалента равна молярной массе вещества, умноженной на фактор эквивалентности:
М(1/z X) = M(X) • fэкв (X) = M(X) / z
Существуют следующие формулы для определения молярных масс эквивалентов сложных веществ:
Кислоты:
М(Х)
М(1/z кислоты) = ---------------------------
Основность кислоты
М(НСl)
НС1 - f (НС1) =1 М(1/1 НС1) = -----------
1
M(h3SO4)
Н2SO4 - f (h3SO4 ) = ½ M(½ h3SO4) =---------------
2
M(h4PO4)
h4PO4 - f (h4PO4) = ⅓ M(⅓ h4PO4) = ---------------
3
Основания:
М(Х)
М(1/z основания) = -----------------------------
кислотность основания
M(NaOH)
NaOH - f (NaOH) = 1 M(NaOH) = --------------
1
M (Ba(OH)2
Ba(OH)2 - f (Ba(OH)2 =½ M(½ Ba(OH)2) = ----------------
2
M (Al(OH)3)
Al(OH)3 - f (Al(OH)3) = ⅓ M(⅓ Al(OH)3 )= ----------------
3
Соли:
М (Х)
М (1/z cоли) = ---------------------------------------------------
число атомов Ме • степень окисления Ме
M (K2SO4)
К2SO4 - f (K2SO4) = ½ M(½ K2SO4) = -------------
2
M ( CaCL2)
CaCl2 - f (CaCl2) = ½ M(½ CaCL2) = --------------
2
M(Fe2(SO4)3)
Fe2(SO4)3 - f ( Fe2(SO4)3) = 1/6 ; M(1/6 Fe2(SO4)3) = ------------------
6
Оксиды:
М (Х)
М (1/z оксида) = --------------------------------------------------------
число атомов эл-та • степень окисления эл-та
M(Na2O)
Na2O - f ( Na2O) = ½ M(½ Na2O) = -------------
2
M(NiO)
NiO - f (NiO) = ½ M(½ NiO) = ---------
2
M(N2O5)
N2O5- f (N2O5) = 1/10 M(1/10N2O5) = -----------
10
Пример 1:
Укажите фактор эквивалентности щавелевой кислоты в реакции:
Н2С2О4 + 2 NaOH ↔ Na2C2O4 + 2 h3O
Найдите молярную массу эквивалента щавелевой кислоты.
Решение:
В данной реакции одна молекула Н2С2О4 равноценна (соответствует, эквивалентна) двум ионам водорода, следовательно:
fэкв (Н2С2О4) = ½ , а молярная масса эквивалента кислоты:
М(Н2С2О4) 90
М(½ Н2С2О4) = ------------- = ---- = 45 (г/моль)
2 2
Пример 2:
Укажите факторы эквивалентности и молярные массы эквивалента КМО4 в реакциях:
а) 2 КМnО4 + 5 Na2C2O4 + 16 HCl ↔ 2 MnCl2 + 2 KCl + 10 CO2 + 8 h3O + 10 h3O
б) 2 KMnO4 + 3 MnCL2 + h3O ↔ 5 MnO2↓ + 4 KCl + 4 HCl
Решение:
а) В полуреакции восстановления участвуют 5 электронов, следовательно:
MnO4- + 8H+ + 5 ê ↔ Mn2+ + 4 h3O
fэкв (KMnO4) = 1/5 , а следовательно
M (KMnO4) 158
М(1/5 KMnO4) = --------------- = ------- = 31,67 (г/моль)
5 5
б) Поскольку в полуреакции восстановления KMnO4 участвуют 3 электрона:
MnO4- + 2 h3O + 3 ê ↔ MnO2 + 4 OH-
fэкв(KMnO4) = 1/3 , следовательно
M (KMnO4) 158
М(1/3 KMnO4) = ----------------- = -------- = 52, 67 (г/моль)
3 3
studfiles.net
5. Количество вещества эквивалентов.
Обозначение nэк(В), единицы измерения моль-эк. Если известна масса вещества и молярная масса эквивалентов, то количество вещества эквивалентов рассчитывают по формуле:
(21)
где m(В) – масса вещества, г;
Мэк(В) – молярная масса эквивалентов вещества, г/моль-эк.
Для газообразных веществ можно рассчитать nэк(В), зная объем газа, который он имеет при н.у.:
(22)
где Vo(В) – объем газа при н.у., л;
–молярный объем эквивалентов газа при н.у., л/моль-эк
Между количеством вещества эквивалентов nэк(В) и количеством вещества n(В) существует простая зависимость :
nэк(В) = n(В) · Z(В) (23)
Пример. Рассчитать Z(В), Мэк(В) всех веществ, принимающих участие в реакциях а) и б), а так же газообразных веществ в реакции а).
а) Fe2O3 (т) + 3CO(г) = 2Fe(т) + 3CO2(г)
б) Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4
Решение. Прежде всего необходимо определить к какому типу реакций (обменная или окислительно - восстановительная) относится данная реакция, для чего рассчитывают степени окисления атомов или групп атомов в формульных единицах всех веществ.
Реакция а)
является окислительно-восстановительной.
Находим атомы, которые изменяют степени окисления, и выписываем их, с учетом числа в составе одной формульной единицы и числа отданных и принятых электронов:
а) для реагентов
б) для продуктов
Расчеты всех величин приведены в таблице 5.
Таблица 5
| ФЕ |
| Z(B) | M(B), г/моль |
|
|
| Fe2O3 | 6 | 6 | 160,0 | 26,7 | - |
| CO | 2 | 2 | 28,0 | 14,0 | 11,2 |
| Fe | 3 | 3 | 56,0 | 18,7 | - |
| CO2 | 2 | 2 | 44,0 | 22,0 | 11,2 |
Реакция б)
является обменной, т.к. степени окисления атомов и групп атомов в ходе реакции не изменяются. Далее необходимо выбрать те части формульных единиц (положительно или отрицательно заряженных) по которым будет производится расчет суммарного заряда замещающихся ионов, а далее – Z(B) и Мэк(В). Расчеты приведены в таблице 6.
Таблица 6.
| ФЕ | Замещаю- щиеся ионы | qi | Ni | Z(В)= Ni·│qi│ | М(В), г/моль |
|
| Al2(SO4)3 | SO4–2 | –2 | 3 | 3·2=6 | 342,0 | 57,0 |
| NaOH | Na+ | +1 | 1 | 1·1=1 | 40,0 | 40,0 |
| Al(OH)3 | OH– | –1 | 3 | 3·1=3 | 78,0 | 26,0 |
| Na2SO4 | Na+ | +1 | 2 | 2·1=2 | 142,0 | 71,0 |
6. Закон эквивалентов.
Согласно закону эквивалентов все вещества реагируют и образуются в эквивалентных количествах.
Например, для реакции
2CO + O2 = 2CO2 (24)
nэк(CO) = nэк(O2)=nэк(CO2) (25)
Для реакции в общем виде:
nAA + nBB = nCC + nDD , (26)
где A,B – реагенты;
C,D – продукты реакции;
nA,nB,nC,nD – стехиометрические коэффициенты,
закон эквивалентов имеет вид:
nэк(A) = nэк(B) = nэк(C) = nэк(D) (27)
Т.е. количество вещества эквивалентов всех участвующих в реакции (26) веществ (реагентов А и В и образовавшихся продуктов C и D) одинаковы. Поэтому, если количество вещества эквивалентов одного из веществ (реагента или продукта) известно по условию задачи, то определены и nэк всех остальных веществ, участвующих в реакции, и необходимость их расчета отпадает. В этом состоит преимущество проведения расчетов по закону эквивалентов.
Для любой химической реакции (см. уравнение реакции в общем виде (26)) соблюдается условие (27), которое также может быть представлено следующим образом:
n(А) · Z(A)= n(В) · Z(B)= n(С) · Z(C)= n(D) · Z(D) (28)
Условие (28) упрощает определение эквивалентного числа в сложных реакциях.
Пример. Определить Z(Cr2(SO4)3) в обменной реакции, выраженной уравнением
Cr2(SO4)3 + 12KOH = 2K3[Cr(OH)6] + 3K2SO4
Решение. Для приведенной реакции запишем условие (28):
n( Cr2(SO4)3) · Z(Cr2(SO4)3)= n( KOH) · Z(KOH)
Из уравнения реакции:
n( Cr2(SO4)3) = 1 n(KOH) = 12
Поскольку Z(KOH) = 1 (не может быть другим, см. табл. 2), то
Если известны массы веществ, участвующих в реакции, то используя уравнения (21) и (27) можно записать:
(29)
или
(30)
Уравнение (30) является математическим выражением закона эквивалентов.
Если одно из веществ уравнения (26), например B, находится в газообразном состоянии и известен его объем при н.у., то количество вещества эквивалентов этого газа можно рассчитать по уравнению (22), а математическая запись закона эквивалентов для веществ A и B будет иметь вид:
(31)
Пример. Рассчитать массу алюминия, вступившего в реакцию с разбавленной серной кислотой, если в результате реакции образуется 10,2 л водорода (н.у.).
Решение. Запишем уравнение реакции и укажем степени окисления атомов и заряды ионов:
Реакция окислительно-восстановительная. Находим атомы, которые изменяют степени окисления, и выписываем их, с учетом числа в составе одной формульной единицы и числа отданных и принятых электронов:
Alo – = Al+3Z(Al) = 3
h3o – = 2H+1Z(h3) = 2
Согласно закону эквивалентов:
.
Отсюда выражаем массу алюмиия:
Рассчитаем Мэк(Al) и :
Подставив полученные значения Мэк(Al) и , а так жеVo(h3), рассчитаем массу алюминия:
studfiles.net
Эквивалент вещества
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
РОССИЙСКОЙ ФЕДЕРАЦИИ
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ АРХИТЕКТУРНО-СТРОИТЕЛЬНЫЙ УНИВЕРСИТЕТ (СИБСТРИН)
Кафедра химии
Методические указания
к выполнению лабораторных работ
для студентов I курса всех специальностей
и форм обучения
НОВОСИБИРСК 2007
Методические указания переработаны
канд. хим. наук Т.А. Шершнёвой
Утверждены методической комиссией СТФ
февраля 2007 года
Рецензент:
Г.А. Маринкина, канд. хим. наук, доцент
кафедры химии НГАУ
© Новосибирский государственный
архитектурно-строительный
университет (Сибстрин), 2007
Эквивалент вещества.
Теоретическая часть.
1.Эквивалент вещества. Эквивалентное число.
Эквивалент – одна из важнейших характеристик простых и сложных веществ. Эквивалент вещества Э (В) – условная частица вещества в Z раз меньше, чем соответствующая формульная единица (ФЕ) этого вещества, принимающая участие в данной реакции.
(1)
Число Z(В) называют эквивалентным числом или числом эквивалентности вещества В (буквой В обозначается формульная единица вещества, которой может быть химическая формула атома (S, Fe), молекулы (O2, h3O), иона (K+, ) и др. частиц, оно показывает во сколько раз эквивалент данного вещества меньше формульной единицы, а так же показывает какое число эквивалентов вещества условно "содержится" в одной формульной единице этого вещества. Следовательно, всегдаZ(В) ≥1. Если известно значение Z(В) можно записать Э (В). (см. табл. 1)
Таблица 1
| Вещество | ФЕ | Z(В) | Э (В) |
| Оксид алюминия | Al2O3 | 6 | Al2O3 |
| Фосфорная кислота | h4PO4 | 3 | h4PO4 |
Значения Z(В), а, следовательно, и эквивалент для большинства веществ не являются постоянными величинами и изменяются в зависимости от реакций, в которых они участвуют. И только в тех случаях, когда Z(В) = 1 и не может иметь других значений, эквивалент вещества постоянен и идентичен формульной единице (см. табл. 2)
Таблица 2
| В | HCl | KOH | NaCl | Nh5OH | HNO3 |
| Z(В) | 1 | 1 | 1 | 1 | 1 |
| Э(В) | HCl | KOH | NaCl | Nh5OH | HNO3 |
Определение эквивалентных чисел веществ неодинаково для обменных и окислительно-восстановительных реакций.
2. Расчет z(в) в окислительно-восстановительных реакциях.
В окислительно-восстановительных реакциях имеет место изменение степеней окисления атомов в результате отдачи или принятия электронов. В таких реакциях Z(В) определяют по числу отданных электронов одной формульной единицей восстановителя или принятых электронов одной формульной единицей окислителя.
(2)
где – число отданных или принятых электронов одной формульной единицей вещества.
Например, в реакции
(3)
Z(N2) = 6, т.к. одна формульная единица азота N2 принимает в ходе реакции шесть электронов:
+ 6 = 2N-3= 6, (4)
а Z(h3) = 2, т.к. одна формульная единица водорода h3 отдает два электрона:
, (5)
На примере реакций (6) и (8) можно убедиться, что одно и то же вещество – углерод может иметь различные значения Z(В).
(6)
т.к. (7)
Z(C) = 4 (8)
т.к. (9)
Как следует из приведенных реакций (6) и (8) эквивалентное число кислорода равно четырём, Z(O2) = 4, т.к. одна формульная единица O2 принимает четыре электрона:
(10)
studfiles.net