Электроотрицательность. Степень окисления и валентность химических элементов. Электроотрицательность как определить по таблице
Относительная электроотрицательность химических элементов (Таблица)
Относительноя электроотрицательность химических элементов (классический вариант)
| I | II | III b | IV b | V b | VI b | VII b | VIII b | VIII b | VIII b | I b | II b | III | IV | V | VI | VII | VIII |
| H 2,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| He |
| Li 0,97 | Be 1,47 |
|
|
|
|
|
|
|
|
|
| B 2,02 | C 2,50 | N 3,07 | O 3,50 | F 4,10 | Ne |
| Na 1,01 | Mg 1,23 |
|
|
|
|
|
|
|
|
|
| Al 1,47 | Si 1,74 | P 2,10 | S 2,60 | Cl 2,83 | Ar |
| K 0,91 | Ca 1,04 | Sc 1,20 | Ti 1,32 | V 1,45 | Сr 1,56 | Mn 1,60 | Fe 1,64 | Co 1,75 | Ni 1,75 | Cu 1,76 | Zn 1,66 | Ga 1,82 | Ge 2,02 | As 2,20 | Se 2,48 | Br 2,74 | Kr 3,00 |
| Rb 0,89 | Sr 0,99 | Y 1,11 | Zr 1,22 | Nb 1,23 | Mo 1,30 | Tc 1,36 | Ru 1,42 | Rh 1,45 | Pd 1,35 | Ag 1,42 | Cd 1,46 | In 1,49 | Sn 1,72 | Sb 1,82 | Te 2,01 | I 2,21 | Xe 2,60 |
| Cs 0,86 | Ba 0,97 | La 1,08 | Hf 1,23 | Ta 1,33 | W 1,40 | Re 1,46 | Os 1,52 | Ir 1,55 | Pt 1,44 | Au 1,42 | Hg 1,44 | Tl 1,44 | Pb 1,55 | Bi 1,67 | Po 1,76 | At 1,96 | Rn 2,20 |
| Fr 0,86 | Ra 0,97 | Ac 1,00 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лантаноиды имеют значения относительных электроотрицательностей в области 1,08 – 1,14;
1. Актиноиды имеют значения относительных электроотрицательностей в области 1,11 – 1,20;
3. Условной границей между металлами и неметаллами считается значение относительно электроотрицательности равное 2
Относительная электроотрицательности химических элементов (таблица)
| Элемент | Электроотрицательность | Элемент | Электроотрицательность |
| Ac | 1,00 | F | 4,10 |
| Ag | 1,42 | Fe | 1,64 |
| Al | 1,47 | Fr | 0,86 |
| Ar | 3,20 | Ga | 1,82 |
| As | 2,11 | Ge | 2,02 |
| At | 1,90 | H | 2,10 |
| Au | 1,42 | He | 5,50 |
| B | 2,01 | Hf | 1,23 |
| Ba | 0,97 | Hg | 1,44 |
| Be | 1,47 | I | 2,21 |
| Bi | 1,67 | In | 1,49 |
| Br | 2,74 | Ir | 1,55 |
| C | 2,50 | K | 0,91 |
| Ca | 1,04 | Kr | 2,94 |
| Cd | 1,46 | La | 1,08 |
| Cl | 2,83 | Li | 0,97 |
| Co | 1,70 | Mg | 1,23 |
| Cr | 1,56 | Mn | 1,60 |
| Cs | 0,86 | Rn | 2,06 |
| Cu | 1,75 | Ru | 1,42 |
| Mo | 1,30 | S | 2,60 |
| N | 3,07 | Si | 2,25 |
| Na | 0,93 | Sb | 1,82 |
infotables.ru
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность
Электроотрицательность (ЭО) — это способность атомов притягивать электроны при связывании с другими атомами.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка (…2s2 2p5) расположена близко к ядру.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.
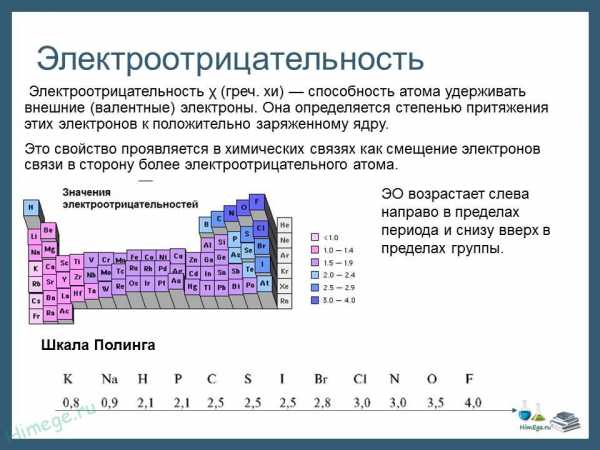
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
 Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная.
Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3,98 — 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например: связь Na—Cl в соединении NaCl: Δ X = (3,16 — 0,93) = 2,23.
Степень окисления
Степень окисления (СО) — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.


При образовании ионной связи происходит переход электрона от менее электроотрицательного атома к более электроотрицательному, атомы теряет свою электронейтральность, превращается в ионы. возникают целочисленные заряды. При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl). Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.


На этом рисунке изображены степени окисления, характерные для первых 20 элементов.Обратите внимание. Высшая СО как правило равна номеру группы в таблице Менделеева. У металлов главных подгрупп – одна характерная СО, у неметаллов, как правило, наблюдается разброс СО. Поэтому неметаллы образуют большое количество соединений и обладают более «разнообразными» свойствами, по сравнению с металлами.
Примеры определения степени окисления
Определим степени окисления хлора в соединениях:
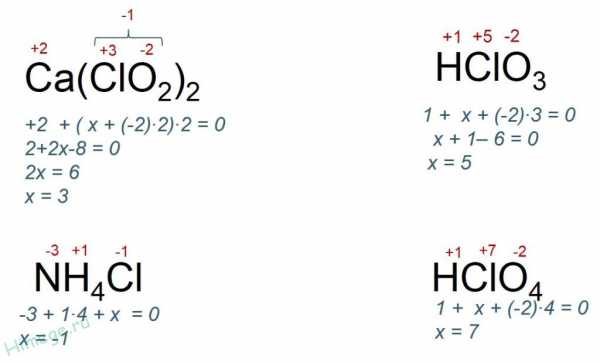
Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.
 Здесь удобно пользоваться следующим приемом:
Здесь удобно пользоваться следующим приемом:
1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.
Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.
Валентность
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов образовывать определённое число химических связей с атомами других элементов.
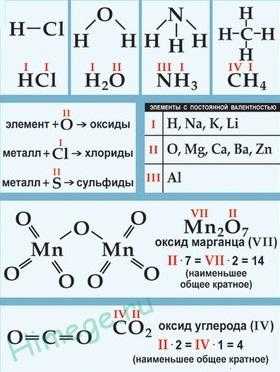
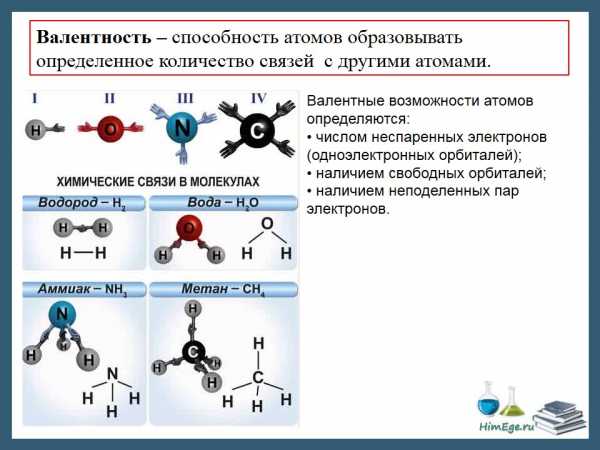
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей. Если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами, т.е. его валентность будет равна n + m. При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4— и Nh5+), фосфора — 5 (PCl5), серы — 6 (h3SO4), хлора — 7 (Cl2O7).
В ряде случаев, валентность может численно совпадать со степенью окисления, но ни коим образом они не тождественны друг другу. Например, в молекулах N2 и CO реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления азота равна 0, углерода +2, кислорода −2.


 В азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4, т.к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.
В азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4, т.к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.

Ещё несколько «коварных» вопросов, в которых часто делают ошибки.
himege.ru
В каком соединение полярность связи наименьшая?
Для определения полярности связей самое нужное - иметь под рукой таблицу электроотрицательностей элементов! Её можно посмотреть здесь: <a rel="nofollow" href="http://ru.wikipedia.org/wiki/Электроотрицательность" target="_blank">http://ru.wikipedia.org/wiki/Электроотрицательность</a> А полярность связи тем больше, чем больше разность электроотрицательности между двумя атомами
Полярность зависит от разницы в значениях электроотрицательности, она максимальна в первом случае. Надо понять, как это определять по таблице Менделеева. Не въедешь-пиши. В ряду F O S Cl минимальная ЭО у серы, значит разница в значениях ЭО серы и водорода минимальна, и полярность связи тоже.
Исходные значения: H=2,7 F=9,92 S=5,77 Cl=7,04 O=8,11 -------- считаем разность 1) HF 9,92-2,70=7,22 2) h3O 8,11-2,70=5,41 3) h3S 5,77-2,70=3,07 4) HCl 7,04-2,70=4,34 правильно первый HF выстраиваем в порядке убывания разницы электроотрицательности более полярная связь<-- HF <-- h3O <-- HCl <-- h3S <-- менее полярная связь ------------------ исходные значения взяты с <a rel="nofollow" href="https://ru.wikipedia.org/wiki/Электроотрицательность" target="_blank">https://ru.wikipedia.org/wiki/Электроотрицательность</a>
touch.otvet.mail.ru
|
www.dpva.ru
Понятие электроотрицательности — урок. Химия, 8–9 класс.
Все известные химические элементы можно разделить на металлы и неметаллы.
Металлы — элементы, атомы которых способны отдавать электроны.
Неметаллы — элементы, атомы которых могут принимать электроны.
При взаимодействии металла с неметаллом атом первого теряет электроны, а атом второго их присоединяет.
А что происходит, если взаимодействуют атомы двух неметаллов?
Сравним атомы серы и кислорода:
O8 +8 2e, 6e;
S16 +16 2e, 8e, 6e.
Радиус атома серы больше, валентные электроны слабее связаны с ядром. При образовании связи произойдёт сдвиг электронов от серы к кислороду.
Сравним атомы углерода и кислорода:
O8 +8 2e, 6e;
C6 +6 2е, 4е.
Заряд ядра атома кислорода больше, и притягивать к себе электроны он будет сильнее.
Значит, атомы разных неметаллов притягивают к себе электроны неодинаково.
Способность атомов элементов оттягивать к себе общие электронные пары в химических соединениях называется электроотрицательностью (ЭО).
Так как общие электронные пары образуются валентными электронами, то можно сказать, что электроотрицательность — это способность атома притягивать к себе валентные электроны от других атомов.
Обрати внимание!
Чем больше электроотрицательность, тем сильнее у элемента выражены неметаллические свойства.
Шкала относительной электроотрицательности Полинга
Абсолютные значения ЭО — неудобные для работы числа. Поэтому обычно используют относительную электроотрицательность по шкале Полинга. За единицу в ней принята ЭО лития.
По шкале Полинга наиболее электроотрицательным среди элементов, способных образовывать соединения, является фтор, а наименее электроотрицательным — франций. ЭО франция равна \(0,7\), а ЭО фтора — \(4\). ЭО остальных элементов изменяются в пределах от \(0,7\) до \(4\).
Как правило, неметаллы имеют ЭО больше двух. У металлов значение ЭО меньше двух. Некоторые элементы (B,Si,Ge,As,Te) со значениями электроотрицательности, близкими к \(2\), способны проявлять промежуточные свойства.
Элементы с высокой и низкой электроотрицательностью считаются активными. С высокой — активные неметаллы, с низкой — активные металлы. У первых ЭО близка к \(3\)–\(4\), у вторых — к \(1\).
Изменение электроотрицательности в Периодической системе
С увеличением порядкового номера элементов ЭО изменяется периодически.
В периоде она растёт слева направо при накоплении электронов на внешнем слое.
В группе она убывает сверху вниз при увеличении числа электронных слоёв и увеличении атомных радиусов.
Наибольшей ЭО в каждом периоде обладают самые маленькие атомы с семью внешними электронами — атомы галогенов (инертные газы соединений не образуют).
Наименьшая ЭО в периоде у самого большого атома с одним внешним электроном — атома щелочного металла.
Обрати внимание!
Значения электроотрицательности элементов позволяют определить:
— заряды атомов в соединении;— сдвиг электронов при образовании химической связи.
Установим, как происходит сдвиг электронов при взаимодействии атомов хлора и серы, cеры и кислорода.
Пример:
хлор и сера расположены в третьем периоде. Электроотрицательность по периоду возрастает слева направо. ЭО хлора больше ЭО серы, значит, электроны будут сдвинуты от серы к хлору. Заряд атома серы будет положительным, а хлора — отрицательным:
Sδ+→Clδ−.
Проверим вывод по шкале Полинга. Электроотрицательность хлора равна \(3\), а электроотрицательность серы — \(2,5\). Хлор более электроотрицательный.
Пример:
кислород и сера расположены в шестой А группе. Электроотрицательность по группе сверху вниз уменьшается. ЭО кислорода больше ЭО серы, значит, электроны будут сдвинуты от серы к кислороду. Атом серы имеет положительный заряд, а кислорода — отрицательный:
Sδ+→Oδ−.
По шкале Полинга электроотрицательность кислорода равна \(3,5\), а электроотрицательность серы — \(2,5\). Более электроотрицательный — кислород.
При сравнении ЭО элементов часто используют ряд электроотрицательности, расположив элементы в порядке убывания её значения:
F,O,N,Cl,Br,S,C,P,H,Si,Mg,Li,Na.
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 71с
Жилин Д. М. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Бином. Лаборатория знаний, 2011. — 245с.
www.yaklass.ru
Электроотрицательность - это... Что такое Электроотрицательность?
Эле́ктроотрица́тельность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. Он использовал понятие электроотрицательности для объяснения того факта, что энергия гетероатомной связи A—B (A, B — символы любых химических элементов) в общем случае больше среднего геометрического значения гомоатомных связей A—A и B—B.
В настоящее время для определения электроотрицательностей атомов существует много различных методов, результаты которых хорошо согласуются друг с другом, за исключением относительно небольших различий, и во всяком случае внутренне непротиворечивы.
Первая и широко известная шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород (3,5) и далее азот и хлор (3,0). Активные щелочные и щёлочноземельные металлы имеют наименьшие значения электроотрицательности, лежащие в интервале 0,7—1,2, а галогены — наибольшие значения, находящиеся в интервале 4,0—2,5. Электроотрицательность типичных неметаллов находится в середине общего интервала значений и, как правило, близка к 2 или немного больше 2. Электроотрицательность водорода принята равной 2,1. Для большинства переходных металлов значения электроотрицательности лежат в интервале 1,5—2,0. Близки к 2,0 значения электроотрицательностей тяжёлых элементов главных подгрупп. Существует также несколько других шкал электроотрицательности, в основу которых положены разные свойства веществ. Но относительное расположение элементов в них примерно одинаково.
Теоретическое определение электроотрицательности было предложено американским физиком Р. Малликеном. Исходя из очевидного положения о том, что способность атома в молекуле притягивать к себе электронный заряд зависит от энергии ионизации атома и его сродства к электрону, Р. Малликен ввёл представление об электроотрицательности атома А как о средней величине энергии связи наружных электронов при ионизации валентных состояний (например, от А− до А+) и на этой основе предложил очень простое соотношение для электроотрицательности атома:
где J1A и εA — соответственно энергия ионизации атома и его сродство к электрону.
Помимо шкалы Малликена, описанной выше, существует более 20-ти различных других шкал электроотрицательности, среди которых шкала Л. Полинга (основана на энергии связи при образовании сложного вещества из простых), шкала Олреда-Рохова (основана на электростатической силе, действующей на внешний электрон) и др.
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселённости, т. е. от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остаётся необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности, силовую постоянную и т. д.
В период бурного развития квантовой химии как средства описания молекулярных образований (середина и вторая половина XX века) плодотворной оказался подход Л.Полинга, который в числе прочих исследований ввел собственную шкалу электроотрицательностей, в которой из «стандартных» элементов максимальную имеет фтор (), а минимальную — цезий (). Степень ионности связи, то есть вклад структуры, при которой более электроотрицательный атом полностью «забирает» себе валентные электроны, в общую резонансную «картину», в этой теории определяется как
где — разность электроотрицетельностей образующих связь атомов.
Одним из наиболее развитых в настоящее время подходов является подход Сандерсона. В основу этого подхода легла идея выравнивания электроотрицательностей атомов при образовании химической связи между ними. В многочисленных исследованиях были найдены зависимости между электроотрицательностями Сандерсона и важнейшими физико-химическими свойствами неорганических соединений подавляющего большинства элементов периодической таблицы.[1] Очень плодотворной оказалась и модификация метода Сандерсона, основанная на перераспределении электроотрицательности между атомами молекулы для органических соединений.[2][3][4]
Значения электроотрицательности
| Группа | I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A | |
| Период | |||||||||||||||||||
| 1 | h3,1 | He | |||||||||||||||||
| 2 | Li0,98 | Be1,57 | B2,04 | C2,55 | N3,04 | O3,44 | F3,98 | Ne | |||||||||||
| 3 | Na0,99 | Mg1,31 | Al1,61 | Si1,90 | P2,19 | S2,58 | Cl3,16 | Ar | |||||||||||
| 4 | K0,82 | Ca1,00 | Sc1,36 | Ti1,54 | V1,63 | Cr1,66 | Mn1,55 | Fe1,83 | Co1,88 | Ni1,91 | Cu1,90 | Zn1,65 | Ga1,81 | Ge2,01 | As2,18 | Se2,55 | Br2,96 | Kr3,00 | |
| 5 | Rb0,82 | Sr0,95 | Y1,22 | Zr1,33 | Nb1,6 | Mo2,16 | Tc1,9 | Ru2,2 | Rh3,28 | Pd2,20 | Ag1,93 | Cd1,69 | In1,78 | Sn1,96 | Sb2,05 | Te2,1 | I2,66 | Xe2,60 | |
| 6 | Cs0,79 | Ba0,89 | * | Hf1,3 | Ta1,5 | W2,36 | Re1,9 | Os2,2 | Ir2,20 | Pt2,28 | Au2,54 | Hg2,00 | Tl1,62 | Pb2,33 | Bi2,02 | Po2,0 | At2,2 | Rn2,2 | |
| 7 | Fr0,7 | Ra0,9 | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| Лантаноиды | * | La1,1 | Ce1,12 | Pr1,13 | Nd1,14 | Pm1,13 | Sm1,17 | Eu1,2 | Gd1,2 | Tb1,1 | Dy1,22 | Ho1,23 | Er1,24 | Tm1,25 | Yb1,1 | Lu1,27 | |||
| Актиноиды | ** | Ac1,1 | Th2,3 | Pa1,5 | U1,38 | Np1,36 | Pu1,28 | Am1,13 | Cm1,28 | Bk1,3 | Cf1,3 | Es1,3 | Fm1,3 | Md1,3 | No1,3 | Lr1,291 | |||
Примечания
- ↑ Sanderson R.T. Chemical Bonds and Bond Energy. N.Y.: Acad.Press, 1976.- 218 p.
- ↑ С. С. Бацанов, Структурная химия. Факты и зависимости. — М: Диалог-МГУ, 2000. — 292 с. ISBN 5-89209-597-5
- ↑ Н. С. Зефиров, М. А. Кирпиченок, Ф. Ф. Измайлов, М. И. Трофимов, Докл. АН СССР, 296, 1987, 883.
- ↑ М. И. Трофимов, Е. А. Смоленский, Известия Академии наук. Серия химическая, 2005, 2166—2176.
См. также
dic.academic.ru
Как определить электроотрицательность
Электроотрицательность - это показатель способности атома элемента притягивать к себе общие электронные пары. Давно было установлено, что в том случае, если химическая связь образована атомами разных элементов, электронная плотность всегда смещена в сторону одного из них в большей или меньшей степени. Тот атом, к которому притянута электронная плотность, в этой паре будет считаться электроотрицательным, а другой, соответственно, электроположительным.Вам понадобится
- Таблица Менделеева.
Инструкция
- Для определения электроотрицательности существует довольно много методов. Например, существует так называемая «шкала Малликена», названная в честь американского ученого, который рассматривал электроотрицательность как среднюю величину энергии связи валентных электронов.
- Есть также «шкала Полинга», получившая свое название по имени химика, положившего в основу понятия «электроотрицательность» энергию связи при образовании сложного вещества из простых исходных веществ. Величины электроотрицательности по этой шкале лежат в интервале от 0,7 (щелочной металл франций) до 4,0 (газ-галоген фтор).
- В «шкале Олреда-Рохова» степень электроотрицательности зависит от величины электростатической силы, воздействующей на внешний электрон.
- А как определить, какой элемент более электроотрицательный, а какой – менее, располагая лишь таблицей Менделеева? Это очень просто. Запомните закономерность: чем выше и правее в этой таблице находится химический элемент, тем более электроотрицательные свойства он имеет. Соответственно, чем ниже и левее расположен элемент, тем он более электроположительный.
- Абсолютный рекордсмен по электоотрицательности – галоген фтор. Это настолько химически активный элемент, что он давно носит неофициальное прозвище «все разгрызающий». Полинг считал, что его электроотрицательность равна 4,0. По последним уточненным данным, она равна 3,98. Несколько уступает фтору хорошо знакомый кислород – его электроотрицательность примерно равна 3,44. Затем идет газ-галоген хлор. Чуть менее электроотрицателен азот. И так далее. У большинства неметаллов величина электроотрицательности примерно равна 2 или немного выше. Соответственно, у самых активных – щелочных и щелочноземельных – металлов эта величина колеблется от 0,7 (франций) до 1,57 (бериллий).
completerepair.ru











