таблица менделеева с электроотрицательностью. Электроотрицательность по таблице менделеева
Электроотрицательность элементов: как определить по таблице Менделеева
24.10.2018
Свежие новостиНАСА пригласило Рогозина в США
Выпускник Ульяновского военного училища стал во Вьетнаме министром
На Афоне заявили о неподчинении Константинополю
Можно ли загореть через стекло, если очень хочется :: SYL.ru
Матвиенко отметила желание России и США вести диалог
Матвиенко заявила о готовности России ответить на выход США из ДРСМД
Конте пригласил Путина в Италию
Какие предметы нужно сдавать при поступлении на юриста | ПапаЮрист.ру
Сироп Гренадин – состав продукта, выбор и хранение, использование в кулинарии
NYT: в Белом доме опасаются, что «социалисты» навредят растущей экономике США
FacebookTwitterInstagramPinterestGoogleYoutube- Армия
- Армия
Шойгу ответил на планы Польши разместить в стране…
24.10.2018
АрмияШойгу заявил о небывалой активности НАТО у границ…
24.10.2018
Армия»Мы не думаем об этом», — в Польше…
23.10.2018
АрмияМинобороны возьмет на учет мемориалы Вечный огонь и…
23.10.2018
АрмияРоссийских военных будут увольнять за публикацию фото в…
23.10.2018
Армия«Аллигатор» ждет перерождение: вертолеты Ка-52 будут модернизированы
22.10.2018
- Армия
- Общество
- Общество
Можно ли загореть через стекло, если очень хочется…
24.10.2018
ОбществоКакие предметы нужно сдавать при поступлении на юриста…
24.10.2018
ОбществоСироп Гренадин – состав продукта, выбор и хранение,…
24.10.2018
ОбществоВазелин вместо косметики и лекарств: 9 полезных способов…
24.10.2018
ОбществоКак сшить чехол на матрас своими руками?
24.10.2018
ОбществоАйдан Шенер ее биография и личная жизнь |…
24.10.2018
- Общество
- Политика
- Политика
НАСА пригласило Рогозина в США
24.10.2018
ПолитикаВыпускник Ульяновского военного училища стал во Вьетнаме министром
24.10.2018
ПолитикаНа Афоне заявили о неподчинении Константинополю
24.10.2018
ПолитикаМатвиенко отметила желание России и США вести диалог
24.10.2018
ПолитикаМатвиенко заявила о готовности России ответить на выход…
- Политика
novoevmire.biz
Как определить электроотрицательность
Электроотрицательность - это показатель способности атома элемента притягивать к себе общие электронные пары. Давно было установлено, что в том случае, если химическая связь образована атомами разных элементов, электронная плотность всегда смещена в сторону одного из них в большей или меньшей степени. Тот атом, к которому притянута электронная плотность, в этой паре будет считаться электроотрицательным, а другой, соответственно, электроположительным.
Вам понадобитсяТаблица Менделеева.
Спонсор размещения P&G Статьи по теме "Как определить электроотрицательность" Как рассчитать промилле Как решать уравнения четвертой степени Как определить степень окисления атомов1
Для определения электроотрицательности существует довольно много методов. Например, существует так называемая «шкала Малликена», названная в честь американского ученого, который рассматривал электроотрицательность как среднюю величину энергии связи валентных электронов.2
Есть также «шкала Полинга», получившая свое название по имени химика, положившего в основу понятия «электроотрицательность» энергию связи при образовании сложного вещества из простых исходных веществ. Величины электроотрицательности по этой шкале лежат в интервале от 0,7 (щелочной металл франций) до 4,0 (газ-галоген фтор).3
В «шкале Олреда-Рохова» степень электроотрицательности зависит от величины электростатической силы, воздействующей на внешний электрон.4
А как определить, какой элемент более электроотрицательный, а какой – менее, располагая лишь таблицей Менделеева? Это очень просто. Запомните закономерность: чем выше и правее в этой таблице находится химический элемент, тем более электроотрицательные свойства он имеет. Соответственно, чем ниже и левее расположен элемент, тем он более электроположительный.5
Абсолютный рекордсмен по электоотрицательности – галоген фтор. Это настолько химически активный элемент, что он давно носит неофициальное прозвище «все разгрызающий». Полинг считал, что его электроотрицательность равна 4,0. По последним уточненным данным, она равна 3,98. Несколько уступает фтору хорошо знакомый кислород – его электроотрицательность примерно равна 3,44. Затем идет газ-галоген хлор. Чуть менее электроотрицателен азот. И так далее. У большинства неметаллов величина электроотрицательности примерно равна 2 или немного выше. Соответственно, у самых активных – щелочных и щелочноземельных – металлов эта величина колеблется от 0,7 (франций) до 1,57 (бериллий). Как простоЭлектроотрицательность химических элементов
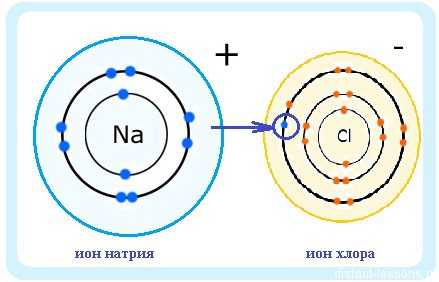 Электроотрицательность химических элементов связана, с одной стороны, со склонностью свободного атома удерживать свои внешние электроны, а с другой стороны, со склонностью атома притягивать дополнительные электроны.
Электроотрицательность химических элементов связана, с одной стороны, со склонностью свободного атома удерживать свои внешние электроны, а с другой стороны, со склонностью атома притягивать дополнительные электроны.
Большинство атомов элементов имеет незавершенный внешний электронный слой, содержащий от 1 до 7 электронов.
Только инертные газы имеют завершенный электронный слой. Каждый атом во время химических реакций стремится к завершению электронного слоя, но происходит это по-разному:
- 1) атомы обобщают свои внешние электроны;
- 2) атомы отдают свои внешние электроны;
- 3) атомы принимают на внешний электронный слой недостающие для его завершения электроны.
Таким образом электроотрицательность зависит:
1) от количества электронов на внешнем электронном слое (в периоде периодической таблицы Менделеева слева направо с увеличением электронов на внешнем уровне – электроотрицательность элементов увеличивается)
2) от радиуса атома, чем больше атом, тем меньше электроотрицательность (в группах периодической таблицы Менделеева сверху вниз электроотрицательность уменьшается, т.к. с возрастанием радиуса положительно заряженное ядро с меньшей силой притягивает электроны с внешнего уровня).
Наиболее часто используемой шкалой электроотрицательности является шкала Полинга, рассчитанная из термохимических данных. За начало отсчета в этой шкале принята величина наиболее электроотрицательного элемента фтора, χF = 4. За единицу принята электроотрицательность лития.
Значения электроотрицательности у металлов от 0,7 до 2. У неметаллов от 2 до 4. В шкале электроотрицательности каждому элементу приписывается вполне определенное значение величины χ, которое на зависит от другого элемента, с которым он образует связь.
При составлении формул соединений из неметаллических элементов более электроотрицательные из них всегда указываются правее:
HF, BrN3, ClF3 , h3S.
distance-teacher.ru
Периодический закон Менделеева и периодическая система химических элементов
Периодический закон Д.И. Менделеева и периодическая система химических элементов имеет большое значение в развитии химии. Окунемся в 1871 год, когда профессор химии Д.И. Менделеев, методом многочисленных проб и ошибок, пришел к выводу, что «… свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». Периодичность изменения свойств элементов возникает вследствие периодического повторения электронной конфигурации внешнего электронного слоя с увеличением заряда ядра.
Современная формулировка периодического закона такова:
«свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Преподавая химию, Менделеев понимал, что запоминание индивидуальных свойств каждого элемента, вызывает у студентов трудности. Он стал искать пути создания системного метода, чтобы облегчить запоминание свойств элементов. В результате появилась естественная таблица, позже она стала называться периодической.
Наша современная таблица очень похожа на менделеевскую. Рассмотрим ее подробнее.
Таблица Менделеева
Периодическая таблица Менделеева состоит из 8 групп и 7 периодов.
Вертикальные столбцы таблицы называют группами. Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. Это объясняется тем, что элементы одной группы имеют сходные электронные конфигурации внешнего слоя, число электронов на котором равно номеру группы. При этом группа разделяется на главные и побочные подгруппы.
В Главные подгруппы входят элементы, у которых валентные электроны располагаются на внешних ns- и np- подуровнях. В Побочные подгруппы входят элементы, у которых валентные электроны располагаются на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне).
Все элементы в периодической таблице, в зависимости от того, на каком подуровне (s-, p-, d- или f-) находятся валентные электроны классифицируются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III — VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
Высшая валентность элемента (за исключением O, F, элементов подгруппы меди и восьмой группы) равна номеру группы, в которой он находится.
Для элементов главных и побочных подгрупп одинаковыми являются формулы высших оксидов (и их гидратов). В главных подгруппах состав водородных соединений являются одинаковыми, для элементов, находящихся в этой группе. Твердые гидриды образуют элементы главных подгрупп I — III групп, а IV — VII групп образуют а газообразные водородные соединения. Водородные соединения типа ЭН4 – нейтральнее соединения, ЭН3 – основания, Н2Э и НЭ — кислоты.
Горизонтальные ряды таблицы называют периодами. Элементы в периодах отличаются между собой, но общее у них то, что последние электроны находятся на одном энергетическом уровне (главное квантовое число n — одинаково).
Первый период отличается от других тем, что там находятся всего 2 элемента: водород H и гелий He.
Во втором периоде находятся 8 элементов (Li — Ne). Литий Li – щелочной металл начинает период, а замыкает его благородный газ неон Ne.
В третьем периоде, также как и во втором находятся 8 элементов (Na — Ar). Начинает период щелочной металл натрий Na, а замыкает его благородный газ аргон Ar.
В четвёртом периоде находятся 18 элементов (K — Kr) – Менделеев его обозначил как первый большой период. Начинается он также с щелочного металла Калий, а заканчивается инертным газом криптон Kr. В состав больших периодов входят переходные элементы (Sc — Zn) — d-элементы.
В пятом периоде, аналогично четвертому находятся 18 элементов (Rb — Xe) и структура его сходна с четвёртым. Начинается он также с щелочного металла рубидий Rb, а заканчивается инертным газом ксенон Xe. В состав больших периодов входят переходные элементы (Y — Cd) — d-элементы.
Шестой период состоит из 32 элементов (Cs — Rn). Кроме 10 d-элементов (La, Hf — Hg) в нем находится ряд из 14 f-элементов(лантаноиды)- Ce — Lu
Седьмой период не закончен. Он начинается с Франций Fr, можно предположить, что он будет содержать, также как и шестой период, 32 элемента, которые уже найдены (до элемента с Z = 118).
Интерактивная таблица Менделеева
Если посмотреть на периодическую таблицу Менделеева и провести воображаемую черту, начинающуюся у бора и заканчивающуюся между полонием и астатом, то все металлы будут находиться слева от черты, а неметаллы – справа. Элементы, непосредственно прилегающие к этой линии будут обладать свойствами как металлов, так и неметаллов. Их называют металлоидами или полуметаллами. Это бор, кремний, германий, мышьяк, сурьма, теллур и полоний.
Периодический закон
Менделеев дал следующую формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».Существует четыре основных периодических закономерности:
Правило октета утверждает, что все элементы стремятся приобрести или потерять электрон, чтобы иметь восьмиэлектронную конфигурацию ближайшего благородного газа. Т.к. внешние s- и p-орбитали благородных газов полностью заполнены, то они являются самыми стабильными элементами.Энергия ионизации – это количество энергии, необходимое для отрыва электрона от атома. Согласно правилу октета, при движении по периодической таблице слева направо для отрыва электрона требуется больше энергии. Поэтому элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести. Самая высокая энергия ионизации у инертных газов. Энергия ионизации уменьшается при движении вниз по группе, т.к. у электронов низких энергетических уровней есть способность отталкивать электроны с более высоких энергетических уровней. Это явление названо эффектом экранирования. Благодаря этому эффекту внешние электроны мене прочно связаны с ядром. Двигаясь по периоду энергия ионизации плавно увеличивается слева направо.
Зависимость энергии ионизации от заряда ядраСродство к электрону – изменение энергии при приобретении дополнительного электрона атомом вещества в газообразном состоянии. При движении по группе вниз сродство к электрону становится менее отрицательным вследствие эффекта экранирования.
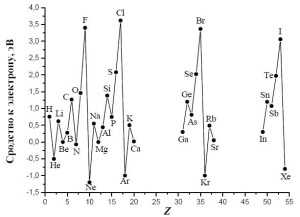 Зависимость сродства к электрону от заряда ядра
Зависимость сродства к электрону от заряда ядраЭлектроотрицательность — мера того, насколько сильно атом стремится притягивать к себе электроны связанного с ним другого атома. Электроотрицательность увеличивается при движении в периодической таблице слева направо и снизу вверх. При этом надо помнить, что благородные газы не имеют электроотрицательности. Таким образом, самый электроотрицательный элемент – фтор.
зависимость электроотрицательности от заряда ядраНа основании этих понятий, рассмотрим как меняются свойства атомов и их соединений в таблице Менделеева.
Итак, в периодической зависимости находятся такие свойства атома, которые связанны с его электронной конфигурацией: атомный радиус, энергия ионизации, электроотрицательность.
Рассмотрим изменение свойств атомов и их соединений в зависимости от положения в периодической системе химических элементов.
Неметалличность атома увеличивается при движении в периодической таблице слева направо и снизу вверх. В связи с этим основные свойства оксидов уменьшаются, а кислотные свойства увеличиваются в том же порядке — при движении слева направо и снизу вверх. При этом кислотные свойства оксидов тем сильнее, чем больше степень окисления образующего его элемента
По периоду слева направо основные свойства гидроксидов ослабевают,по главным подгруппам сверху вниз сила оснований увеличивается. При этом, если металл может образовать несколько гидроксидов, то с увеличением степени окисления металла, основные свойства гидроксидов ослабевают.
По периоду слева направо увеличивается сила кислородосодержащих кислот. При движении сверху вниз в пределах одной группы сила кислородосодержащих кислот уменьшается. При этом сила кислоты увеличивается с увеличением степени окисления образующего кислоту элемента.
По периоду слева направо увеличивается сила бескислородных кислот. При движении сверху вниз в пределах одной группы сила бескислородных кислот увеличивается.
zadachi-po-khimii.ru
таблица менделеева с электроотрицательностью — Какое химическое вещество обладает самой высокой электроотрицательностью? — 22 ответа
В разделе Наука, Техника, Языки на вопрос Какое химическое вещество обладает самой высокой электроотрицательностью? заданный автором Пользователь удален лучший ответ это Вообще-то понятие "электроотрицательность" применимо не к веществам, а к элементам.. .Электротрицательность характеризует способность атома химического элемента смещать в свою сторону электронное облако при образовании химической связи.В настоящее время предложено около 20 различных шкал электроотрицательности. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом. Электроотрицательность измеряется в относительных величинах. Наиболее электроотрицательным из всех элементов является фтор (F) - его электроотрицательность в шкале Полинга принята равной 4,0 (по Малликену - полусумма его сродства к электрону и потенциала ионизации действительно 4,1). Остальные элементы по сравнению с фтором имеют меньшую электроотрицательность .ЛёкаВысший разум(136594)С чего бы? По Полингу у золота - 2,4 , у серебра - 1,9 , у гелия - вообще 0.Я не зря оговорилась о наличии множества шкал... Если анализировать все в каше ,то придем вообще к бредовым результатам...А,вы про ионы...Вообще-то электроотрицательность - величина, характеризующая способность атома к поляризации ковалентных связей. Так что ионы тут ни при чем.
Ответ от 22 ответа[гуру]Привет! Вот подборка тем с ответами на Ваш вопрос: Какое химическое вещество обладает самой высокой электроотрицательностью?
Ответ от НИКОЛАЙ КРАДИН[новичек]КАНЕЧно же фтор!
Ответ от хитросплетенный[гуру]Насчёт веществ не знаю, а вот у элемента фтора относителная электроотрицательность самая высокая из всех (4.10)... На 2-м месте кислород (3.52), 3-е место разделяют азот и хлор (3.10)...Ну и катионы золота, серебра и меди, а также катионы инертных газов.. . Они сильнее фтора...
Ответ от философия[гуру]фтор
Ответ от 2 ответа[гуру]Привет! Вот еще темы с нужными ответами:
Ответить на вопрос:
22oa.ru
Электроотрицательность. Степень окисления и валентность химических элементов
АХМЕТОВ М. А. УРОК 6. ТЕОРИЯ. Выбрать другой урок http://maratakm.narod.ru
Электроотрицательность. Степень окисления и валентность химических элементов
Все атомы, имеющие незаполненные электронные оболочки, способны к образованию химической связи. Так, ковалентная химическая связь образуется за счет общей электронной пары. Если в образовании связи участвуют атомы разных химических элементов, то эта электронная пара будет смещена к одному из них. Способность атома к смещению электронной пары в свою сторону при образовании химической связи называется электроотрицательностью. Так электронная пара может быть смещена к более электроотрицательному атому А®B , в данном случае это атом В . Или наоборот A¬B, теперь это атом А.
Электроотрицательность в периоде периодической системы Д. И. Менделеева увеличивается с возрастанием заряда ядра химического элемента, то есть слева направо. В группе с увеличением числа электронных слоев электроотрицательность уменьшается, то есть происходит уменьшение электроотрицательности сверху вниз. Значит самым электроотрицательным элементом является фтор (F), а наименее электроотрицательным – франций (Fr). Чтобы сравнить электроотрицательности элементов, расположенных в разных периодах и группах, можно воспользоваться рассчитанными значениями электроотрицательностей. Существует несколько способов расчета значений электроотрицательностей. Рассчитанные значения образуют шкалу электроотрицательностей. Наиболее известной шкалой является шкала известного американского химика Л. Полинга (табл. 6.1)
Таблица 6.1. Электоотрицательности элементов по Полингу
|
| I | II | III | IV | V | VI | VII | VIII |
| I | H 2,1 |
|
|
|
|
|
| He
|
| II | Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | Ne |
| III | Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 | Ar |
| IV | K 0,8 | Ca 1,0 | Sc 1,3 | Ti 1,5 | V 1,6 | Cr 1,6 | Mn 1,5 | Fe 1,8 Co 1,8 Ni 1,8 |
|
| Cu 1,9 | Zn 1,6 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 | Kr |
| V | Rb 0,8 | Sr 1,0 |
|
|
|
|
|
|
В результате смещения электронной пары на атоме, к которому произошло смещение, возникает частичный отрицательный заряд, а на атоме, связанном с ним – частичный положительный заряд. Если посчитать любое частичное смещение электронов полным, то на атомах будет либо полный положительный, либо полный отрицательный заряд. Результат этого допущения называется степенью окисления. Степень окисления – это условный заряд который возник бы на атоме в случае, когда все полярные ковалентные связи считались бы ионными.
Валентность – это способность химического элемента к образованию химической связи. Рассмотрим формулы водородных соединений элементов второго периода: HF, h3O, Nh4, Ch5.
Атом фтора связал один атом водорода – следовательно его валентность равна одному. Атом кислорода связал два атома водорода – следовательно валентность атома кислорода равна двум. Как Вы думаете, чему равна валентность атомов азота и углерода? Рассмотрим вещество, имеющее формулу СО2. Так как кислород может связать два атома водорода, значит его валентность равна двум, значит валентность углерода четырем.
maratakm.narod.ru