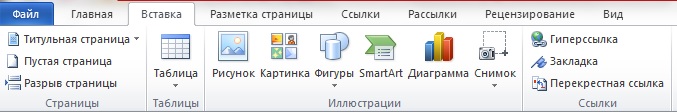
Атом. Представление о строении атома. Электроны, протоны, нейтроны. Химия электроны протоны нейтроны
Атом. Представление о строении атома. Электроны, протоны, нейтроны
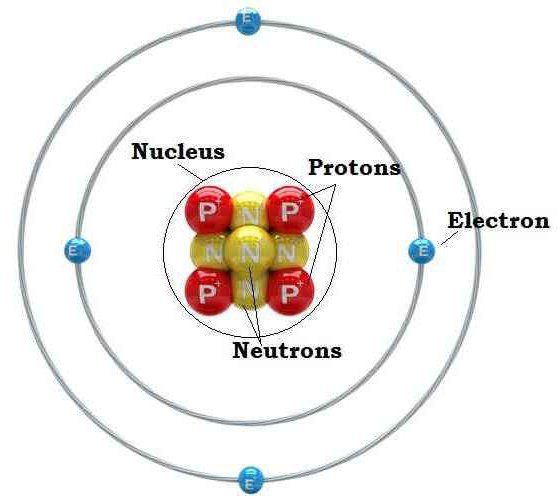
Атом - элементарная частица вещества (хим. элемента), состоящая из определенного набора протонов и нейтронов (ядро атома), и электронов.
Ядро атома состоит из протонов (p+) и нейтронов (n0).Число протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов). Сумма числа нейтронов N(n0), обозначаемого просто буквой N, и числа протонов Z называется массовым числом и обозначается буквой А.Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е-). Число электронов N(e-) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре.
Представление о современной квантово-механической модели атома. Характеристика состояния электронов в атоме с помощью набора квантовых чисел, их трактовка и допустимые значения
Атом– микромир, в котором действуют законы квантовой механики.
Волновой процесс движения электрона в атоме вокруг ядра описывается с помощью волновой функции пси (ψ), которая должна иметь три параметра квантования (3 степени свободы).
Физический смысл– трехмерная амплитуда эл. волны.
n– главное квантовое число, характ. энергетич. уровень в атоме.
l– побочное (орбитальное к.ч.)l=0…n-1, характеризует энергетич. подуровни в атоме и форму атомной орбитали.
ml– магнитное к.ч.ml= -l… +l, характеризует ориентацию элемента в м.п.
ms- спиновое число. Исп. Т.к. каждый электрон имеет свой момет движения
Последовательность заполнения энергетических уровней и подуровней электронами в многоэлектронных атомах. Принцип Паули. Правило Гунда. Принцип минимума энергии.
Пр. Гунда: заполнение происходит последовательно таким образом, чтобы сумма спиновых чисел (момент движения) было максимально.
Принцип Паули: в атоме не может быть 2х эл., у которых все 4 квант. Числа были бы одинаковы
Хn– макс кол-во эл. на энерг. ур.
Согласно принципу, можно рассчитать Хnпо формуле –Xn=2n^2имакс кол-во эл. на энерг подуровне Хl= 2(2l+1).
Начиная с 3его периода наблюдается эффект запаздывания, который объясняется принципом наименьшей энергии: формирование электронной оболочки атома происходит таким образом, что эл. занимают энергетически выгодное положение, когда энергия связи с ядром максимально возможна, а собственная энергия электрона – минимально возможна.
Пр. Кличевского – наиболее энергетически выгодны те подур., у кот. сумма квантовых чиселnиlстремится к мин.
Энергия ионизации и энергия сродства к электрону. Характер их изменения по периодам и группам периодической системы д.И.Менделеева. Металлы и неметаллы.
Энергия ионизации атома - Энергия, необходимая для отрыва электрона от невозбужденного атома, называется первой энергией (потенциалом) ионизации.
Сродство к электрону - Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону (Е).
Энергия ионизации возрастаетв периодах от щелочных металлов к благородным газами уменьшаетсяв группах сверху вниз.
Для элементов главных подгрупп сродство к электрону возрастаетв периодах слева направои уменьшаетсяв группах сверху вниз.
Электроотрицательность химических элементов. Характер изменения электроотрицательности по периодам и группам периодической системы д.И.Менделеева. Понятие степени окисления.
Электроотрицательность– способность атома хим.эл. в соединении притягивать к себе электроны
Методы оценки:
ЭО=I+E(кДж/моль) - полусумма энергий ионизации и сродства(по Маликену)
Относительная шкала по Полингу
Используя относ шкалу э.о. и приняв э.о. F= 4в периоде с увеличением заряда ядра э.о. увелич. и увелич немет. св-ва.
В группе увеличение заряда ядра сопровождается уменьшение э.о. и усиление мет. св-в
Степень окисления (окислительное число)– воображаемый заряд атома электронного соединения, который определяется из предположения, что соединение состоит из ионов
С.о. простых веществ =0
С.о кислорода = -2 (искл. Пероксиды h3O2(-1) и соединения со фтором)
С.о. водорода и щелочных металлов = +1
Отриц С.о. имеют только немет и только одну
В любом ионе алгебраич сумма всех с.о. = заряду иона, а в нейтральных молекулах = 0
Если хим соед сост из мет и немет, то мет +, немет –
Если хим соед сост из 2х немет, то отриц с.о. имеет тот, у кот > э.о.
Периодический закон и периодическая система элементов Д.И.Менделеева. Периоды, группы и подгруппы периодической системы. Связь периодической системы со строением атомов. Электронные семейства элементов.
формулировка периодического закона такова:
«свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Периодическая таблица Менделеева состоит из 8 групп и 7 периодов.
Вертикальные столбцы таблицы называют группами. Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. Это объясняется тем, что элементы одной группы имеют сходные электронные конфигурации внешнего слоя, число электронов на котором равно номеру группы. При этом группа разделяется на главные и побочные подгруппы.
В Главные подгруппы входят элементы, у которых валентные электроны располагаются на внешних ns- и np- подуровнях. В Побочные подгруппы входят элементы, у которых валентные электроны располагаются на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне).
Все элементы в периодической таблице, в зависимости от того, на каком подуровне (s-, p-, d- или f-) находятся валентные электроны классифицируются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III — VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
Горизонтальные ряды таблицы называют периодами. Элементы в периодах отличаются между собой, но общее у них то, что последние электроны находятся на одном энергетическом уровне (главное квантовое число n — одинаково).
studfiles.net
Атом. Представление о строении атома. Электроны, протоны, нейтроны
Атом - элементарная частица вещества (хим. элемента), состоящая из определенного набора протонов и нейтронов (ядро атома), и электронов.
Ядро атома состоит из протонов (p+) и нейтронов (n0).Число протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов). Сумма числа нейтронов N(n0), обозначаемого просто буквой N, и числа протонов Z называется массовым числом и обозначается буквой А.Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е-). Число электронов N(e-) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре.
Представление о современной квантово-механической модели атома. Характеристика состояния электронов в атоме с помощью набора квантовых чисел, их трактовка и допустимые значения
Атом– микромир, в котором действуют законы квантовой механики.
Волновой процесс движения электрона в атоме вокруг ядра описывается с помощью волновой функции пси (ψ), которая должна иметь три параметра квантования (3 степени свободы).
Физический смысл– трехмерная амплитуда эл. волны.
n– главное квантовое число, характ. энергетич. уровень в атоме.
l– побочное (орбитальное к.ч.)l=0…n-1, характеризует энергетич. подуровни в атоме и форму атомной орбитали.
ml– магнитное к.ч.ml= -l… +l, характеризует ориентацию элемента в м.п.
ms- спиновое число. Исп. Т.к. каждый электрон имеет свой момет движения
Последовательность заполнения энергетических уровней и подуровней электронами в многоэлектронных атомах. Принцип Паули. Правило Гунда. Принцип минимума энергии.
Пр. Гунда: заполнение происходит последовательно таким образом, чтобы сумма спиновых чисел (момент движения) было максимально.
Принцип Паули: в атоме не может быть 2х эл., у которых все 4 квант. Числа были бы одинаковы
Хn– макс кол-во эл. на энерг. ур.
Согласно принципу, можно рассчитать Хnпо формуле –Xn=2n^2имакс кол-во эл. на энерг подуровне Хl= 2(2l+1).
Начиная с 3его периода наблюдается эффект запаздывания, который объясняется принципом наименьшей энергии: формирование электронной оболочки атома происходит таким образом, что эл. занимают энергетически выгодное положение, когда энергия связи с ядром максимально возможна, а собственная энергия электрона – минимально возможна.
Пр. Кличевского – наиболее энергетически выгодны те подур., у кот. сумма квантовых чиселnиlстремится к мин.
Энергия ионизации и энергия сродства к электрону. Характер их изменения по периодам и группам периодической системы д.И.Менделеева. Металлы и неметаллы.
Энергия ионизации атома - Энергия, необходимая для отрыва электрона от невозбужденного атома, называется первой энергией (потенциалом) ионизации.
Сродство к электрону - Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону (Е).
Энергия ионизации возрастаетв периодах от щелочных металлов к благородным газами уменьшаетсяв группах сверху вниз.
Для элементов главных подгрупп сродство к электрону возрастаетв периодах слева направои уменьшаетсяв группах сверху вниз.
Электроотрицательность химических элементов. Характер изменения электроотрицательности по периодам и группам периодической системы д.И.Менделеева. Понятие степени окисления.
Электроотрицательность– способность атома хим.эл. в соединении притягивать к себе электроны
Методы оценки:
ЭО=I+E(кДж/моль) - полусумма энергий ионизации и сродства(по Маликену)
Относительная шкала по Полингу
Используя относ шкалу э.о. и приняв э.о. F= 4в периоде с увеличением заряда ядра э.о. увелич. и увелич немет. св-ва.
В группе увеличение заряда ядра сопровождается уменьшение э.о. и усиление мет. св-в
Степень окисления (окислительное число)– воображаемый заряд атома электронного соединения, который определяется из предположения, что соединение состоит из ионов
С.о. простых веществ =0
С.о кислорода = -2 (искл. Пероксиды h3O2(-1) и соединения со фтором)
С.о. водорода и щелочных металлов = +1
Отриц С.о. имеют только немет и только одну
В любом ионе алгебраич сумма всех с.о. = заряду иона, а в нейтральных молекулах = 0
Если хим соед сост из мет и немет, то мет +, немет –
Если хим соед сост из 2х немет, то отриц с.о. имеет тот, у кот > э.о.
Периодический закон и периодическая система элементов Д.И.Менделеева. Периоды, группы и подгруппы периодической системы. Связь периодической системы со строением атомов. Электронные семейства элементов.
формулировка периодического закона такова:
«свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Периодическая таблица Менделеева состоит из 8 групп и 7 периодов.
Вертикальные столбцы таблицы называют группами. Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. Это объясняется тем, что элементы одной группы имеют сходные электронные конфигурации внешнего слоя, число электронов на котором равно номеру группы. При этом группа разделяется на главные и побочные подгруппы.
В Главные подгруппы входят элементы, у которых валентные электроны располагаются на внешних ns- и np- подуровнях. В Побочные подгруппы входят элементы, у которых валентные электроны располагаются на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне).
Все элементы в периодической таблице, в зависимости от того, на каком подуровне (s-, p-, d- или f-) находятся валентные электроны классифицируются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III — VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
Горизонтальные ряды таблицы называют периодами. Элементы в периодах отличаются между собой, но общее у них то, что последние электроны находятся на одном энергетическом уровне (главное квантовое число n — одинаково).
studfiles.net
Строение атома: ядро, нейтрон, протон, электрон
Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра, имеющего положительный электрический заряд, и отрицательно заряженных электронов. Заряд ядра любого химического элемента равен произведению Z на e, где Z — порядковый номер данного элемента в периодической системе химических элементов, е — величина элементарного электрического заряда.
Электрон — это мельчайшая частица вещества с отрицательным электрическим зарядом е=1,6·10-19 кулона, принятым за элементарный электрический заряд. Электроны, вращаясь вокруг ядра, располагаются на электронных оболочках К, L, М и т. д. К — оболочка, ближайшая к ядру. Размер атома определяется размером его электронной оболочки. Атом может терять электроны и становиться положительным ионом или присоединять электроны и становиться отрицательным ионом. Заряд иона определяет число потерянных или присоединенных электронов. Процесс превращения нейтрального атома в заряженный ион называется ионизацией.
Атомное ядро (центральная часть атома) состоит из элементарных ядерных частиц — протонов и нейтронов. Радиус ядра примерно в сто тысяч раз меньше радиуса атома. Плотность атомного ядра чрезвычайно велика. Протоны — это стабильные элементарные частицы, имеющие единичный положительный электрический заряд и массу, в 1836 раз большую, чем масса электрона. Протон представляет собой ядро атома самого легкого элемента — водорода. Число протонов в ядре равно Z. Нейтрон — это нейтральная (не имеющая электрического заряда) элементарная частица с массой, очень близкой к массе протона. Поскольку масса ядра складывается из массы протонов и нейтронов, то число нейтронов в ядре атома равно А — Z, где А — массовое число данного изотопа (см. Периодическая система химических элементов). Протон и нейтрон, входящие в состав ядра, называются нуклонами. В ядре нуклоны связаны особыми ядерными силами.
В атомном ядре имеется огромный запас энергии, которая высвобождается при ядерных реакциях. Ядерные реакции возникают при взаимодействии атомных ядер с элементарными частицами или с ядрами других элементов. В результате ядерных реакций образуются новые ядра. Например, нейтрон может переходить в протон. В этом случае из ядра выбрасывается бета-частица, т. е. электрон.
Переход в ядре протона в нейтрон может осуществляться двумя путями: либо из ядра испускается частица с массой, равной массе электрона, но с положительным зарядом, называемая позитроном (позитронный распад), либо ядро захватывает один из электронов с ближайшей к нему К-оболочки (К-захват).
Иногда образовавшееся ядро обладает избытком энергии (находится в возбужденном состоянии) и, переходя в нормальное состояние, выделяет лишнюю энергию в виде электромагнитного излучения с очень малой длиной волны — гамма-излучение. Энергия, выделяющаяся при ядерных реакциях, практически используется в различных отраслях промышленности.
Атом (греч. atomos — неделимый) наименьшая частица химического элемента, обладающая его химическими свойствами. Каждый элемент состоит из атомов определенного вида. В состав атома входят ядро, несущее положительный электрический заряд, и отрицательно заряженные электроны (см.), образующие его электронные оболочки. Величина электрического заряда ядра равна Z-e, где е — элементарный электрический заряд, равный по величине заряду электрона (4,8·10-10 эл.-ст. ед.), и Z — атомный номер данного элемента в периодической системе химических элементов (см.). Так как неионизированный атом нейтрален, то число электронов, входящих в него, также равно Z. В состав ядра (см. Ядро атомное) входят нуклоны, элементарные частицы с массой, примерно в 1840 раз большей массы электрона (равной 9,1·10-28 г), протоны (см.), заряженные положительно, и не имеющие заряда нейтроны (см.). Число нуклонов в ядре называется массовым числом и обозначается буквой А. Количество протонов в ядре, равное Z, определяет число входящих в атом электронов, строение электронных оболочек и химические свойства атома. Количество нейтронов в ядре равно А—Z. Изотопами называются разновидности одного и того же элемента, атомы которых отличаются друг от друга массовым числом А, но имеют одинаковые Z. Таким образом, в ядрах атомов различных изотопов одного элемента имеется разное число нейтронов при одинаковом числе протонов. При обозначении изотопов массовое число А записывается сверху от символа элемента, а атомный номер внизу; например, изотопы кислорода обозначаются:
Размеры атома определяются размерами электронных оболочек и составляют для всех Z величину порядка 10-8 см. Поскольку масса всех электронов атома в несколько тысяч раз меньше массы ядра, масса атома пропорциональна массовому числу. Относительная масса атома данного изотопа определяется по отношению к массе атома изотопа углерода С12, принятой за 12 единиц, и называется изотопной массой. Она оказывается близкой к массовому числу соответствующего изотопа. Относительный вес атома химического элемента представляет собой среднее (с учетом относительной распространенности изотопов данного элемента) значение изотопного веса и называется атомным весом (массой).
Атом является микроскопической системой, и его строение и свойства могут быть объяснены лишь при помощи квантовой теории, созданной в основном в 20-е годы 20 века и предназначенной для описания явлений атомного масштаба. Опыты показали, что микрочастицы — электроны, протоны, атомы и т. д.,— кроме корпускулярных, обладают волновыми свойствами, проявляющимися в дифракции и интерференции. В квантовой теории для описания состояния микрообъектов используется некоторое волновое поле, характеризуемое волновой функцией (Ψ-функция). Эта функция определяет вероятности возможных состояний микрообъекта, т. е. характеризует потенциальные возможности проявления тех или иных его свойств. Закон изменения функции Ψ в пространстве и времени (уравнение Шредингера), позволяющий найти эту функцию, играет в квантовой теории ту же роль, что в классической механике законы движения Ньютона. Решение уравнения Шредингера во многих случаях приводит к дискретным возможным состояниям системы. Так, например, в случае атома получается ряд волновых функций для электронов, соответствующих различным (квантованным) значениям энергии. Система энергетических уровней атома, рассчитанная методами квантовой теории, получила блестящее подтверждение в спектроскопии. Переход атома из основного состояния, соответствующего низшему энергетическому уровню Е0, в какое-либо из возбужденных состояний Ei происходит при поглощении определенной порции энергии Еi — Е0. Возбужденный атом переходит в менее возбужденное или основное состояние обычно с испусканием фотона. При этом энергия фотона hv равна разности энергий атома в двух состояниях: hv= Ei— Еk где h — постоянная Планка (6,62·10-27 эрг·сек), v — частота света.
Кроме атомных спектров, квантовая теория позволила объяснить и другие свойства атомов. В частности, были объяснены валентность, природа химической связи и строение молекул, создана теория периодической системы элементов.
www.medical-enc.ru
Поговорим о том, как найти протоны, нейтроны и электроны
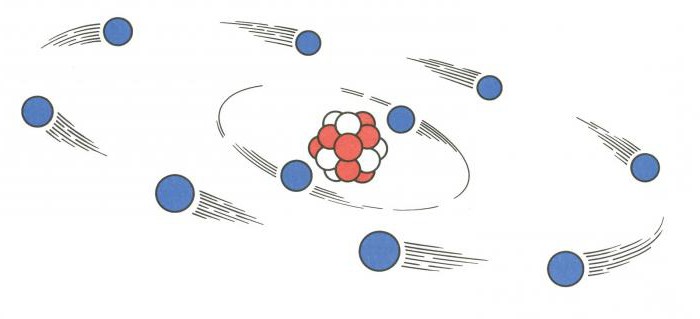
Поговорим о том, как найти протоны, нейтроны и электроны. В атоме существует три вида элементарных частиц, причем у каждой есть свой элементарный заряд, масса.
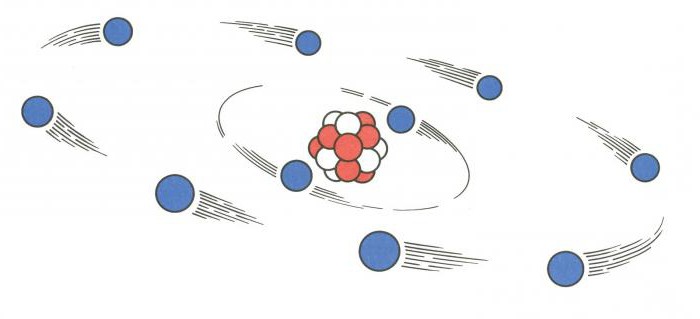
Строение ядра
Для того чтобы понять, как найти протоны, нейтроны и электроны, представим особенности строения ядра. Оно является основной частью атома. Внутри ядра располагаются протоны и нейтроны, именуемые нуклонами. Внутри ядра эти частицы могут переходить друг в друга.
Например, чтобы найти протоны, нейтроны и электроны в атоме водорода, необходимо знать его порядковый номер. Если учесть, что именно этот элемент возглавляет периодическую систему, то в его ядре содержится один протон.
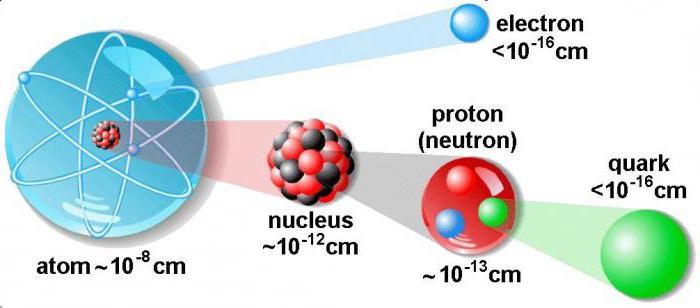
Диаметр атомного ядра составляет десятитысячную долю всего размера атома. В нем сосредоточена основная масса всего атома. По массе ядро превышает в тысячи раз сумму всех электронов, имеющихся в атоме.
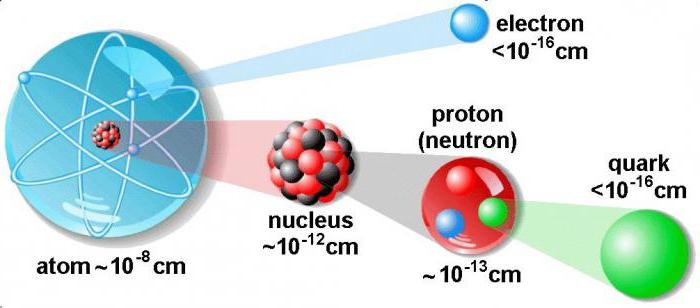
Характеристика частиц
Рассмотрим, как найти протоны, нейтроны и электроны в атоме, и узнаем об их особенностях. Протон - это элементарная частица, которая соответствует ядру атома водорода. Его масса превышает электрон в 1836 раз. Для определения единицы электричества, проходящего через проводник с заданным поперечным сечением, используют электрический заряд.
У каждого атома в ядре располагается определенное количество протонов. Оно является постоянной величиной, характеризует химические и физические свойства данного элемента.
Как найти протоны, нейтроны и электроны в атоме углерода? Порядковый номер данного химического элемента 6, следовательно, в ядре содержится шесть протонов. Согласно планетарной модели строения атома, вокруг ядра по орбитам движется шесть электронов. Для определения количество нейтронов из значения относительной атомной массы углерода (12) вычитаем количество протонов (6), получаем шесть нейтронов.
Для атома железа число протонов соответствует 26, то есть этот элемент имеет 26-й порядковый номер в таблице Менделеева.
Нейтрон является электрически нейтральной частицей, нестабильной в свободном состоянии. Нейтрон способен самопроизвольно превращаться в положительно заряженный протон, испуская при этом антинейтрино и электрон. Средний период его полураспада составляет 12 минут. Массовое число - это суммарное значение количества протонов и нейтронов внутри ядра атома. Попробуем выяснить, как найти протоны, нейтроны и электроны в ионе? Если атом во время химического взаимодействия с другим элементом приобретает положительную степень окисления, то число протонов и нейтронов в нем не изменяется, меньше становится только электронов.
Заключение
Существовало несколько теорий, касающихся строения атома, но ни одна из них не была жизнеспособной. До версии, созданной Резерфордом, не было детального пояснения о расположении внутри ядра протонов и нейтронов, а также о вращении по круговым орбитам электронов. После появления теории планетарного строения атома у исследователей появилась возможность не только определять количество элементарных частиц в атоме, но и предсказывать физические и химические свойства конкретного химического элемента.
fb.ru
Атом, его составные части (ядро, протоны, нейтроны, электроны), их заряд, масса. Химический элемент. Изотопы.
Атом, его составные части (ядро, протоны, нейтроны, электроны), их заряд, масса. Химический элемент. Изотопы.
А́том— частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомное ядро́— центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Состоит из нуклонов – протонов(+) и нейтронов (0). Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами (наоборот – изотонами).Прото́н — элементарная частица, электрический заряд равен +1.Масса протона ~1 а.е.м. Ядро атома водорода состоит из одного протона.Нейтро́н —элементарная частица, не имеющая электрического заряда. Масса = 1 а.е.м.Электро́н— отрицательно заряженная элементарная частица. Из электронов состоят электронные оболочки атомов, где их число и положение определяет почти все химические свойствавеществ. Движение свободных электронов обусловливает такие явления, какэлектрический ток в проводниках и вакууме.Заряд равен −1,602176565(35)·10−19 Кл. Масса электрона равна 9,10938291(40)·10−28 г.Химическийэлемент— совокупность атомов с одинаковым зарядом ядра и числомпротонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе Менделеева. Формой существования химических элементов в свободном виде являются простые вещества. Порядковый номер элемента в ней равен заряду ядра, который, в свою очередь, численно равен числу содержащихся в ядре протонов. Суммарное число протонов и нейтронов в ядре равномассовому числу А. Количество протонов равно количеству электронов.Изото́пы— разновидности атомов какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа. Пример изотопов: 168O (заряд ядра = 8, атомная масса = 16), 178O, 188O — три стабильных изотопа кислорода.
Периодический закон Д.И.Менделеева. Структура периодической системы: периоды, группы, подгруппы. Особенности электронного строения атомов главных и побочных подгрупп.
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».Период — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки. Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл.Группа — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением.Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома. В короткопериодном варианте периодической системы группы подразделяются на подгруппы— главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы. Элементы одной подгруппы обладают сходными химическими свойствами.У атомов элементов главных подгрупп заполняются электронами последние уровни, а у побочных - предпоследние. Число электронов на последнем уровне у элементов главных подгрупп совпадает с номером их группы, у элементов побочных подгрупп – нет.
Изменение свойств элементов в периодической системе
см. п. 4
О связи элементов ПС элементов со строением атома смотри начало 4 билета
Ионные реакции.
Ионные реакции — реакции между ионами в растворе. Например, реакциюAgNO3 + NaCl = NaNO3 + AgClможно представить в ионном виде (реакция расписывается на ионы, не расписываются осадки, газы, вода, слабые кислоты и основания, а также малорастворимые и нерастворимые соединения) например AgCl нерастворим в воде и на ионы не расписывается:Ag+ + NO3− + Na+ + Cl− = AgCl + Na+ + NO3−Одинаковые ионы сокращаются и получается сокращенное ионное уравнение. Так как взаимодействие произошло между ионами Ag+ и ионами Cl−, то выражение Ag+ + Cl− = AgClи есть ионное уравнение рассматриваемой реакции. Оно проще молекулярного и в то же время отражает сущность происходящей реакции.
Условия необратимости ионной реакции: 1. Если в результате реакции выделяется малодиссоциирующее вещество – вода.Молекулярное уравнение реакции щелочи с кислотой: Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.Полное ионное уравнение реакции:K+ + OH– + H+ + Cl– = K+ + Cl– + h3O.Cокращенное ионное уравнение реакции: H+ + OH– = h3O.Молекулярное уравнение реакции основного оксида с кислотой:CaO + 2HNO3 = Ca(NO3)2 + h3O.Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции: CaO + 2H+ = Ca2+ + h3O.Молекулярное уравнение реакции нерастворимого основания с кислотой:3Mg(OH)2 + 2h4PO4 = Mg3(PO4)2 + 6h3O. Полное ионное уравнение реакции: В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.Молекулярное уравнение реакции амфотерного оксида с кислотой:Al2O3 + 6HCl = 2AlCl3 + 3h3O.Полное ионное уравнение реакции:Al2O3 + 6H+ + 6Cl– = 2Al3+ + 6Cl– + 3h3O. Cокращенное ионное уравнение реакции:Al2O3 + 6H+ = 2Al3+ + 3h3O.
2. Если в результате реакции выделяется нерастворимое в воде вещество.Молекулярное уравнение реакции растворимой соли со щелочью:CuCl2 + 2KOH = 2KCl + Cu(OH)2 .Полное ионное уравнение реакции: Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH)2 .
Cокращенное ионное уравнение реакции: Cu2+ + 2OH– = Cu(OH)2 . Молекулярное уравнение реакции двух растворимых солей:Al2(SO4)3 + 3BaCl2 = 3BaSO4 + 2AlCl3.Полное ионное уравнение реакции: Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции нерастворимого основания с кислотой:Fe(OH)3 + h4PO4 = FePO4 + 3h3O. Полное ионное уравнение реакции: В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
3. Если в результате реакции выделяется газообразное вещество.Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:K2S + 2HCl = 2KCl + h3S .Полное ионное уравнение реакции: 2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + h3S . Cокращенное ионное уравнение реакции: S2– + 2H+ = h3S . Молекулярное уравнение реакции растворимой соли (карбоната) с кислотой:Na2CO3 + 2HNO3 = 2NaNO3 + h3O + CO2 Полное ионное уравнение реакции: Cокращенное ионное уравнение реакции: О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV).Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:3СaCO3 + 2h4РO4 = Са3(PO4)2 + 3h3O + 3CO2 Полное ионное уравнение реакции: В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
По природе лиганда
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(Nh4)4]SO4, [Co(Nh4)6]Cl3, [Pt(Nh4)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(h3O)6]Cl2, [Al(h3O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: h3[CoCl4], h3[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
Элементы VIIА подгруппы.
Галогены - химические элементы 7-й группы периодической таблицы химических элементов Д.И. Менделеева. Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается. Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.FClBrI--------->неметаллические свойства ослабевают, окислительная способность падает. Г2 + 2e --> 2Г-Физические свойства простых веществ - все галогены токсичны, плохо растворимы в h3O1Vh3O – 2.3VCl2 (20°C)2F2 + 2h3O -->4HF + O2Cl2; Br2; J2 – подвергаются гидролизу (образуется хлорная, бромная либо йодная вода).Г2 + h3O<-->НГ + НГО
Химические свойства.F2 не реагирует с C; N2; O2Cl2 не реагирует с C; N2Галогеноводороды h3 + Г 2 --> 2НГ (синтез)HF – взрыв HCl – на светуHJ – при нагреванииCaF2 + h3SO4(конц)-->CaSO4 + 2HFNaCl + h3SO4 -->NaHSO4 + HCl(газ) NaCl + NaHSO4 -->Na2SO4 + HCl(газ)(дляJ; Br) РГ3 + h3O<--> 3НГ + h4PO4 НГ – растворяется в воде с образованием кислоты.HFHClHBrHJ ---------->(сила кислот увеличивается, устойчивость уменьшается, восстановительные свойства усиливаются)HClO – хлорноватистая (гипохлориты)HClO2 – хлористая (хлориты)HClO3 – хлорноватая (хлораты)HClO4 – хлорная (перхлораты) HClOHClO2HClO3HClO4--------------------->(окислительные свойства уменьшаются, сила кислот увеличивается)
Оксиды и гидроксиды.
CO2 + 2h3 -->C + 2h3O
CO2 + h3O <--> h3CO3
SiO2 + h3O --> (неидет)
SnO + h3SO4 --> SnSO4 +h3O
SnO + NaOH + h3O <--> Na[Sn(OH)3]
2SnO + O2 --> 2SnO2
Sn(OH)2 + 3HCl --> H[SnCl3] + 2h3O
Sn(OH)2 + NaOH --> Na[Sn(OH)3]
Pb(OH)2 + 2HCl --> PbCl2 + 2h3O
Pb(OH)2 + NaOH --> Na2[Pb(OH)4]
Pb(OH)2 + CO2 --> Pb2(OH)2CO3
Атом, его составные части (ядро, протоны, нейтроны, электроны), их заряд, масса. Химический элемент. Изотопы.
А́том— частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомное ядро́— центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Состоит из нуклонов – протонов(+) и нейтронов (0). Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами (наоборот – изотонами).Прото́н — элементарная частица, электрический заряд равен +1.Масса протона ~1 а.е.м. Ядро атома водорода состоит из одного протона.Нейтро́н —элементарная частица, не имеющая электрического заряда. Масса = 1 а.е.м.Электро́н— отрицательно заряженная элементарная частица. Из электронов состоят электронные оболочки атомов, где их число и положение определяет почти все химические свойствавеществ. Движение свободных электронов обусловливает такие явления, какэлектрический ток в проводниках и вакууме.Заряд равен −1,602176565(35)·10−19 Кл. Масса электрона равна 9,10938291(40)·10−28 г.Химическийэлемент— совокупность атомов с одинаковым зарядом ядра и числомпротонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе Менделеева. Формой существования химических элементов в свободном виде являются простые вещества. Порядковый номер элемента в ней равен заряду ядра, который, в свою очередь, численно равен числу содержащихся в ядре протонов. Суммарное число протонов и нейтронов в ядре равномассовому числу А. Количество протонов равно количеству электронов.Изото́пы— разновидности атомов какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа. Пример изотопов: 168O (заряд ядра = 8, атомная масса = 16), 178O, 188O — три стабильных изотопа кислорода.
cyberpedia.su
Поговорим о том, как найти протоны, нейтроны и электроны
Образование 22 декабря 2016Поговорим о том, как найти протоны, нейтроны и электроны. В атоме существует три вида элементарных частиц, причем у каждой есть свой элементарный заряд, масса.
Строение ядра
Для того чтобы понять, как найти протоны, нейтроны и электроны, представим особенности строения ядра. Оно является основной частью атома. Внутри ядра располагаются протоны и нейтроны, именуемые нуклонами. Внутри ядра эти частицы могут переходить друг в друга.
Например, чтобы найти протоны, нейтроны и электроны в атоме водорода, необходимо знать его порядковый номер. Если учесть, что именно этот элемент возглавляет периодическую систему, то в его ядре содержится один протон.
Диаметр атомного ядра составляет десятитысячную долю всего размера атома. В нем сосредоточена основная масса всего атома. По массе ядро превышает в тысячи раз сумму всех электронов, имеющихся в атоме.
Характеристика частиц
Рассмотрим, как найти протоны, нейтроны и электроны в атоме, и узнаем об их особенностях. Протон - это элементарная частица, которая соответствует ядру атома водорода. Его масса превышает электрон в 1836 раз. Для определения единицы электричества, проходящего через проводник с заданным поперечным сечением, используют электрический заряд.
У каждого атома в ядре располагается определенное количество протонов. Оно является постоянной величиной, характеризует химические и физические свойства данного элемента.
Как найти протоны, нейтроны и электроны в атоме углерода? Порядковый номер данного химического элемента 6, следовательно, в ядре содержится шесть протонов. Согласно планетарной модели строения атома, вокруг ядра по орбитам движется шесть электронов. Для определения количество нейтронов из значения относительной атомной массы углерода (12) вычитаем количество протонов (6), получаем шесть нейтронов.
Для атома железа число протонов соответствует 26, то есть этот элемент имеет 26-й порядковый номер в таблице Менделеева.
Нейтрон является электрически нейтральной частицей, нестабильной в свободном состоянии. Нейтрон способен самопроизвольно превращаться в положительно заряженный протон, испуская при этом антинейтрино и электрон. Средний период его полураспада составляет 12 минут. Массовое число - это суммарное значение количества протонов и нейтронов внутри ядра атома. Попробуем выяснить, как найти протоны, нейтроны и электроны в ионе? Если атом во время химического взаимодействия с другим элементом приобретает положительную степень окисления, то число протонов и нейтронов в нем не изменяется, меньше становится только электронов.
Видео по теме
Заключение
Существовало несколько теорий, касающихся строения атома, но ни одна из них не была жизнеспособной. До версии, созданной Резерфордом, не было детального пояснения о расположении внутри ядра протонов и нейтронов, а также о вращении по круговым орбитам электронов. После появления теории планетарного строения атома у исследователей появилась возможность не только определять количество элементарных частиц в атоме, но и предсказывать физические и химические свойства конкретного химического элемента.
Источник: fb.ruКомментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы
Query failed: connection to localhost:9312 failed (errno=111, msg=Connection refused).
monateka.com
Атом. Представление остроении атома. Электроны, протоны, нейтроны — КиберПедия
Атом. Представление остроении атома. Электроны, протоны, нейтроны
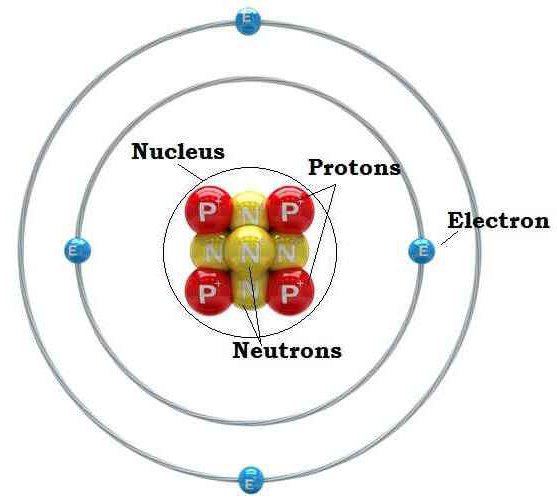
Атом - элементарная частица вещества (хим. элемента), состоящая из определенного набора протонов и нейтронов (ядро атома), и электронов.
Ядро атома состоит из протонов (p+) и нейтронов (n0). Число протонов N(p+) равно заряду ядра (Z) ипорядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов). Сумма числа нейтронов N(n0), обозначаемого просто буквой N, и числа протонов Z называется массовым числом и обозначается буквой А. Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е-). Число электронов N(e-) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре.
Представление о современной квантово-механической модели атома. Характеристика состояния электронов в атоме с помощью набора квантовых чисел, их трактовка и допустимые значения
Атом – микромир, в котором действуют законы квантовой механики.
Волновой процесс движения электрона в атоме вокруг ядра описывается с помощью волновой функции пси (ψ), которая должна иметь три параметра квантования (3 степени свободы).
Физический смысл – трехмерная амплитуда эл. волны.
n – главное квантовое число, характ. энергетич. уровень в атоме.
l – побочное (орбитальное к.ч.) l=0…n-1, характеризует энергетич. подуровни в атоме и форму атомной орбитали.
ml – магнитное к.ч. ml= -l… +l, характеризует ориентацию элемента в м.п.
ms- спиновое число. Исп. Т.к. каждый электрон имеет свой момет движения
Последовательность заполнения энергетических уровней и подуровней электронами в многоэлектронных атомах. Принцип Паули. Правило Гунда. Принцип минимума энергии.
Пр. Гунда: заполнение происходит последовательно таким образом, чтобы сумма спиновых чисел (момент движения) было максимально.
Принцип Паули: в атоме не может быть 2х эл., у которых все 4 квант. Числа были бы одинаковы
Хn – макс кол-во эл. на энерг. ур.
Согласно принципу, можно рассчитать Хn по формуле – Xn=2n^2 и макс кол-во эл. на энерг подуровне Хl = 2(2l+1).
Начиная с 3его периода наблюдается эффект запаздывания, который объясняется принципом наименьшей энергии: формирование электронной оболочки атома происходит таким образом, что эл. занимают энергетически выгодное положение, когда энергия связи с ядром максимально возможна, а собственная энергия электрона – минимально возможна. 
Пр. Кличевского– наиболее энергетически выгодны те подур., у кот. сумма квантовых чисел n и l стремится к мин.
Энергия ионизации и энергия сродства к электрону. Характер их изменения по периодам и группам периодической системы Д.И.Менделеева. Металлы и неметаллы.
Энергия ионизации атома- Энергия, необходимая для отрыва электрона от невозбужденного атома, называется первой энергией (потенциалом) ионизации.
Сродство к электрону - Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону (Е).
Энергия ионизации возрастает в периодах от щелочных металлов к благородным газам и уменьшается в группах сверху вниз.
Для элементов главных подгрупп сродство к электрону возрастает в периодах слева направо и уменьшается в группах сверху вниз.
Периодический закон и периодическая система элементов Д.И.Менделеева. Периоды, группы и подгруппы периодической системы. Связь периодической системы со строением атомов. Электронные семейства элементов.
формулировка периодического законатакова:
«свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Периодическая таблица Менделеева состоит из 8 групп и 7 периодов.
Вертикальные столбцы таблицы называют группами. Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. Это объясняется тем, что элементы одной группы имеют сходные электронные конфигурации внешнего слоя, число электронов на котором равно номеру группы. При этом группа разделяется на главные и побочные подгруппы.
В Главные подгруппы входят элементы, у которых валентные электроны располагаются на внешних ns- и np- подуровнях. В Побочные подгруппы входят элементы, у которых валентные электроны располагаются на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне).
Все элементы в периодической таблице, в зависимости от того, на каком подуровне(s-, p-, d- или f-) находятся валентные электроны классифицируются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III — VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
Горизонтальные ряды таблицы называют периодами. Элементы в периодах отличаются между собой, но общее у них то, что последние электроны находятся на одном энергетическом уровне (главное квантовое число n — одинаково).
Метод валентных связей
В образовании ковалент хим связей участвуют только валентные атомные орбитали (электроны), а остальные локализованы возле ядра атома.
Основные положения:
В образовании ков хим св участвуют только валентные атомные орбитали
Ковалет св образуется двумя электронами с антипараллельными спинами
Связь располагается в том направлении, в кот возможность перекрывания электронных облаков минимальна
8. Два механизма образования ковалентной связи: обычный и донорно-акцепторный.


9. Гибридизация валентных атомных орбиталей: sр-, sp2-, sp3-гибридизация. Геометрическая форма и полярность молекул. Основные характеристики ковалентных связей: длина, энергия, направленность, насыщаемость, валентные углы.
Гибридизация – это энергетическое выравнивание валентных атомных орбиталей, сопровождающееся выравниванием форм эл. облаков
Гибридные атомные орбитали имеют форму направленной восьмерки в плоскости, в трехмерном пространстве – укороченная гантель, называемая q –а.о.
| Тип гибридизации | Геометрическая форма | Примеры |
| Sp | линейная | BeCl2 |
| sp2 | треугольная | BCl3 |
| sp3 | тетраэдрическая | Ch5 |
| sp3d | тригонально-бипирамидальная | PCl5 |
| sp3d2 | октаэдрическая | SF6 |
Полярность молекул определяется их составом и геометрической формой.
Неполярными (р = O) будут:
а) молекулы простых веществ, так как они содержат только неполярные ковалентные связи;
б) многоатомные молекулы сложных веществ, если их геометрическая форма симметрична.
Полярными (р > O) будут:
а) двухатомные молекулы сложных веществ, так как они содержат только полярные связи;
б) многоатомные молекулы сложных веществ, если их строение асимметрично, т. е. их геометрическая форма либо незавершенная, либо искаженная, что приводит к появлению суммарного электрического диполя, например у молекул Nh4, Н2О, HNО3 и HCN.
Энергия ков.св.|Ех.с.(кДж/моль) –кол-во энергии, выделяемое при возникновении хим св в объеме 1 моля элементов
Длина ков св – определяется, как прямая, соединяющая ядра атомов хим элементов
Насыщаемость ков хим св – каждая валентная а.о. у атома может образовывать только одну хим связь т.е. только 1 раз перекрываться с а.о. других атомов
Направленность – обуславливает молекулярное строение веществ и геометрич. форму их молекул. Углы между 2мя связями называются валентными.
Полярность – обуславливается неравномерном распределением электронной плотности вследствие различных электроотрицательных атомов в молекуле, образованной атомами одного и того же электрона (o2, cl2…) общее эл. облако распределено симметрично относительно ядер атомов, т.к. разность электроотрицательности = 0. Такие хим связи называются полярными.
В молекулах типа HF HCl общее эл облако смещено в сторону ядра частицы с большей величиной э.о. такие связи называют неполярными
Реакции, отличающиеся по тепловому эффекту – эндо- и экзотермические. Превращения энергии при химических реакциях. Первый закон термодинамики. Функции состояния: внутренняя энергия, энтальпия, энтропия, энергия Гиббса.
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты.
Эндотермическая реакция - химическая реакция, при которой происходит поглощение теплоты.
Выделение или поглощение энергии происходит в виде теплоты. Это позволяет судить о наличии в веществах определенного количества некоторой энергии (внутренней энергией реакции).
При химических реакциях происходит освобождение части энергии, содержащейся в веществах, это носит название теплового эффекта реакции. по которому можно судить об изменении количества внутренней энергии вещества.
Во время химических реакций происходит взаимное превращение энергий – внутренней энергии веществ в тепловую, лучистую, электрическую и механическую, и наоборот.
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
ΔU = A + Q,
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
Из (ΔU = A + Q) следует закон сохранения внутренней энергии. Если систему изолировать от внешних воздействий, то A = 0 и Q = 0, а следовательно, и ΔU = 0.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:

где A' — работа, совершаемая системой (A' = -A).
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Функцией состояния называется такая переменная характеристика системы, которая не зависит от предыстории системы и изменение которой при переходе системы из одного состояния в другое не зависит от того, каким образом было произведено это изменение.
Внутренняя энергия характеризует общий запас системы (все виды энергии системы)
Энтропия – есть мера неупорядоченности системы. Энтпропия вводится как функция состояния, изменение которой определяется отношением количества теплоты, полученное или отданное системой при t – T.
Энтальпией образования сложного вещества из простых веществ называется тепловой эффект реакции образования данного вещества из простых веществ в стандартных состояниях, отнесенный к 1 молю получающегося вещества
Энергия Гиббса- это величина, показывающая изменение энергии в ходе химической реакции.
Основные понятия химической кинетики. Скорость химической реакции. Факторы, влияющие на скорость реакции в гомогенных и гетерогенных процессах.
Химическая кинетика – изучает скорость химической реакции и зависимость ее от различных факторов, а также механизм протекания химических реакций.
Скоростью химической реакции называют число элементарных актов реакции, происходящих в единицу времени.
Скорость химической реакции зависит от:
1) концентрации реагирующих веществ;
2) температуры;
3) присутствия катализаторов;
4) природы реагирующих веществ;
5) степени измельчения твердого вещества;
6) перемешивания, если вещества находятся в растворенном состоянии.
Vист = 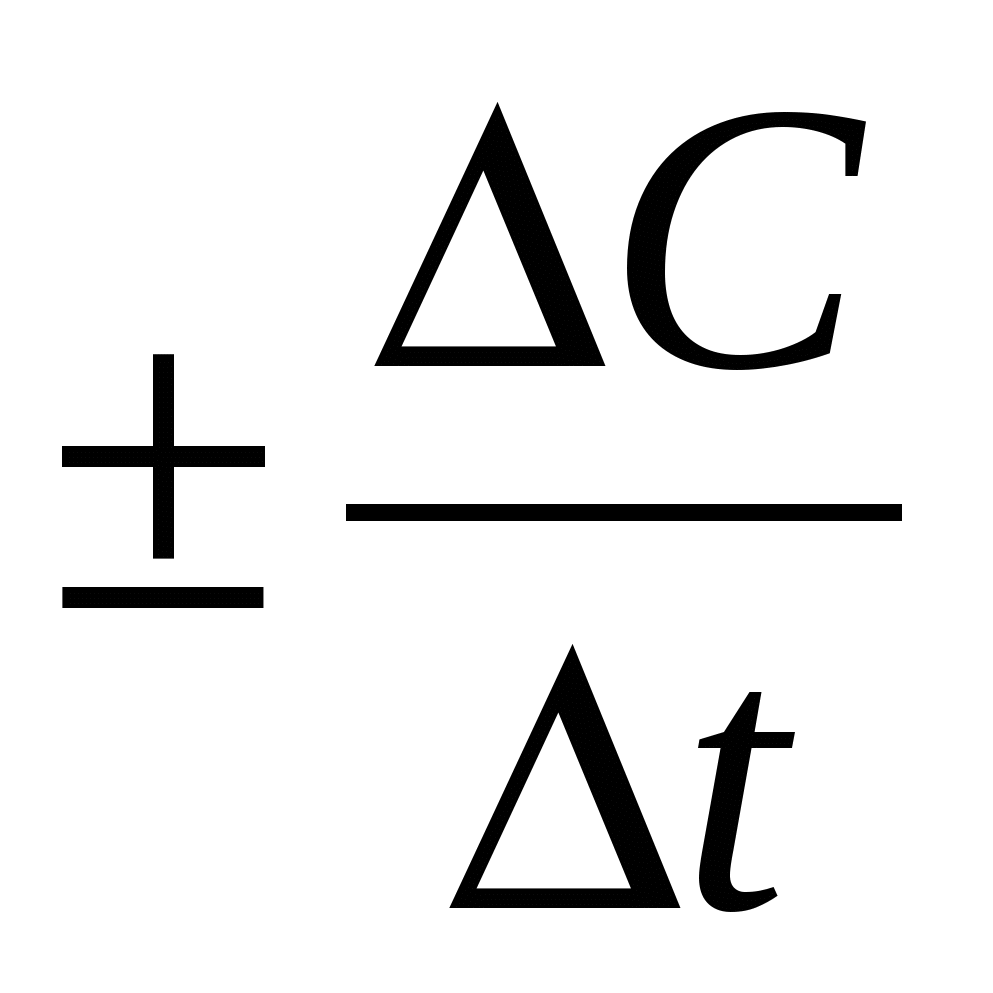
Средняя скорость каждой реакции определяется изменением молярной концентрации реагирующих в-в за промежуток времени. (моль/(литр*с))
21. Влияние концентрации на скорость химической реакции. Закон действующих масс.
Закон действующих масс показывает зависимость скорости хим. реакц. от концентрации реагир. в-в.
Скорость хим. реакт. Прямо пропорциональна произв. конц. реагирующих в-в, взятых в степенях их стехиометрических коэф.



 Для газовых реакций можно пользоваться парциальным давлением.Закон справедлив только для ГОМОГЕННЫХ систем. Если система гетерогенная, то скор. Реакц. Зависит от пов-ти раздела(степени давления) твердой фазы.
Для газовых реакций можно пользоваться парциальным давлением.Закон справедлив только для ГОМОГЕННЫХ систем. Если система гетерогенная, то скор. Реакц. Зависит от пов-ти раздела(степени давления) твердой фазы.
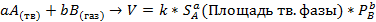
При повышении температуры увеличивается запас внутренней энергии молекул. Всё большее их число становятся активными. Как следствие этого, возрастает доля эффективных соударений между молекулами за единицу времени, а значит и скорость химической реакции.
При повышении температуры концентрации исходных веществ в реакционной смеси практически не изменяются. Значит, увеличение скорости реакции в соответствии с главным кинетическим уравнением должно быть связано с возрастанием её константы скорости.
Голландский учёный Вант-Гофф опытным путём определил, что для химических реакций (имеющих нормальный тип зависимости скорости от температуры) при повышении температуры на каждые 10 градусов величина константы скорости возрастает в 2-4 раза. Причём для каждой химической реакции это число является постоянным и может принимать из указанного интервала как целочисленные (2, 3, 4) значения, так и дробные. Оно определяется экспериментально, называется температурным коэффициентом скорости химической реакции или коэффициентом Вант-Гоффа и обозначается греческой буквой γ:
γ = 
где kТ – константа скорости химической реакции при температуре, равной Т; kT+10 – константа скорости химической реакции при температуре, повышенной, по сравнению с исходной, на 10 градусов.
Энергию активации химической реакции (Еа) по физическому смыслу можно определить как тот избыток энергии, по сравнению со средней энергией неактивных молекул исходных веществ в реакционной системе при данной температуре, который им нужно сообщить, чтобы столкновения между ними привели к химической реакции.
Минимальный запас энергии, которым должны обладать молекулы для вступления в ту или иную реакцию, можно рассматривать как своеобразный энергетический барьер этой реакции.
Причём, чем он выше, тем меньшее число молекул способно его преодолеть. Зная общее число молекул в системе и величину энергии активации для данной реакции, количество таких активных молекул можно рассчитать по закону Максвелла-Больцмана
Na = No∙
где Na – число активных молекул, No– общее число молекул.
Типы гидролиза солей
Химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и сопровождающееся изменением рН раствора, называется гидролизом солей.
Любую соль можно представить, как продукт взаимодействия кислоты и основания. Тип гидролиза соли зависит от природы основания и кислоты, образующих соль. Возможны 3 типа гидролиза солей.
Гидролиз по аниону идет, если соль образована катионом сильного основания и анионом слабой кислоты. Например, соль СН3СООNa образована сильным основанием NaOH и слабой одноосновной кислотой СН3СООН. Гидролизу подвергается ион слабого электролита СН3СОО–.
Гидролиз по катиону идет, если соль образована катионом слабого основания и анионом сильной кислоты. Например, соль CuSO4 образована слабым двухкислотным основанием Cu(OH)2 и сильной кислотой h3SO4. Гидролиз идет по катиону Cu2+ и протекает в две стадии с образованием в качестве промежуточного продукта основной соли.
Гидролиз по катиону и аниону идет, если соль образована катионом слабого основания и анионом слабой кислоты. Например, соль Ch4COONh5 образована слабым основанием Nh5OH и слабой кислотой СН3СООН. Гидролиз идет по катиону Nh5+ и аниону СН3СОО–.
Количественно гидролиз можно охарактеризовать при помощи константы гидролиза (КГ) и степени гидролиза (h).
Константа гидролиза (KГ) - это отношение ионного произведения воды (Kw) к константе диссоциации слабого основания или слабой кислоты, образующих данную соль.
Частное от деления одной постоянной величины на другую есть также величина постоянная. Поэтому KГ - величина постоянная, которая характеризует способность соли подвергаться гидролизу. Значение KГ зависит от природы соли, температуры и не зависит от концентрации раствора.
1. Для солей типа Nh5Cl:
 . .
| (1) |
Чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
2. Для солей типа Ch4COONa:
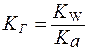 . .
| (2) |
Чем слабее кислота, тем в большей степени подвергаются гидролизу соли, образованные этой кислотой.
3. Для солей типа Nh5CN:
 . .
| (3) |
Чем слабее кислота и основание, образующие соль, тем в большей степени протекает гидролиз соли.
4. Для солей типа Na2CO3(две ступени гидролиза):
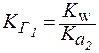 | (4) |
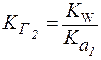 | (4´) |
Так как  , следовательно,
, следовательно,  . Таким образом, по первой ступени гидролиз солей всегда протекает в большей степени.
. Таким образом, по первой ступени гидролиз солей всегда протекает в большей степени.
Степень гидролиза (h) - отношение количества гидролизованной соли к общему количеству растворенной соли, обычно выражаемое в процентах.
Если, например, в воде было растворено 2 моль соли, а гидролизу подверглось 0,01 моль, то  .
.
Степень гидролиза зависит от многих факторов:
1. В первую очередь, она зависит от химической природы составляющих данную соль ионов. Так, в растворах Ch4COONa и NaCN с молярными концентрациями 0,1 моль/л при 250С степень гидролиза солей различна:
h(Ch4COONa) = 0,01%, a h(NaCN) = 1,5%.
Это объясняется различной силой кислот, составляющих соли:


 .
.
Таким образом:
Чем слабее кислота (основание), образующие соль, тем выше степень гидролиза.
2. Степень гидролиза сильно меняется c изменением температуры раствора соли. Действительно, процесс гидролиза является эндотермическим, поэтому:
Чем выше температура, тем больше степень гидролиза.
3. Степень гидролиза зависит от концентрации раствора:
Чем меньше концентрация раствора соли, тем больше степень гидролиза.
Степень гидролиза может быть выражена через константу гидролиза:
1. Для солей типаNh5Cl:
 . .
| (5) |
2. Для солей типаCh4COONa:
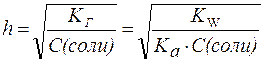 | (6) |
3. Для солей типаNh5CN:
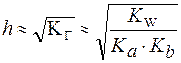 | (7) |
Таким образом, степень гидролиза солей, образованных слабой кислотой и слабым основанием, практически не зависит от концентрации раствора соли.
34. Электродный потенциал. Возникновение скачка потенциала на межфазной границе. Понятие об электродной системе и электродной реакции.
Электродный потенциал- относительная величина т.к. измеряется относительно эталона, за эталон принимается водородный электрод
Скачек потенциала
При протекании электрохимической реакции на поверхности электродов 1 род образуется положительный или отрицательный заряд относительно прилегающего слоя раствора, который называется скачек потенциала. Этот скачек измерить сложно, поэтому вводят понятие электродный потенциал
35. Электродные системы, их классификация. Оx- и red- определяющие частицы в электродных системах разного типа.
1 рода состоит из металлического электрода – проводника опущенного в водный раствор электролита, который имеет также катионы этого металла . (Металл опущен в раствор своей соли). Электрод проводник – RED, а его катион - OX
2 рода состоит из электрода проводника металла, покрытого малорастворимым соединением, имеющим те же анионы этого металла, и опущен в раствор электролита, содержащий одноименные анионы малорастворимого соединения. В электродах второго рода окисленной формой является малорастворимое соединение (МА), восстановленной – атом металла (М) и анион раствора (АZ-).
Неметаллические электроды
Неметаллические электроды - системы состоящие из электрода проводника не участвующего в электродной реакции, а являющиеся поставщиками электронов для электродной реакции. Если в неметаллическом электроде частицы OX и RED являются ионами, то такие электроны называются редокси. Если одна из потенциалоопределяющих частиц- газ, то такие электроды называются газовыми.
Понятие о стандартном равновесном электродном потенциале. Таблица стандартных электродных потенциалов. Электрохимический ряд напряжений металлов и его использование для оценки электрохимической активности металлов.
36. а) Стандартный водородный электрод. Кислородный электрод.
Для стандартных условий, т.е. когда активность ионов водорода и парциальное давление водорода равны 1, а температура 250 С, по всеобщему соглашению принимается, что стандартный потенциал водородного электрода равен нулю. Водородный электрод называют электродом сравнения.
Уравнение Нернста для водородного электрода: ϕ H+/h3=-0.059*PH
Для кислородного ϕOH-/O2=1.23-0.059PH
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем.
Окислительные
Пассивация
В компактном состоянии на поверхности металла образуется слой – пленки из окисной фазы, которая может предохранять от дальнейшей коррозии. Данное явление называется самопассивацией.Условие сплошности пленки определяется правилом Пиллинга и Бедвортса

 на поверхности металла образуется достаточно прочная пленка
на поверхности металла образуется достаточно прочная пленка
 образуется рыхлая пленка
образуется рыхлая пленка
 потресковшаяся пленка не защищающая от коррозии
потресковшаяся пленка не защищающая от коррозии
42. Химическое взаимодействие металлов с растворами щелочей.
С щелочами способны взаимодействовать только те металлы, оксиды и гидроксиды которых обладают амфотерными и кислотными свойствами. Это металлы : Be, Zn, Al, Ti, Ta, Cr, Mo, W, Mn, V, NbМеталлы, у которых оксиды и гидроксиды обладают только основными свойствами к щелочам химически устойчивы (щелочные и щелочно-земельные металлы)
Щелочи в растворах и расплавах выполняют только роль среды, и окислителем по отношению к металлам в растворах щелочей является h3O , в расплавах окислитель – O2
43. Химическое взаимодействие металлов с водой.
В зависимости от активности металла, реакция протекает при различных условиях и образуются разные продукты.
1). Взаимодействие с самыми активными металлами, стоящими в периодической системе в I А и I I А группах (щелочные и щелочно-земельные металлы) и алюминий. В ряду активности эти металлы расположены до алюминия (включительно)
Реакция протекает при обычных условиях, при этом образуется щелочь и водород.
активные металлы -Li, Na, K, Rb, Cs, Fr, Ca, Sr, Ba, Ra + Al – реагируют так
| Me + h3O = Me(OH)n + h3 (р. замещения) основание |
2) Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Реакция протекает только с парообразной водой, т.е. при нагревании.
При этом образуются: оксид этого металла и водород.
металлы средней активности, стоящие в ряду активности до (Н2) –Be, Mg, Fe, Pb, Cr,Ni, Mn, Zn – реагируют так
| Me + Н2О = Мех Оу + Н2(р. замещения) Оксид металла |
Катодные процессы
Поскольку катионы и молекулы воды принимают электроны от катода на инертном катоде в нейтральном растворе в первую очередь восстанавливаются те частицы, которые обладают наибольшей окислительной способностью (чем больше потенциал тем >OX способности.
Для воды надо рассчитать по уравнению Нернста как для водородного электрода ϕh3O/h3 =-0.059*PH
Анодные процессы
Поскольку анионы и молекулы воды отдают электроны аноду, то в нейтральном растворе в первую очередь окисляются те частицы, которые обладают большей восстановительной способностью (с наименьшим электродным потенциалом) ϕO2/h3O =1,23-0.059*PH
45. Процессы анодного окисления и катодного восстановления. Электролиз с инертным и растворяющимся анодом.
Катодный процесс.
Поскольку катион и молекулы воды принимают электроды от катода, на инертном катоде в нейтральном растворе в первую очередь восстанавливаются те частицы, которые облад наибольшей окислительной способностью ( чем больше потенциал, тем выше их окисл способ)
ур.Нерснста – ϕh30/h3 =-0.059pH.
После воды не разряжаются (<-0.41)
Анодный процесс.
Поскольку анионы и h30 отдают электроны аноду, то в нейтральном растворе в первую очередь окисляются те частицы, которые обладают большей восст. Способностью (с наименьшим потенциалом).
Для h3O по ур Нернста ϕoh/h30=1.23-0.059pH
Сложные кислородсодержащие анионы не могут окисляться на аноде из водных растворов если ионы мет и немет в их состояниях имеют макс ст окисл
Искл – S+6O4 до S2O8
Металлы не могут принимать участие в процессе восстановления на катоде.
46. Расчеты масс веществ – продуктов электролиза по закону Фарадея. Выход по току продуктов электролиза.
m = AIT/nF
A – атомная масса эл
I – величина тока
T – время
F – пост. фарадея
N – валетность
Э – хим экв = A/n (m= ЭIT/F) в часах – ЭIT/26.8
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Выход вещества B=mфакт/mтеор*100%
Mфакт – фактическая масса вещ-ва на аноде и катоде
Mтеор – рассчитанная масса по формулам
47. Химический анализ. Качественный анализ неорганических веществ. Характерные и специфические реакции. Аналитическая классификация катионов и анионов.
Химический анализ - определение химического состава и строения веществ; включает качественный и количественный анализ.
Задачей качественного анализа является выяснение качественного состава анализируемого объекта.
Задачей количественного анализаявляется определение точного содержания отдельных элементов или их соединений в анализируемом объекте.
Различные методы исследования, применяемые в качественном и в количественном анализах, можно разделить на три основные группы методов:
- химические, где используются химические реакции, результат которых определяют визуально;
- физические, основанные на измерении каких-либо физических характеристик вещества, являющихся функцией его химического состава;
- физико-химические, основанные на наблюдении за изменением физических свойств веществ (оптической плотности, электропроводности, теплопроводности и др.), которые происходят в результате химической реакции.
48. Методы количественного анализа – гравиметрический и титриметрический (объемный).
Титрование- это процесс, при котором к анализируемому раствору медленно, по каплям, приливают раствор реагента (р.в.) точно известной концентрации в количестве, эквивалентном содержанию определяемого компонента (о.в.).
Гравиметрический (весовой) анализ - метод количественного химического анализа, основанный на точном измерении массы определяемого вещества или его составных частей, выделяемых в чистом химическом состоянии или в виде соответствующих соединений (точно известного постоянного состава).
Титриметрическим (объемным) методом анализа называют метод количественного химического анализа, основанный на точном измерении объема реагента (р.в.), требующегося для завершения реакции с данным количеством определяемого вещества (о.в.).
Гравиметрический анализ основан на законе сохранения массы веществ при химических превращениях. Это наиболее точный из химических методов анализа. Его метрологические характеристики: предел обнаружения – 0,10 % или 10-3 моль/дм3; точность - 0,2 %.
Титриметрический метод анализа имеет предел обнаружения такой же, как и в гравиметрии - 0,10 % или 10-3 моль/дм3; а вот в точности уступает ей - 0,5 %. Являясь более точным, гравиметрический анализ имеет один существенный недостаток по сравнению с титриметрическим: он требует больших затрат времени на выполнение анализа.
49. Кислотно-основной метод титрования. Расчеты по закону эквивалентов. Методика титрования. Мерная посуда в титриметрическом методе
Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации:
Н+ + ОН- = Н2О
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией. При количественном определении кислот (алкалиметрия) — рабочим раствором является раствор щелочи NaOH или КОН, при количественном определении щелочи (ацидиметрия) рабочим раствором является раствор сильной кислоты (обычно НСl или h3SO4). Определяемые вещества: сильные и слабые кислоты; сильные и слабые основания; соли, подвергающиеся гидролизу.
Виды кислотно-основного титрования:
- титрование сильной кислоты сильным основанием или наоборот;
- титрование слабой кислоты сильным основанием;
- титрование слабого основания сильной кислотой.
Индикаторы кислотно-основного титрования представляют собой слабые органические кислоты и основания, у которых молекулярная и ионная формы отличаются окраской. В процессе диссоциации эти две формы находятся в равновесии. Изменение рН в кислотно-основном титровании нарушает равновесие процесса диссоциации индикатора, что вызывает накопление в растворе одной из форм индикатора, окраску которой можно визуально наблюдать.
Закон эквивалентов формулируется так: эквивалентные количества всех веществ, участвующих в реакции, одинаковы. Для необратимой химической реакции
nАА + nВВ+ …= nСС + nDD + …
в соответствии с законом эквивалентов всегда будет справедливо равенство:
пeqA = пeqB = …=пeqC = пeqD = …
Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки. Титровать, начиная от других отметок, не рекомендуется, так как шкала бюретки может быть неравномерной. Заполнение бюреток рабочим раствором производят через воронку или с помощью специальных приспособлений, если бюретка полуавтоматическая. Конечную точку титрования (точку эквивалентности) определяют индикаторами или физико-химическими методами (по электропроводности, светопропусканию, потенциалу индикаторного электрода и т. д.). По количеству пошедшего на титрование рабочего раствора рассчитывают результаты анализа.
При выполнении титриметрических определений измерение объемов стандартных или анализируемых растворов проводят с помощью точной мерной посуды:
мерные колбы;
пипетки;
бюретки.
50. Титриметрический метод анализа. Классификация методов титриметрического анализа. Индикаторы в титриметрическом методе анализа.
Титриметрический анализ – метод количественного химического анализа, который базируется на измерении точного объема раствора с точно известной концентрацией (титранта), истраченного на взаимодействие с определяемым веществом.
Классификация по способу титрования. Обычно выделяют три способа: прямое, обратное и заместительное титрование.
Прямое титрование –это титрование раствора определяемого вещества А непосредственно раствором титранта В. Его применяют в том случае, если реакция между А и В протекает быстро. Содержание компонента А при прямом титровании титрантом В рассчитывают на основе равенства п [fЭКВ (А)А] =п [fЭКВ (В) В].
Обратное титрованиезаключается в добавлении к определяемому веществу А избытка точно известного количества стандартного раствора В и после завершения реакции между ними, титровании оставшегося количества вещества В раствором титранта В'. Этот способ применяют в тех случаях, когда реакция между А и В протекает недостаточно быстро, либо нет подходящего индикатора для фиксирования точки эквивалентности этой реакции.
Количество молей эквивалента определяемого вещества А при обратном титровании всегда равно разности между количеством молей эквивалента веществ В и В’:
п [fЭКВ (А)А] =п [fЭКВ (В) В] - п [fЭКВ (В’) В’]
Титрование косвенное заключается в титровании титрантом В не определяемого вещества А, а эквивалентного ему количества заместителя А', получающегося в результате предварительно проведенной реакции между определяемым веществом А и каким-либо реагентом.
Титрование заместителя применяют обычно в тех случаях, когда невозможно провести прямое титрование.
Количество молей эквивалента определяемого вещества при титровании заместителя всегда равно количеству молей, эквивалента титранта:
п [fЭКВ (А)А] =п [fЭКВ (A’) A’] = п [fЭКВ (В) В]
Индикаторы — вещества, которые дают возможность установить конечную точку титрования (момент резкого изменения окраски титруемого раствора). Наиболее часто индикатор добавляют ко всему титруемому раствору (внутренний индикатор). При работе с внешними индикаторами периодически берут каплю титруемого раствора и смешивают с каплей раствора индикатора или помещают на индикаторную бумагу (что приводит к по
cyberpedia.su