Как вычислить относительную молекулярную массу вещества. Как найти относительно молекулярную массу
Содержание
Вам понадобится
Инструкция
|
completerepair.ru
Как определить относительную молекулярную массу
Относительная молекулярная масса вещества - это величина, показывающая, во сколько раз масса одной молекулы данного вещества больше 1/12 массы изотопа углерода. По-другому, она может называться просто молекулярной массой. Каким образом можно найти относительную молекулярную массу?Вам понадобится
- Таблица Менделеева.
Инструкция
- Все, что вам понадобится для этого – Таблица Менделеева и элементарная способность производить вычисления. Ведь относительная молекулярная масса – это сумма атомных масс элементов, входящих в состав интересующей вас молекулы. Разумеется, с учетом индексов каждого элемента. Атомная же масса каждого элемента указана в Таблице Менделеева наряду с другой важной информацией, причем с очень высокой точностью. Вам для этих целей вполне подойдут и округленные значения.
- Рассмотрите, например, хорошо знакомое всем соединение – серную кислоту. Это настолько важное вещество, что ее неофициально называют «кровь химии». Какова ее относительная молекулярная масса? Прежде всего, напишите ее формулу: h3SO4.
- Теперь возьмите Таблицу Менделеева и определите атомные массы каждого элемента, входящего в ее состав. Таких элементов три: водород, сера, кислород. Атомная масса водорода (H) =1, атомная масса серы (S) =32, атомная масса кислорода (О) = 16. Учитывая индексы, просуммируйте: 2 + 32 + 64 = 98. Именно такова относительная молекулярная масса серной кислоты. Обратите внимание, что речь идет о приблизительном, округленном результате. Если же по какой-то причине требуется высокая точность, то придется учесть, что атомная масса серы не ровно 32, а 32,06, водорода – не ровно 1, а 1,008 и т.д.
- Таким же образом можно определить молекулярную массу любого вещества, как имеющего относительно простой состав, так и очень сложный. Надо только знать точную формулу вещества. И ни в коем случае не забывать про индексы.
completerepair.ru
Как вычислить относительную молекулярную массу вещества
Относительная молекулярная масса – это безразмерная величина, показывающая во сколько раз масса молекулы больше 1/12 массы атома углерода. Соответственно, масса атома углерода равна 12 единиц. Определить относительную молекулярную массу химического соединения можно, сложив массы атомов, из которых состоит молекула вещества.Вам понадобится
- - ручка;
- - бумага для записей;
- - калькулятор;
- - таблица Менделеева.
Инструкция
- Запишите химическую формулу соединения, относительную молекулярную массу которого требуется вычислить. Например, ортофосфорная кислота h4PO4. Из формулы вы можете увидеть, что молекула кислоты состоит из трех атомов водорода, одного атома фосфора и четырех атомов кислорода.
- Найдите в таблице Менделеева ячейки элементов, из которых состоит данная молекула. Значения относительных атомных масс (Ar) для каждого вещества указаны в левом нижнем углу ячейки. Перепишите их, округлив до целого числа: Ar(H) – 1; Ar( P) – 31; Ar(O) – 16.
- Определите относительную молекулярную массу соединения (Mr). Для этого умножьте атомную массу каждого элемента на количество атомов в молекуле. Затем сложите получившиеся значения. Для ортофосфорной кислоты: Mr(н3ро4) = 3*1 + 1*31 + 4*16 = 98.
- Относительная молекулярная масса численно совпадает с молярной массой вещества. В некоторых задачах используется эта связь. Пример: газ при температуре 200 К и давлении 0,2 MПа имеет плотность 5,3 кг/мз. Определить его относительную молекулярную массу.
- Используйте уравнение Менделеева-Клайперона для идеального газа: PV = mRT/M, где V – объем газа, м3; m – масса данного объела газа, кг; M – молярная масса газа, кг/моль; R – универсальная газовая постоянная. R=8.314472 м2кг с-2 К-1 Моль-1; T – температура газа, К; P - абсолютное давление, Па. Выразите из этой зависимости молярную массу: М = mRT/(PV).
- Как известно, формула плотности: p = m/V, кг/м3. Подставьте ее в выражение: М = рRT/P. Определите молярную массу газа: М = 5,3*8,31*200/(2*10^5) = 0,044 кг/моль. Относительная молекулярная масса газа: Mr = 44. Вы можете предположить, что это углекислый газ: Mr(CO2) = 12 + 16*2 = 44.
completerepair.ru
Как найти относительную молекулярную массу вещества?
#1
Относительная молекулярная масса — это отношение массы молекулы ma химического соединения к 1/12 массы атома углерода С+12: Mr = ma/(1/12mc) = (12ma)/mc. Относительная молекулярная масса является безразмерной величиной.Таблица Д. И. Менделеева поможет определить относительную молекулярную массу, округляя значения атомных масс до двух–трех значащих цифр. Относительную атомную массу обозначают Ar, ее значение указано в таблице элементов Менделеева под химическим знаком элемента.Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов (с учетом индексов). Итак,как вычислить относительную молекулярную массу, например, молекулы воды (h3O): Mr (воды) = 2Ar (H) + Ar (O) ≈ 2·1+16 = 18Относительная молекулярная масса воды равна 18 и это значит, что масса молекулы воды больше в 18 раз, чем 1/12 массы атома C+12.
#2
Смесь это чередующиеся друг с другом в пространстве два или более веществ. При этом свойства компонентов смести остаются неизменными. Как найти массу смеси? Масса смеси равна сумме масс компонентов, из которых состоит смесь. mсм = m1 + m2+….. mi. Плотность смеси ρ(cм) смеси, состоящей из i компонентов и занимающей объем V, определяется по формуле:ρ (см)= m/V =(m1+m2+…+mi)/V = m1/V + m2/V +…+ mi/V = ρ1 + ρ2 +…+ ρiгде m1, m2,………..mi; и ρ1,ρ2,…..ρi — массы и плотности каждого из компонентов смеси.Плотности компонентов смеси определяют по справочникам.Масса смеси m равна ρсмV = (ρ1 + ρ2 +…+ ρi)V
#3
Вещества состоят из молекул, молекула мельчайшая частица данного вещества. А как определить массу молекулы? Массу одной молекулы вещества можно определить делением молярной массы вещества на число молекул в одном моле, то есть на число Авогардо. Следовательно m0 = M/NA. Молярная масса численно совпадает с молекулярной, но отличается по размерности. Ее размерность г/моль.Например, молярная масса воды равна 18 г/моль.Чтобы узнать массу молекулы воды, разделим 18 на число Авогадро NA = 6,022×10^23:18/(6,022×10^23) = 2,99·10^-23.Действуя аналогичным образом легко найти массу молекулы вещества с известной химической формулой.
#4
Вещества могут существовать в нескольких состояниях — твердом, жидком и газообразном. Газы постоянно меняют форму и объем. Как рассчитать массу газа? Уравнение состояния газа связывает термодинамические параметры, характеризующие газ – давление p, объем V и температуру Т:рV = (m/M)RT,где m – масса газа, M – молярная масса, R – универсальная газовая постоянная. Массу газа можно определить, если известны параметры состояния: m = pVM/RT.Универсальная газовая постоянная обозначаемая R, равна 8,314 Дж/(К.моль) или 1,987 кал/(К.моль). Это универсальная постоянная — фундаментальная физическая константа.
#5
Растворы — однородная многокомпонентная система, состоящая из растворителя,растворённых веществ и продуктов их взаимодействия. Как определить массу раствора? Найти массу раствора, можно используя формулу нахождения массы раствора:m (раствора) = m (вещества) + m (расворителя). Растворы встречаются повсюду. Например, раствор углекислого газа (CO2) в воде это всем знакомая газированная вода. Одно из важнейших свойств воды — ее способность растворять различные вещества. Растворы могут быть и газообразные, но именно жидкие смеси в химии называют просто растворами. Вода является наиболее часто применяемым неорганическим растворителем.
uznay-kak.ru
Урок 7. Относительная молекулярная и относительная формульная массы – HIMI4KA
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.

Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды h3O:
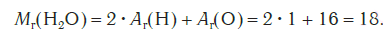
Относительная молекулярная масса серной кислоты h3SO4:

Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(h3O) = 18, это значит, что масса молекулы h3O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы h3SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:

Относительная формульная масса вещества Al2(SO4)3 равна:

Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:

где w («дубль-вэ») — массовая доля элемента А;Ar(А) — относительная атомная масса элемента А;х, у — числа атомов элементов А и В в формуле вещества;Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте h4PO4
Спойлер

[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Как найти молекулярную массу вещества
Наверняка ещё со школы вам известно такое понятие, как молекулярная масса вещества. Собственно, это просто масса молекулы, просто выражается она в относительных единицах - атомных единицах массы (а.е.м.), или же дальтонах, что одно и то же. Такая единица измерения введена для удобства, потому что настоящая масса молекул в килограммах (единица СИ) очень мала и неудобна для расчётов.Вам понадобится
- Для расчётов возьмите ручку, калькулятор и таблицу Менделеева.
Инструкция
- Единицей молекулярной массы является 1/12 массы атома углерода, которая условно принята за 12. Молекулярная масса численно равна суммарной относительной атомной массе всех атомов, входящих в молекулу, и её очень легко рассчитать.
- Согласно закону Авогадро в одинаковых объемах газов при постоянном давлении и температуре будет содержаться одинаковое число молекул. Из него позже было выведено уравнение Менделеева-Клайперона. Сейчас вам потребуется им воспользоваться, но оно справедливо только для газообразных веществ! Подставьте в формулу известное вам давление и температуру, в результате получите молекулярную массу газа:M=(m∙R∙T)/(P∙V),где M – искомая молекулярная масса, m – масса вещества, R – универсальная газовая постоянная (принимать за 8,31 Дж/моль*К), T – температура в Кельвинах, P –давление в Паскалях, V – объём в кубических метрах.Как видно, для этого способа требуется очень много данных, но зато погрешность таких расчетов минимальна.
- Следующий способ намного проще. Если вам известна только масса вещества m и его химическое количество ν, то подставьте эти данные в формулу:M=m/ν,где m – масса вещества (как правило, в граммах), а ν – количество вещества в молях.
- А есть самый простой вариант, если вам известна химическая формула вещества. Возьмите таблицу Менделеева, посмотрите молекулярную массу каждого элемента, входящего в состав. Например, у водорода она равна 1, у кислорода – 16. А чтобы найти молекулярную массу всего вещества (возьмём для примера воду, которая состоит из двух молекул водорода и одной молекулы кислорода) просто сложите массы всех входящих в него элементов. Для воды: M(h3O) = 2M(H)+M(O) = 2•1+16 = 18 а. е. м.
completerepair.ru
Как определить молекулярную массу
Определения молекулярной массы вещества – это довольно специфическое, но важное умение, которое требуется для качественного изучения курса химии или физики. Данная тема относится к одному из базовых школьных разделов, на которых строится умения решать расчетные задачи, причем как на контрольной или на самостоятельной работе, так и во время практических занятий. И даже если уже не придется заниматься собственным образованием, то полученные знания могут пригодиться для ответов на вопросы своих пытливых детей.Вам понадобится
- Таблица Д.И. Менделеева, ручка, калькулятор
Инструкция
- Если внимательно рассмотреть таблицу химических элементов Дмитрия Ивановича Менделеева, то можно увидеть, что она имеет вид многоквартирного многоэтажного дома, в котором находятся «жильцы» – химические элементы. Каждый из них имеет фамилию (название) и химический символ. Причем каждый из элементов живет в своей собственной квартире, а потому имеет порядковый номер. Эта информация представлена во всех клеточках таблицы.
- Однако там стоит еще одна цифра, на первый взгляд совсем непонятная. Мало того, она указана с несколькими значениями после запятой, что делается для большей точности. Именно на это число и нужно обратить внимание, потому что это и есть относительная атомная масса. Причем эта характеристика – величина постоянная, которую не требуется запоминать и можно найти по таблице. Кстати даже на ЕГЭ по химии таблица Д.И. Менделеева является справочным материалом, доступным для использования, и у каждого лежит в индивидуальном пакете – КИМе.
- Молекулярная масса, а точнее относительная молекулярная масса вещества обозначается буквами (Mr) складывается из относительных атомных масс (Ar), образующих молекулу, элементов. Относительная атомная масса – это как раз та, загадочная цифра, которая стоит в каждой клеточке таблицы. Для расчетов необходимо эти значения округлять до целого числа. Исключением является только атом хлора, у которого относительная атомная масса составляет 35,5. Единиц измерения эта характеристика не имеет.
- Пример 1. Найдите молекулярную массу гидроксида калия (KOH)Молекула гидроксида калия состоит из одного атома калия (К), одного атома кислорода (О) и одного атома водорода (Н). Следовательно, находим:Mr (KOH) = Ar (К) + Ar (О) + Ar (Н)По таблице Д.И. Менделеева находим значения относительных атомных масс элементов:Ar (К) = 39, Ar (О) = 16, Ar (Н) = 1Отсюда: Mr (KOH) = 39 + 16 + 1 = 56
- Пример 2. Найдите молекулярную массу серной кислоты (h3SO4 аш-два-эс-о-четыре)Молекула серной кислоты состоит из двух атомов водорода (Н), одного атома серы (S) и четырех атомов кислорода (О). Следовательно, находим:Mr (h3SO4) = 2Ar (H) + Ar (S) + 4Ar (O)По таблице Д.И. Менделеева находим значения относительных атомных масс элементов:Ar (К) = 39, Ar (О) = 16, Ar (Н) = 1Отсюда: Mr (h3SO4) = 2 х 2 + 32 + 4 х 16 = 98
completerepair.ru












