Как определить число ионов. Как определить ионы
Содержание
Вам понадобится
Инструкция
|
completerepair.ru
Как определить заряд иона | Сделай все сам
В силу определенных причин атомы и молекулы могут либо приобретать, либо терять свои электроны. В этом случае образуется ион. Таким образом, ион — это одноатомная либо многоатомная заряженная частица. Видимо, важнейшей колляцией иона будет его заряд .

Вам понадобится
- Таблица химических элементов Д.И. Менделеева
Инструкция
1. Атом всякого вещества состоит из электронной оболочки и ядра. Ядро состоит из 2-х типов частиц — нейтронов и протонов. Нейтроны не имеют электрического заряд а, то есть электрический заряд нейтронов равен нулю. Протоны являются позитивно заряженными частицами и имеют электрический заряд , равный +1. Число протонов характеризует ядерный номер данного атома.
2. Электронная оболочка атома состоит из электронных орбиталей, на которых расположено различное число электронов. Электрон — негативно заряженная элементарная частица. Ее электрический заряд равен -1.При помощи связей атомы могут также соединяться в молекулы.
3. В нейтральном атоме число протонов равно числу электронов. Следственно его заряд равен нулю.Дабы определить заряд иона , нужно знать его конструкцию, а именно число протонов в ядре и число электронов на электронных орбиталях.
4. Суммарный заряд иона получается в итоге алгебраического суммирования заряд ов входящих в него протонов и электронов. Число электронов в ионе может превышать число протонов, и тогда ион будет негативным. Если число электронов поменьше числа протонов, то ион будет правильным.
5. Зная химический элемент, по таблице Менделеева мы можем определить его ядерный номер, тот, что равен числу протонов в ядре атома этого элемента (скажем 11 у натрия). Если один из электронов оставил атом натрия, то у атома натрия будет теснее не 11, а 10 электронов. Атом натрия станет одобрительно заряженным ионом с заряд ом Z = 11+(-10) = +1.Обозначаться такой ион будет символом Na с плюсом сверху, в случае заряд а +2 — двумя плюсами и.т.д. Соответственно для негативного иона применяется знак «минус».
Атом химического элемента состоит из ядра и электронной оболочки. Ядро — это центральная часть атома, в котором сфокусирована примерно каждая его масса. В различие от электронной оболочки, ядро имеет позитивный заряд .

Вам понадобится
- Атомный номер химического элемента, закон Мозли
Инструкция
1. Ядро атома состоит из 2-х типов частиц — протонов и нейтронов. Нейтроны являются электронейтральными частицами, то есть их электрический заряд равен нуля. Протоны являются одобрительно заряженными частицами и их электрический заряд равен +1.
2. Таким образом, заряд ядра равен числу протонов. В свою очередь, число протонов в ядре равно ядерному номеру химического элемента. К примеру, ядерный номер водорода — 1, то есть ядро водорода состоит из одного протона имеет заряд +1. Ядерный номер натрия — 11, заряд его ядра равен +11.
3. При альфа-распаде ядра его его ядерный номер уменьшается на два за счет испускания альфа-частицы (ядра атома гелия). Таким образом, число протонов в ядре, испытавшем альфа-распад, также уменьшается на два.Бета-распад может протекать в 3 разных видах. В случае распада «бета-минус» нейтрон превращается в протон при испускании электрона и антинейтрино. Тогда заряд ядра возрастает на единицу.В случае распада «бета-плюс» протон превращается в нейтрон, позитрон и нйтрино, заряд ядра уменьшается на единицу.В случае электронного захвата заряд ядра также уменьшается на единицу.
4. Заряд ядра дозволено также определить по частоте спектральных линий характеристического излучения атома. Согласно закону Мозли: sqrt(v/R) = (Z-S)/n, где v — спектральная частота характеристического излучения, R — непрерывная Ридберга, S — непрерывная экранирования, n — основное квантовое число.Таким образом, Z = n*sqrt(v/r)+s.
Видео по теме
Впереди лабораторная работа, а необходимые навыки и знания по распознаванию химических веществ не наработаны. А может в химической лаборатории нечаянно отклеились этикетки с наименованиями соединений. Знание верно определять химические вещества в силу своей специфичности может теснее не понадобиться позже окончания учебных заведений. Но но эти познания могут потребоваться собственному ребенку, тот, что придет за подмогой. Что тогда ему ответить?

Вам понадобится
- Штатив с пробирками, реагенты для определения веществ, спиртовка, проволочка с петелькой, индикаторы
Инструкция
1. Химические вещества состоят из одобрительно и негативно заряженных ионов, образуя в совокупности электронейтральное соединение. Дабы определить состав вещества нужно руководствоваться добротными реакциями на разные ионы . И не неукоснительно их учить назубок, а довольно знать, что существуют такие реагенты, с подмогой которых дозволено определить фактически всякое химическое соединение.
2. Кислоты. Все кислоты объединяет то, что в их состав входит ион водорода. Именно его наличие обусловливает кислые свойства. Добротной реакцией на эту группу веществ дозволено считать индикаторы, то есть в кислой среде лакмус становится красным, а метиловый оранжевый — розовым.
3. Основания. Вещества этой группы также дозволено определить с подмогой индикатора. Характерную реакцию дает фенолфталеин, тот, что в щелочной среде становится малиновым. Это происходит за счет присутствия гидроксид-ионов.
4. Металлы. Дабы определить ионы металлов, для этого надобно воспользоваться спиртовкой либо горелкой. Возьмите медную проволочку, на одном конце сделайте петельку 6-10 мм в диаметре и внесите в пламя. Фактически сразу увидите, что оно купило окраску прекрасного зеленого цвета. Это происходит как раз за счет ионов меди. Тот же самый итог будет отслеживаться, если проволочку вначале обмакнуть в соли меди (хлорид меди, нитрат меди, сульфат меди), а потом внести в пламя.
5. Дабы определить присутствие ионов щелочных металлов (натрия и калия) и щелочно-земельных (кальция и бария) необходимо также внести соответствующие растворы солей в пламя спиртовки. Ионы натрия окрасят пламя в ясно-желтый цвет, ионы кальция – в кирпично-алый. Ионы бария, входящие в состав веществ дадут желто-зеленое окрашивание, а ионы калия – фиолетовое.
6. Для определения ионов кислотных остатков существует целый ряд добротных реакций. Сульфат-ион дозволено определить, предпочтя в качестве реагента ион хлора, что в итоге даст белый осадок. Дабы узнать, что в пробирке находится карбонат-ион, возьмите всякую разбавленную кислоту и в результате увидите вскипание. Добавочно пропустите образовавшийся углекислый газ через известковую воду, отслеживая при этом помутнение.
7. Дабы определить ортофосфат-ион, довольно прилить в пробирку с ним нитрат серебра, в итоге реакции будет отслеживаться выпадение желтого осадка. Для распознавания солей аммония необходимо провести реакцию с растворимыми щелочами. Визуального слежения не будет, но но появится малоприятный запах мочевины за счет образовавшегося аммиака.
8. Для распознавания галоген-ионов (хлора, брома, йода) реагентом для всех 3 является нитрат серебра и во всех случаях произойдет выпадение осадка. В итоге ион хлора с нитратом серебра даст белый осадок (хлорида серебра), ион брома – бело-желтый осадок (бромида серебра), а ион йода – осадок желтого цвета (образуется йодид серебра).
Видео по теме
Обратите внимание! При выполнении даже самых примитивных навыков непременно соблюдайте правила техники безопасности
Полезный совет Имеется довольно много реакций, в которых реагентом выступает нитрат серебра. Если это вещество попадет на поверхность стола либо одежду, то удалить пятнышка не удастся.
В обыкновенных условиях атом электрически нейтрален. При этом ядро атома, состоящее из протонов и нейтронов, заряжено одобрительно, а электроны несут негативный заряд. При избытке либо недостатке электронов атом превращается в ион.

Инструкция
1. Всякий химический элемент имеет свой неповторимый заряд ядра. Именно заряд определяет номер элемента в периодической системе. Так, ядро водорода имеет заряд +1, гелия +2, лития +3, бериллия +4 и т.д. Таким образом, если вестим элемент, заряд ядра его атома дозволено определить из таблицы Менделеева.
2. От того что при обыкновенных условиях атом электрически нейтрален, число электронов соответствует заряду ядра атома. Негативный заряд электронов компенсируется позитивным зарядом ядра. Электростатические силы удерживают электронные облака возле атома, что обеспечивает его стабильность.
3. При воздействии определенных условий у атома дозволено отнимать электроны либо присоединять к нему добавочные. Если отнять электрон от атома, атом превращается в катион – одобрительно заряженный ион. При избыточном числе электронов атом становится анионом – негативно заряженным ионом.
4. Химические соединения могут иметь молекулярную либо ионную природу. Молекулы также электрически нейтральны, а ионы несут в себе определенный заряд. Так, молекула аммиака Nh4 нейтральна, а вот ион аммония Nh5+ заряжен одобрительно. Связи между атомами в молекуле аммиака ковалентные, образованные по обменному типу. Четвертый атом водорода присоединяется по донорно-акцепторному механизму, это тоже ковалентная связь. Аммоний образуется при взаимодействии аммиака с растворами кислот.
5. Главно понимать, что заряд ядра элемента не зависит от химических перевоплощений. Сколько электронов ни добавляй и ни отнимай, заряд ядра останется тем же. К примеру, атом O, анион O- и катион O+ характеризуются одним и тем же зарядом ядра +8. При этом атом имеет 8 электронов, анион 9, катион — 7. Само ядро дозволено изменить только путем ядерных перевоплощений.
6. Особенно частый вид ядерных реакций – радиоактивный распад, тот, что может происходить в натуральной среде. Ядерная масса элементов, подвергающихся в природе такому распаду, заключена в квадратные скобки. Это обозначает, что массовое число непостоянно, меняется на протяжении времени.
Электрический заряд – это величина, характеризующая способность физического тела быть источником электромагнитного поля и принимать участие во взаимодействии с другими сходственными источниками. Еще древние греки нашли, что если кусок янтаря потереть о шерсть, то он приобретет способность притягивать легкие предметы. Янтарь на древнегреческом языке именовался «электрон».

Инструкция
1. Школьникам, постигавшим физику в старших классах, наверно знаком примитивный прибор – электрометр. Он состоит из металлического стержня с круглым горизонтально расположенным выступом. На данный выступ насажена стрелка, которая может вольно вращаться. Что произойдет, если к металлическому стержню электрометра прикоснется заряженное тело? Часть заряда как бы перетечет на стержень и стрелку. Но от того что эти заряды одноименные, то они будут отталкивать друг друга. И стрелка отклонится от изначального расположения на определенный угол. С подмогой градуированной шкалы его замеряют и рассчитывают величину заряда. Легко дозволено осознать, что чем огромнее заряд, тем огромнее будет угол отклонения стрелки электрометра, и напротив. Разумеется, с поддержкой такого примитивного прибора дозволено произвести лишь примерное определение величины заряда. Если надобна высокая точность, используются эмоциональные электронные электрометры.
2. Можете воспользоваться законом Кулона: F = kq1q2/r^2, где F – сила взаимодействия между двумя заряженными телами, q1 и q2 – величины их зарядов, r – расстояние между центрами этих тел, а k – показатель пропорциональности. Иными словами, если у вас есть тело, заряд которого q1 вам знаменит, то, поднеся второе тело, заряд которого q2 нужно определить на расстояние r и силу взаимодействия F с поддержкой эмоционального прибора-динамометра, вы легко вычислите желанный заряд q2 по формуле: q2 = Fr^2/(kq1).
3. Также допустимо вычистить величину заряда, измерив силу тока в цепи. Дело в том, что суммарная величина заряда, протекшего через поперечное сечение какого-нибудь проводника, вычисляется по формуле: Q = IT, где I – сила тока в амперах, а Т – время в секундах. Для этого навыка вам потребуется секундомер и амперметр – прибор для определения силы тока. Соберите электрическую цепь, куда включен амперметр, включите ток, запишите показание амперметра. Разомкните цепь, единовременно отключив секундомер. Запишите, сколько времени ток был в цепи. И по вышеуказанной формуле подсчитайте суммарный электрический заряд.
Видео по теме
Полезный совет Представление о позитивном и негативном заряде ввел Б. Франклин в середине 18-го столетия. А сам термин «электрический заряд» был впервой использован Шарлем Кулоном в 1785-м году, тот, что как бы объединил слова «электрон» и «заряд». В честь этого ученого названа основная единица электрического заряда – 1 кулон.
jprosto.ru
Как определить число ионов
Ион – это электрически заряженная частица. Она образуется, когда атом или молекула притягивает к себе дополнительные электроны или же отдает свои. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами. Частицы образуются в растворах в ходе процесса, который называется электролитической диссоциацией. Но это может происходить и при воздействии высокой температуры, электрического тока и т.д. При диссоциации даже крохотного количества вещества образуется определенное число ионов.Инструкция
- Поставлена следующая задача: имеется 40 г поваренной соли. Ее растворили в воде. Сколько ионов при этом образовалось, если допустить, что все атомы поваренной соли подверглись диссоциации?
- Напишите формулу этого вещества: NaCl. Посчитайте его молекулярную массу, сложив атомные веса натрия и хлора: 23 + 35,5 = 58,5 а.е.м. (атомных единиц массы). Поскольку молярная масса любого вещества численно равна его молекулярной массе, только выражается в другой размерности (г/моль), то 1 моль поваренной соли (хлористого натрия) будет весить приблизительно 58,5 г.
- Вычислить, сколько молей хлористого натрия содержится в 40 г. Произведите деление: 40/58,5 = 0,6838 , или 0,68 моля.
- Воспользуйтесь универсальным числом Авогадро, которое равно 6,022*10^23. Это количество элементарных частиц – молекул, атомов или ионов, содержащихся в одном моле любого вещества. В вашем случае до диссоциации хлористый натрий состоял из молекул. Следовательно, в 1 моле этого вещества содержится примерно 6,022*10^23 его молекул. Но у вас 0,68 моля. Произведите умножение: 0,68*6,022*10^23 = 4,095*10^23. Вот столько молекул содержится в 40 г хлористого натрия.
- При диссоциации каждая молекула поваренной соли образует два иона: положительно заряженный ион натрия и отрицательно заряженный ион хлора. Поэтому, умножьте полученный результат на 2: 2*4,095*10^23 = 8,19*10^23. Вот столько ионов образовалось при диссоциации 40 г поваренной соли. Задача решена.
completerepair.ru
Как определить заряд иона
В силу определенных причин атомы и молекулы могут либо приобретать, либо терять свои электроны. В этом случае образуется ион. Таким образом, ион - это одноатомная или многоатомная заряженная частица. Очевидно, важнейшей характеристикой иона будет его заряд.Вам понадобится
- Таблица химических элементов Д.И. Менделеева
Инструкция
- Атом любого вещества состоит из электронной оболочки и ядра. Ядро состоит из двух типов частиц - нейтронов и протонов. Нейтроны не имеют электрического заряда, то есть электрический заряд нейтронов равен нулю. Протоны являются положительно заряженными частицами и имеют электрический заряд, равный +1. Количество протонов характеризует атомный номер данного атома.
- Электронная оболочка атома состоит из электронных орбиталей, на которых расположено разное количество электронов. Электрон - отрицательно заряженная элементарная частица. Ее электрический заряд равен -1.При помощи связей атомы могут также соединяться в молекулы.
- В нейтральном атоме количество протонов равно количеству электронов. Поэтому его заряд равен нулю.Чтобы определить заряд иона, необходимо знать его структуру, а именно количество протонов в ядре и количество электронов на электронных орбиталях.
- Суммарный заряд иона получается в результате алгебраического суммирования зарядов входящих в него протонов и электронов. Число электронов в ионе может превышать число протонов, и тогда ион будет отрицательным. Если число электронов меньше числа протонов, то ион будет положительным.
- Зная химический элемент, по таблице Менделеева мы можем определить его атомный номер, который равен количеству протонов в ядре атома этого элемента (например 11 у натрия). Если один из электронов покинул атом натрия, то у атома натрия будет уже не 11, а 10 электронов. Атом натрия станет положительно заряженным ионом с зарядом Z = 11+(-10) = +1.Обозначаться такой ион будет символом Na с плюсом сверху, в случае заряда +2 - двумя плюсами и.т.д. Соответственно для отрицательного иона используется знак «минус».
completerepair.ru
Урок 6. Простые ионы – HIMI4KA
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
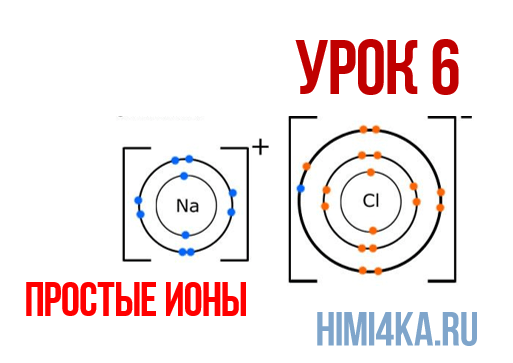
Ионная химическая связь
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e—), образуя положительный ион натрия Na+, а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl—. Это записывается в виде двух реакций:
- Na → Na+ + e— и ½Cl2 + e— → Cl—
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl— окружен со всех сторон соседними положительными ионами натрия Na+; ионы натрия Na+ точно также окружены ближайшими хлорид-ионами Cl—. Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Заряд простого, одноатомного иона, например Mg2+ или F2-, называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg2+ + 2e— → Mg
- Реакция окисления: F2- → F + 2e—
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl—, имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl3+, имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| h3O | H(I), O(II) | H+1, O-2 |
| CS2 | C(IV), S(II) | C+4, S-2 |
| Ch5 | C(IV), H(I) | C-4, H+1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe2+ железо(II) или ион двухвалентного железа
- Fe3+ железо(III) или ион трехвалентного железа
- Сu+ медь(I) или ион одновалентной меди
- Cu2+ медь (II) или ион двухвалентной меди
- Sn2+ олово(II) или двухвалентного олова
- Sn4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe3+ + e— → Fe2+. Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Содержание
Инструкция
|
completerepair.ru
Как определить заряд комплексного иона
Первым делом напишите точную формулу комплексного соединения. Вот, например, желтая кровяная соль – гексацианоферрат калия. Ее формула: К4[Fe(CN)6].2Определите состав комплексного иона. В данном случае это ион [Fe(CN)6], величину и знак заряда которого вам надо определить. А четыре иона калия составляют внешнюю сферу этого соединения.3Теперь вам поможет одно из основных правил химии, гласящее: любая молекула электрически нейтральна. То есть в данном конкретном случае суммарный заряд молекулы гексацианоферрата калия также равен нулю. А это может быть только тогда, когда заряд комплексного иона [Fe(CN)6] уравновешен суммарным зарядом четырех ионов калия, находящихся во внешней сфере. То есть заряд комплексного иона такой же по размерности, но с противоположным знаком.4Посмотрите в таблицу Менделеева. Калий – один из самых активных металлов, он уступает только своим собратьям по первой главной группе таблицы – рубидию, цезию и францию. Следовательно, по сравнению с другими элементами, входящими в состав этого соединения, – железом (Fe), углеродом (С) и азотом (N), калий, безусловно, самый электроположительный. То есть он будет не притягивать к себе общую электронную плотность молекулы, а отталкивать ее от себя. Это вполне объяснимо, ведь у калия на внешнем электронном уровне всего один электрон, и ему гораздо легче отдать его (чтобы предыдущий уровень, на котором восемь электронов, стал устойчивым), нежели притянуть еще целых семь.5Таким образом, каждый атом калия, образуя химическую связь в этой молекуле, отдал по одному электрону и превратится, соответственно, в ион с положительным зарядом +1. Таких ионов четыре, следовательно, суммарный заряд внешней сферы равен +4. А чтобы молекула была нейтральной, его должен уравновесить заряд -4. Вот и ответ на поставленный вопрос.
Оцени ответ
shkolniku.com













