Повторим основные классы неорганических соединений. Как определить класс соединения в химии
Основные классы неорганических соединений :: SYL.ru
К неорганическим соединениям относят все сочетания химических элементов, которые не содержат углерод. Большинство известных соединений являются органическими, однако известно около 20 миллионов тех, которые принадлежат к классу неорганических. Огромное количество вызывает необходимость их классификации, то есть деления на группы.
Каждое из этих веществ обладает своими характеристиками, и поэтому можно выделить основные классы неорганических соединений. Для любого из них характерны различные способности взаимодействия с другими веществами, свои свойства. Химия, классы неорганических соединений в которой занимают важное место, рассматривает их классификацию с нескольких точек зрения.
Классификация неорганических веществ
Можно выделить несколько категорий, по которым подразделяются классы неорганических соединений. В соответствии со своим строением они могут быть простого и сложного состава. Простые вещества состоят из атомов одного вида. Они могут быть металлами и неметаллами. В некоторых источниках можно встретить информацию, что к простым веществам относят также благородные газы и амфотерные простые вещества.
Характеристика металлов
Атомы металлических соединений связаны между собой при помощи особой металлической связи, образуя кристаллическую сеть. Ионы металлов связываются между собой, образуя электронное облако.
Кристаллическая сеть создается всеми металлами, и этим обусловлены общие свойства большинства этих простых неорганических веществ. Например, такими свойствами являются высокая теплопроводность, пластичность, прочность, непрозрачность, высокая электропроводность.
Неметаллы
Неорганические соединения неметаллической природы отличаются большим многообразием. В этой группе можно встретить вещества в твердом, жидком и газообразном состоянии. Примером твердого неметалла может служить сера, фосфор и т. д.; газообразного – водород, хлор; жидкого – бром.
Газообразные неметаллы обычно существуют в природе в виде двухатомных молекул, кроме благородных газов, которые существуют в виде одноатомных. Жидкие неметаллы также часто имеют молекулярное строение. Твердые вещества чаще всего образуют кристаллическую сеть, то есть обладают немолекулярным строением.
Сложные неорганические вещества
Чаще всего можно встретить классификацию сложных веществ по строению. Поэтому важнейшие классы неорганических соединений выглядят следующим образом:
1. Оксиды.
2. Гидроксиды:
- кислоты;
- основания;
- амфотерные гидроксиды.
3. Соли.
Некоторые источники выделяют кислоты, основания и амфотерные гидроксиды как самостоятельные пункты классификации, однако в связи с тем, что и первые, и вторые, и третьи являются результатом взаимодействия оксидов с водой, все эти категории относят к гидроксидам.
Оксиды
Оксиды являются веществами, которые имеют в своем составе 2 элемента (или более), причем один из них - это обязательно кислород. Общая формула оксидов имеет вид ЭхОу.
В зависимости от того, как взаимодействуют оксиды с другими веществами, их подразделяют на 3 категории: амфотерные, кислотные и основные.
Свойства классов неорганических соединений имеют значение при определении возможных реакций с их участием. Так, амфотерными являются те оксиды, которые при вступлении в реакцию с кислотами и основаниями образуют соли и воду. При вступлении в реакцию с водой данные соединения могут обладать кислотными и основными свойствами, то есть образовывать как кислоты, так и основания. К амфотерным относят соединения алюминия, хрома III, бериллия, железа III, цинка. Кислотные оксиды вступают в реакцию с водой и образуют кислоту, а при взаимодействии с основаниями - соли. Основные оксиды в реакции с водой образуют основания, а с основаниями – тоже соли.
В соответствии с другой классификацией, оксиды также делят по способности образовывать соли на солеобразующие и несолеобразующие. Несолетворные оксиды образуют кислоты, и для них невозможны реакции с образованием солей.
Гидроксиды
Эти соединения получают путем присоединения воды к оксидам либо косвенно в процессе ряда реакций. Те гидроксиды, что образованы основными оксидами, называют основаниями, а те, что образуются из амфотерных оксидов, – амфотерными гидроксидами.
Кислоты
Эти сложные вещества входят в основные классы неорганических соединений, состоят из водорода и кислотного остатка. Наименование последнего позволяет дать название той или иной кислоте.
Кислоты как классы неорганических соединений могут быть одно-, двух- и трехосновными, что зависит от количества атомов водорода в их составе. Примером одноосновной кислоты служит соляная кислота (HCl), двухосновной – серная (h3SO4), а трехосновной – фосфорная (h4PO4).
Кислотные остатки также имеют свою классификацию, могут быть кислородсодержащими и бескислородными.
Атомы металлов способны замещать водород в кислотах, в таком случае получаются соли.
Понятие о солях
В основные классы неорганических соединений входят также соли. Это продукт замещения атомами металла водорода в кислотах или гидроксильных групп оснований на кислотные остатки. Соли образуются тогда, когда различные классы неорганических соединений взаимодействуют между собой.
В зависимости от степени замещения атомов различают средние, кислые и основные соли. Если происходит полное замещение атомов, то образовавшаяся соль средняя, если частичное, то, соответственно, кислая или основная. В том случае, когда состава реагентов достаточно для полного замещения, образуется средняя соль.
Когда при взаимодействии не хватает кислоты для получения средней соли, говорят о получении основной соли.
При вступлении в реакцию металлов с неметаллами образуется бескислородная соль, а когда в реакцию вступает кислотный и основный оксид, получают кислородсодержащую соль.
Понятие о связи между классами неорганических соединений
Выше мы упоминали о том, что некоторые вещества получают только косвенным путем, посредством нескольких реакций. Существует связь между классами неорганических соединений, о которой можно говорить в связи с тем, что различные сложные элементы вступают в реакции между собой, образуя новые вещества. Например, соль образуется при взаимодействии кислот с основаниями. Это так называемая генетическая связь классов неорганических соединений, суть которой в том, что взаимодействие происходит между разными классами неорганических веществ. Так, в реакции вступают основные и кислотные оксиды, основания и кислоты, металлы и неметаллы и т. д. Основные классы неорганических соединений, взаимодействуя, обеспечивают химические свойства этих групп веществ.
Вот некоторые из примеров, подтверждающих генетическую связь между разными классами соединений:
- Металлы при взаимодействии с неметаллами образуют соли.
- Металлы при взаимодействии с кислородом образуют оксиды.
- Неметаллы, соответственно, образуют в реакции с кислородом оксиды неметаллов.
- Основные и амфотерные оксиды, вступая в реакцию с кислотами или кислотными оксидами, образуют соли.
- Кислотные оксиды образуют соли при реакции с основаниями или основными оксидами.
- Кислотные оксиды вступают в реакцию с водой и образуют кислоты.
- Основания, вступая в реакцию с амфотерными гидроксидами, образуют соли.
Таким образом, деление на классы неорганических соединений позволяет сгруппировать их огромное количество и определить принципы их взаимодействия между собой и другими веществами. Кроме того, подобная группировка способствует более легкому усвоению и запоминанию свойств различных неорганических соединений.
www.syl.ru
В мир химии - Классы веществ
Восьмиклассникам. Классы веществ
Во второй четверти с вами будем учиться составлять формулы сложных веществ. Для начала надо понять, как формула вещества связана с классом, к которому это вещество относится. Пока мы знакомимся с четырьмя классами: оксиды, основания, кислоты и соли.
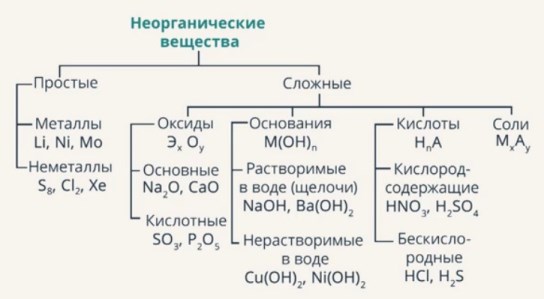 Схема классификации взята из видеоролика с сайта "Интернет-урок". Там же вы можете услышать подробные пояснения к классификации веществ.
Схема классификации взята из видеоролика с сайта "Интернет-урок". Там же вы можете услышать подробные пояснения к классификации веществ. Если кратко:
Оксиды - состоят из двух химических элементов, один из которых кислород (О).
Основания - состоят из металла и гидроксогруппы (ОН).
Кислоты - состоят из водорода (Н) и кислотного остатка.
Соли - содержат металл и кислотный остаток.
Задание 1. Найдите способ распределить эти формулы на четыре группы
Этот тренажер поможет вам закрепить умение классифицировать неорганические вещества по их формулам.
Задание 2. Учимся классифицировать вещества
Игра "Классификация веществ"
Еще одна игра на классификацию веществ. Смелее! Чтобы развернуть на весь экран, кликните на значок в правом верхнем уголке.
Игра "Классификация веществ"
Задание 3. Запоминаем формулы кислот
Следующая игра-тренажер поможет вам выучить формулы кислот, совмещая приятное с полезным. Выбирайте форму игры (можно стрелять по мишеням или из пушки, искать парные карточки - всего 5 видов игр) и тренируйтесь! Удачи!
Игра "Формулы кислот"
Задание 4. Повторяем названия кислотных остатков
Сможете вспомнить названия известных вам кислотных остатков? Найдите их все! Справитесь?
Игра "Названия кислотных остатков"
Задание 5. Учимся составлять формулы солей
Чтобы развернуть видео на весь экран, надо кликнуть на значок в правом нижнем углу видео.
vmirhimii.ucoz.ru
Химические соединения - это... Характеристика, примеры и свойства
Большинство людей не задумывается о составе окружающих их предметов, веществ, материи. Атомы, молекулы, электроны, протоны - эти понятия кажутся не только непонятными, но и далекими от действительности. Однако такое мнение ошибочно. Практически все, что нас окружает, состоит из химических связей. Химические соединения - это достаточно сложные формы веществ. В окружающем нас мире великое множество таких связей. Однако и соединения, состоящие только из одного элемента химического, могут относиться к ним, например, кислород или хлор. Поэтому стоит подробнее разобрать вопрос: "Химические соединения - это что?"

Сложный "химический" мир
Мало кто задумывается о том, что окружающий нас мир состоит из сложных структур, макромолекул и крошечных частиц. Удивительно, насколько разнородны даже размеры атомов у разных элементов. Различия в величинах атомных масс тоже впечатляют - бериллий со своими 9 а. е. м. - "легковес" по сравнению с "тяжеловесом" астатом: его атомный вес составляет 210 а. е. м. (а. е. м. - атомные единицы массы - единица измерения массы атомов, молекул, ядер, которая равна 1/12 массы атома углерода, находящегося в основном состоянии).
Многообразие элементов обуславливает и наличие множества химических соединений (это, простыми словами, комбинация соединенных между собой атомов различных и, в некоторых случаях, одинаковых частей). Большинство предметов, веществ представляют собой именно такого рода соединения. Необходимый для жизни кислород, поваренная соль, ацетон... Можно еще очень долго перечислять примеры и всем известные, и понятные только узким специалистам. Что же такое эти химические соединения?

Определение, отличие от смесей
Химические соединения - это сложные вещества, которые состоят из соединенных между собой атомов разных химических элементов, однако существуют исключения: к химическим соединениям относятся и простые вещества (то есть состоят из атомов одного элемента), если атомы этих веществ соединены ковалентной связью (она образована общими для обоих атомов электронами). К таким веществам относятся азот, кислород, большинство галогенов (в таблице Менделеева элементы седьмой группы главной подгруппы; фтор, хлор, бром, йод, предположительно и астат).
Зачастую путают между собой понятия "химическое соединение" и "смесь простых веществ". Смесь веществ - это, как можно сделать вывод из названия, не самостоятельное вещество, а система двух и более компонентов. Сам состав этих двух единиц химических веществ является основным различием между ними. Как уже говорилось, соединение химических элементов и смесь простых (или сложных) веществ - это не одно и то же. Свойства, способы получения, методы разделения на компоненты также являются отличительными критериями смесей и соединений. Важно отметить, что ни получить, ни разделить химические соединения нельзя без проведения химических реакций, а смеси - можно.

Очень многие люди также путают между собой словосочетания "соединение химических веществ" и "соединение элементов". По непонятным причинам, но, скорее всего, в силу своей некомпетентности, большинство из них не видит разницы между первым и вторым научными понятиями. Стоит узнать и понимать, что не существует такой терминологии, как "соединение химических веществ". Не стоит повторять за другими ошибки этимологии тех или иных не только выражений, но и слов.
Как определить свойства соединений
Зачастую свойства химических соединений разительно отличаются от свойств элементов, из которых они состоят. Например, молекула этилового спирта состоит из двух атомов углерода, шести атомов водорода и одного атома кислорода, однако его свойства разительно отличаются от свойств всех элементов своего состава. В связи с тем, что существуют разные классы соединений, то и свойства у каждого из них свои. Большинство реакций, безусловно, являются характерными для многих соединений, однако механизмы их проявления разные.

На какие классы делятся химические соединения
В зависимости от своей природы, существуют такие классы химических соединений, как органические и неорганические. Стоит сказать, что органическими называют вещества (соединения), в составе которых присутствует углерод (исключения составляют некоторые соединения, содержащие углерод, но относящиеся к неорганическим, ниже они приводятся). Основными группами органических соединений являются углеводороды, спирты, альдегиды, кетоны, эфиры, карбоновые кислоты, амиды и амины. Неорганические вещества (соединения) в своем составе не содержат атомов углерода, однако среди них можно выделить карбиды, цианиды, карбонаты и оксиды углерода, так как они, наравне с органическими соединениями, в своем составе содержат его атомы. И те, и другие соединения имеют свои особенности, свои свойства, причем разные группы соединений одного класса могут иметь разные характеристики.
Неорганические соединения: основные свойства
Все неорганические соединения можно разбить на несколько групп. У каждого из данных видов соединений есть общие свойства, зачастую не совпадающие с другими группами этого же класса. Итак, ответ на вопросы, какие химические соединения относятся к неорганическими, какие группы образуют и какими свойствами обладают, можно представить следующим образом:
- Первая группа - простые неорганические соединения неметаллической природы. Данную категорию соединений объединяют такие свойства, как возможность находиться в газообразном состоянии. Твердые соединения неметаллического характера обладают немолекулярным строением, в связи с чем способны к образованию кристаллов.
- Вторая группа - сложные неорганические соединения. Их можно разделить на четыре подгруппы.

Сложные неорганические соединения, их свойства
Как было сказано ранее, вторую группу неорганических соединений можно разделить на четыре подгруппы:
- Оксиды. Для этой подгруппы неорганических соединений характерны реакции взаимодействия с водой, кислотами и кислотными оксидами (у них есть соответствующая кислородсодержащая кислота).
- Кислоты. Эти соединения взаимодействуют с водой, щелочами и основными оксидами (у них есть соответствующее основание).
- Амфотерные соединения - соединения, которые могут вести себя и как кислоты, и как основания (обладают и теми, и теми свойствами). Такие соединения реагируют и с кислотными оксидами, и с основаниями.
- Гидроксиды. Эти вещества неограниченно растворяются в воде, изменяют окраску при воздействии на них щелочами.
Соединения органической природы
Большинство предметов, с которыми человек ежедневно сталкивается, изготовлены из органических соединений. Органические химические соединения представляют собой обширный класс связей, составы и свойства групп, при взаимодействии которых они отличаются завидной разнообразностью. Стоит подробнее рассмотреть группы этих соединений.

Группы органических соединений и их некоторые свойства
- Углеводороды. Они представляют собой соединения только атомов водорода и углерода. Можно выделить предельные и непредельные, линейные (ациклические) и карбоциклические, ароматические и не ароматические; алканы, алкены, алкины, диены, нафтены. Для всех перечисленных углеводородов является общим свойством их не смешиваемость с водой. Для предельных типичны реакции замещения, а для непредельных - присоединения.
- Спирты - соединения, содержащие в своем составе гидроксильную (-ОН) группу (конечно, органические соединения). Они обладают свойствами слабых кислот, для них характерны реакции нуклеофильного замещения и реакции окисления, а также спирты сами могут выступать в качестве нуклеофила.
- Простые и сложные эфиры. Простые эфиры малорастворимы в воде, обладают слабоосновными свойствами. Сложные эфиры выступают в качестве носителей электрофильных реагентов, вступают в реакции замещения.
- Альдегиды (содержат альдегидную -СНО группу). Они вступают в такие реакции, как присоединение, окисление, восстановление, сопряженного присоединения.
- Кетоны. Для них характерны гидрирование, конденсация, нуклеофильное замещение.
- Карбоновые кислоты. Они проявляют, конечно же, кислотные свойства. Восстановление, галогенирование, реакции нуклеофильного замещения у ацильного атома углерода, получение амидов и нитрилов, декарбоксилирование - основные характерные реакции.
- Амиды. Гидролизация, разложение, кислотность и основность - основные свойственные реакции для амидов.
- Амины. Являются основаниями; взаимодействуют с водой, с кислотами, с ангидридами, галогенами и галогеналканами.
fb.ru
Классы неорганических соединений | Дистанционные уроки
04-Окт-2012 | комментариев 10 | Лолита Окольнова
Это очень важная тема в неорганической химии и в учебниках, и в интернете, но здесь я хочу показать именно практическое применение классификации. Так что, давайте разбираться!
Основные классы неорганических соединений:
простые вещества;
сложные вещества:
- оксиды;
- основания;
- кислоты;
- соли

Давайте сразу разберем эту схему на примерах:
У нас есть простые вещества:
- металлы: Na, например
- неметаллы: S
При взаимодействии с кислородом (O2) образуются оксиды:
- из металлов образуются основные оксиды: 4Na + O2 = 2Na2O
- из переходных элементов (диагональ о Be к At) — амфотерные оксиды — Al2O3
- из неметаллов образуются кислотные оксиды — SO2
- также из неметаллов образуются несолеобразующие оксиды: 2С + O2 = 2CO
Названия оксидов очень логичны — из основных оксидов образуются основания — соединения с- OH — группой:
Na2O + h3O = NaOH
( Me(OH)x — общая формула. Х= степени окисления металла. Заряд группы -OH= -1)
Систематическое названия — гидроксиды;
Растворимые основания называются щелочи.
Кислотные оксиды при взаимодействии с водой дают кислоты — соединения, у которых в начале молекулы стоит Н — водород: SO2 + h3O = h3SO3
(Когда пишите уравнения взаимодействия, то просто складываете атомы: сначала H, потом неметалл, потом кислород)
Кислоты и основания при взаимодействии друг с другом дают соли: 2NaOH + h3SO3 = Na2SO3 + 2h3O
Эта реакция называется реакцией нейтрализации, т.к. кислота и щелочь дают соль и воду — «нейтрализуется» действие каждого из реагентов.
Амфотерные оксиды и несолеобразующие лучше разобрать отдельно… у них своя запутанная история 🙂
Есть еще одна довольно удобная табличка по взаимодействиям основных классов неорганических соединений:

Правый столбец — все, что относится к металлам и их соединениям.
Левый столбец — неметаллы и их соединения.
ВНУТРИ СТОЛБЦА РЕАКЦИИ НЕ ИДУТ!
(есть некоторые исключения — например, реакции оксидов и металлов d-элементов)
Т.е. основной оксид с основанием взаимодействовать не будет: Na2O + NaOH —> реакция не идет
кислота с кислотным оксидом взаимодействовать не будут: SO2 + h3SO3 —> реакция не идет
ВЕЩЕСТВА ИЗ РАЗНЫХ СТОЛБЦОВ РЕАГИРУЮТ МЕЖДУ СОБОЙ
Давайте эти реакции разберем подробнее…
1. Идем по синим стрелочкам
1. Металл + неметалл = соль:
2Na+ Cl2 = 2NaCl — хлорид натрия
2Na + S = Na2S — сульфид натрия
2. металл + кислотный оксид = оксид металла + неметалл/несолеобразующий оксид:
2Na + CO2 = Na2O + CO
Na + SO2 = Na2O + S
здесь суть в том, что металл окисляется кислородом кислотного оксида, а оксид, соответственно, восстанавливается металлом.
3. металл + кислота = соль + …
Здесь нам понадобится ряд активности металлов.
- Если металл стоит ДО ВОДОРОДА Н, то он вытесняет водород из кислот: 2Na + 2HCl =2 NaCl + h3
- Если металл стоит ПОСЛЕ ВОДОРОДА, то реакция идет без выделения h3: Сu + 4HNO3 = Cu(NO3)2 + NO2 +2 h3O
4. металл + соль = другая соль + другой металл
И опят нам нужен ряд активности металлов. Только предыдущий металл может вытеснить последующий из его соли:
2Na + MgCl2 = 2NaCl + Mg
Na + CaCl2 —> реакция не идет!
2. Идем по зеленым стрелочкам
1. Основной оксид + неметалл = металл/ оксид с меньшей степенью окисления + кислотный оксид/ несолеобразующий оксид
Na2O + S = 2Na + SO2
Fe2O3 + C = 2FeO + CO
здесь идет окислительно-восстановительный процесс — неметалл восстанавливает основной оксид, сам при этом окисляется
2. Основной оксид + кислотный оксид = соль
Na2O + SO2 = Na2SO3 — сульфит натрия (просто «складываем» количество атомов 🙂 )
3. Основной оксид + соль —> реакция не идет
3. Идем по желтым стрелочкам
1. основание + неметалл =…
Обычно такие реакции не идут. Исключение составляет NaOH и Cl2:

2. основание + кислотный оксид = соль
2NaOH + SO2 = Na2SO3 + h3O
3. основание + кислота = соль — РЕАКЦИЯ НЕЙТРАЛИЗАЦИИ
NaOH + HCl = NaCl + h3O
4. основание + соль —> реакция идет, если образуется газ, осадок или малодиссоциирующее вещество
Как видите, в большинстве случаев реакции между веществами из двух столбцов приводят к образованию соли. Ну а исключения надо отдельно все разобрать, а некоторые выучить.

в ЕГЭ это задания:
- А7 — классификация органических и неорганических веществ.
- А8 — свойства простых веществ.
- А9 — химические свойства оксидов.
- А10 — свойства оснований и кислот.
- А11 — химические свойства солей.
- А12 — взаимосвязь неорганических соединений.
в ГИА (ОГЭ) по химии:
- А9 — Химические свойства простых веществ: металлов и неметаллов
- А10 — Химические свойства оксидов: основных, амфотерных, кислотных
- А11 — Свойства оснований и кислот
- А12 — Химические свойства солей (средних)
Категории: |
Обсуждение: "Классы неорганических соединений"
(Правила комментирования)distant-lessons.ru
Классы неорганических веществ | Студенческая жизнь
Неорганические вещества бывают простыми и сложными. Простые состоят из атомов одного вида, или, как говорят химики, одного химического элемента. К ним относятся металлы (например, Ca, Fe, Cu)и неметаллы (S, P, O2 и другие).
Сложные вещества, в отличие от простых, состоят из атомов разных химических элементов. К ним принадлежат такие классы неорганических веществ, как оксиды, гидроксиды и соли.
Рассмотрим их подробнее.
Оксиды
Оксиды — это бинарные соединения, в которых один из элементов — обязательно кислород, причем в степени окисления -2. Общая формула веществ этого класса RxOy.
Оксиды бывают:
- несолеобразующие или безразличные — не взаимодействующие ни с основаниями, ни с кислотами и, как следствие, не образующие солей.
- солеобразующие, которые способны образовать соль при взаимодействии с кислотой или щёлочью.
Первая группа очень немногочисленна. К несолеобразующим принадлежат оксиды азота (I)и (II), и оксид углерода (II) (N2O, NO, CO).
Солеобразующих оксидов гораздо больше. Они в свою очередь делятся на три группы.
- Кислотными называют такие оксиды, в которых атомы кислорода связаны с неметаллом или металлом в степени окисления от +5 до +7. Иначе их называют ангидридами кислот. Примерами таких оксидов являются SO2 -оксид серы (IV) или сернистый ангидрид, CrO3 — оксид хрома (VI) или хромовый ангидрид и другие.
- В основных оксидах кислород связан с металлами, степени окисления которых +1 и +2, например, Na2O, CaO. Таким оксидам соответствуют основания, поэтому ZnO и BeO, хотя и содержат в своём составе металлы в степени окисления +2, основными не являются, так как им соответствуют амфотерные гидроксиды.
- Амфотерными называют оксиды, которые могут взаимодействовать и с кислотами, и с основаниямиё. Металл них находится в степени окисления +3 или +4, например, Al2O3, PbO2. Также амфотерны оксиды бериллия и цинка.
Гидроксиды
Это группа, объединяющая такие классы неорганических веществ, как основания, кислородсодержащие кислоты и амфотерные гидроксиды.
Основания — соединения, в формуле которых обязательно присутствует металл и одна или несколько гидроксогрупп. Общая формула — R(OH)x. Различают растворимые (щелочи — NaOH, Ba(OH)2) и нерастворимые (Mg(OH)2, Cu(OH)2) основания.
С точки зрения теории электролитической диссоциации щелочи — электролиты, диссоциирующие с образованием катиона металла и гидроксид-ионов, которых может быть один или несколько.
Кислоты (HxR, где R — кислотный остаток) — сложные вещества, образованные атомами водорода и кислотными остатками, или электролиты, в качестве катионов отщепляющие только катионы водорода. Кислоты бывают кислородсодержащими (HNO3, h3SO4) или бескислородными (HCl, h3S). Подробнее об этом написано в статье «Формулы кислот».
Амфотерными называют такие гидроксиды, которые могут выступать в роли как кислот, так и оснований. Они образованы гидроксогруппами и металлами в степени окисления +3 и +4. Также амфотерны гидроксиды цинка и бериллия. Формулы этих соединений пишут следующим образом: Zn(OH)2 либо h3ZnO2.
Соли
Соли похожи на кислоты наличием кислотного остатка в их составе, но атомы водорода в них замещены атомами металлов или ионами аммония. Общая формула солей MxRy, где М — металл (ион аммония), а R — кислотный остаток. С точки зрения электролитической диссоциации солями называют электролиты, диссоциирующие с образованием катионов металлов или аммония и анионов кислотных остатков.
Если в составе соли присутствуют только металл (катион аммония) и кислотный остаток, то говорят, что это средняя или нормальная соль. Представителями этой группы являются такие вещества, как поваренная соль (NaCl- хлорид натрия), аммиачная селитра (Nh5NO3) и многие другие.
Существуют соли, в составе которых помимо катиона металла и кислотного остатка присутствует ион водорода H+. Их называют кислыми. Такова всем известная пищевая сода (NaHCO3 — гидрокарбонат натрия).
Есть среди солей и основные, содержащие гидроксогруппу в своем составе. Катион металла (аммония) и кислотный остаток при этом остаются обязательными составляющими соли. Основной солью является малахит — гидроксокарбонат меди (II), формула которого (CuOH)2CO3.
Подробнее о кислых и средних солях читайте в статье «Формулы солей».
Соли также могут быть двойными (содержащими два металла). Алюмокалиевые квасцы или сульфат калия алюминия KAlSO4 — наиболее известная из таких солей.
Встречаются среди солей и такие, в которых катион либо анион комплексные: K3[Fe(CN)6] — гексацианоферрат (III) калия, [Cu(h3O)6]SO4 — сульфат гексааквамеди (II).
Выше рассмотрены только основные классы неорганических веществ, которые наиболее часто встречаются в учебных пособиях и повседневной жизни человека. Здесь можно также прочитать про классы органических веществ.
life-students.ru
Химия. Основные классы неорганических соединений.

- Простые вещества. Вещества, состоящие из атомов одного типа. К ним относятся:
- Металлы (Me). Металлы характеризуются рядом физических свойств. Это электропроводность, ковкость и металлический блеск. К металлам относят элементы главных подгрупп, находящиеся на диагонали от к и находящиеся левее этой диагонали. Металлами являются также все элементы побочных групп. В приложенной таблице Менделеева металлы окрашены в зеленый, розовый цвет или двумя цветами сразу. Среди металлов отдельно выделяют:
− щелочные. Металлы I А группы. ;− щелочноземельные. .
- Неметаллы (НеМе). В приложенной таблице неметаллы окрашены в желтый и фиолетовый цвета. Среди неметаллов отдельно выделяют:
− галогены. Неметаллы VII A группы. ;− благородные газы. .
- Оксиды. Соединения, содержащие только элемент и кислород в степени окисления
. Внимание, оксидами не являются перекиси и фторид кислорода .
- Основные оксиды. Оксиды, которым соответствуют основные гидроксиды. Это оксиды металлов в степени окисления и , кроме и . Например, основными являются .
- Амфотерные оксиды. Оксиды, которым соответствует амфотерные гидроксиды. Это оксиды металлов в степенях окисления и , а также и . Например, амфотерными оксидами являются .
- Несолеобразующие оксиды. Несолеобразующие оксиды не реагируют с кислотами и щелочами, иногда их называют безразличными оксидами. В школьном курсе встречаются три несолеобразующих оксида: .
- Кислотные оксиды. Оксиды, которым соответствуют кислотные гидроксиды. Кислотными считаются все оксиды неметаллов, кроме несолеобразующих, и оксиды металлов со степенями окисления , , . Например, кислотными оксидами являются .
- Гидроксиды. В состав гидроксидов входят атомы водорода, кислорода и еще некоего элемента. В зависимости от характера гидроксидов, их изображают либо как или как .
- Основные гидроксиды или основания. Это соединения вида , проявляющие определенный набор свойств (основных свойств). Основаниями являются гидроксиды металлов в степенях окисления и , кроме и . Например, основаниями являются
- Амфотерные гидроксиды. Гидроксиды, проявляющие свойства оснований и кислот. Амфотерными являются гидроксиды вида , где степень окисления металла или (в случае и ). Например, амфотерными гидроксидами являются .
- Кислотные гидроксиды или кислородосодержащие кислоты. Имеют общий вид , где – неметалл или металл в степени окисления Примерами кислородосодержащих кислот могут быть Стоит заметить, что кислоты бывают и бескислородными, но они не являются гидроксидами. Бескислородные кислоты:
- Соли.Сложные соединения, содержащие в своем составе металлы (или металлоподобный ион ) и кислотные остатки. Кислотным остатком называется кислота, лишившаяся атомов
- Средние. Соли, содержащие только металл (или металлоподобный ион ) и кислотный остаток. Примеры таких солей:
- Кислые. Кислые соли отличаются от средних наличием в составе атомов оставшихся от кислоты. Примеры таких солей: Кислыми солями не являются средние соли аммония: и подобные.
- Основные соли. Основные соли, в отличие от средних, имеют группу , пришедшую из основания. Примеры основных солей: .
- Двойные. Соли, содержащие два металла и один кислотный остаток. Примеры двойных солей:
- Смешанные. Соли, содержащие один металл и два кислотных остатка. Пример смешанной соли:
- Комплексные соли. Более сложный вид солей, содержащий в центре атом металла (комплексообразующий ион), а рядом с металлом в скобках указывают лиганд. В школьном курсе чаще всего попадаются следующие комплексные соли: и подобные.
Звоните нам: 8 (800) 775-06-82 (бесплатный звонок по России) +7 (495) 984-09-27 (бесплатный звонок по Москве)
Или нажмите на кнопку «Узнать больше», чтобы заполнить контактную форму. Мы обязательно Вам перезвоним.
ege-study.ru
Классификация неорганических веществ | CHEMEGE.RU
Химические вещества можно разделить на две неравные группы: простые и сложные.
Простые вещества состоят из атомов одного элемента (О2, P4).
Сложные вещества состоят из атомов двух и более элементов (CaO, h4PO4).
Простые вещества можно разделить на металлы и неметаллы.
Металлы – это простые вещества, в которых атомы соединены между собой металлической химической связью. Металлы стремятся отдавать электроны и характеризуются металлическими свойствами (металлический блеск, высокая электро- и теплопроводность, пластичность и др.).
Неметаллы – это простые вещества, в которых атомы соединены ковалентными (или межмолекулярными) связями. Неметаллы стремятся принимать или притягивать электроны. Неметаллические свойства – это способность принимать или притягивать электроны.
Все элементы в Периодической системе химических элементов (ПСХЭ) расположены либо в главной подгруппе, либо в побочной. В различных формах короткопериодной ПСХЭ главные и побочные подгруппы расположены по-разному. Есть простой способ, который позволит вам быстро и надежно определять, к акой подгруппе относится элемент. Дело в том, что все элементы второго периода расположены в главной подгруппе. Те элементы, которые расположены в ячейке точно под элементами второго периода (справа или слева), относятся к главной подгруппе. Остальные — к побочной.
Например, в таблице Менделеева, которая используется на ЕГЭ по химии, элемент номер 32, галлий, расположен в ячейке справа, точно под соответствующим ему элементом второго периода, бором. Следовательно, галлий относится к главной подгруппе. А вот скандий, элемент номер 21, расположен в ячейке слева. Следовательно, скандий относится к побочной подгруппе.
Неметаллы расположены в главных подгруппах, в правом верхнем угле ПСХЭ. К металлам относятся все элементы побочных подгрупп и элементы главных подгрупп, расположенные в левой нижней части ПСХЭ. Разделяют металлы и неметаллы обычно, проводя условную линию от бериллия до астата. На рисунке показано точное разделение на металлы и неметаллы. Закрашены цветом неметаллы.
Основные классы сложных веществ — это оксиды, гидроксиды, соли.
Оксиды — это сложные вещества, которые состоят из атомов двух элементов, один из которых кислород, имеющий степень окисления -2.
В зависимости от второго элемента оксиды проявляют разные химические свойства. Некоторым оксидам соответствуют гидроксиды (солеобразующие оксиды), а некоторым нет (несолеобразующие).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, которые проявляют характерные основные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +1 и +2. Например, оксид лития Li2O, оксид железа (II) FeO.
Кислотные оксиды — это оксиды, которые проявляют кислотные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов с любой степенью окисления. Например, оксид хлора (I) Cl2O, оксид хрома (VI) CrO3.
Амфотерные оксиды — это оксиды, которые проявляют и основные, и кислотные свойства. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Встречаются и оксиды, похожие на соли, т.е. солеобразные (двойные).
Двойные оксиды — это некоторые оксиды, образованные элементом с разными степенями окисления. Например, магнетит (магнитный железняк) FeO·Fe2O3.
Алгоритм определения типа оксида: сначала определяем, какой элемент образует оксид – металл или неметалл. Если это металл, то определяем степень окисления, затем определяем тип оксида. Если это неметалл, то оксид кислотный (если это не исключение).
Гидроксиды — это сложные вещества, в составе которых есть группа Э-O-H. К гидроксидам относятся основания, амфотерные гидроксиды, и кислородсодержащие кислоты.
Каждому солеобразующему оксиду соответствует гидроксид:
основному оксиду соответствует гидроксид основание,
кислотному оксиду соответствует гидроксид кислота,
амфотерному оксиду соответствует амфотерный гидроксид.
Например, оксид хрома (II) CrO — основный, ему соответствует гидроксид основание. Формулу гидроксида легко получить, просто добавив к металлу гидроксидную группу OH: Cr(OH)2.
Оксид хрома (VI) — кислотный, ему соответствует гидроксид кислота h3CrO4, и кислотный остаток хромат-ион CrO42-.
Если все индексы кратны 2, то мы делим все индексы на 2.
Например: N2O5 + h3O → h3N2O6, делим на 2, получаем HNO3. Так получаем мета-формулу кислоты. Если мы добавим еще одну молекулу воды, то получим орто-формулу кислоты.
Например: оксид P2O5, мета-форма: HPO3. Добавляем воду, орто-форма: h4PO4. Орто-форма устойчива у фосфора и мышьяка.
Оксид хрома (III) — Cr2O3 — амфотерный, ему соответствует амфотерный гидроксид, который может выступать и как основание, и как кислота: Cr(OH)3 = HCrO2, кислотный остаток хромит: CrO2—.
Взаимосвязь оксидов и гидроксидов:
Основания (основные гидроксиды) — это сложные вещества, которые при диссоциации в водных растворах в качестве анионов (отрицательных ионов) образуют только гидроксид-ионы OH—.
Основания можно разделить на растворимые в воде (щелочи), нерастворимые в воде, и самопроизвольно разлагающиеся.
К разлагающимся в воде (неустойчивым) основаниям относят гидроксид аммония, гидроксид серебра (I), гидроксид меди (I). В водном растворе такие соединения практически необратимо распадаются:
Nh5OH → Nh4 + h3O
2AgOH → Ag2O + h3O
2CuOH → Cu2O + h3O
Основания с одной группой ОН – однокислотные (например, NaOH), с двумя – двухкислотные (Ca(OH)2) и с тремя – трехкислотные (Fe(OH)3).
Кислоты – это сложные вещества, которые при диссоциации в водных растворах образуют в качестве катионов только ионы гидроксония h4O+(H+). Кислоты состоят из катиона водорода H+ и аниона кислотного остатка.
По числу атомов водорода, которые можно заместить на металлы, кислоты разделяют на одноосновные (HNO3), двухосновные (h3SO4), трехосновные (h4PO4) и т.д.
По содержанию атомов кислорода кислоты делят на бескислородные (например, соляная кислота HCl) и кислородсодержащие (например, серная кислота h3SO4).
Кислоты также можно разделить на сильные и слабые.
Сильные кислоты. К ним относятся:
- Бескислородные кислоты: HCl, HBr, HI. Остальные бескислородные кислоты, как правило, слабые.
- Некоторые высшие кислородсодержащие кислоты: h3SO4, HNO3, HClO4и др.
Слабые кислоты. К ним относятся:
- Слабые и растворимые кислоты: это h4PO4, Ch4COOH, HF и др.
- Летучие или неустойчивые кислоты: h3S — газ; h3CO3 — распадается на воду и оксид: h3CO3 → Н2О + СО2↑; h3SO3— распадается на воду и оксид: h3SO3 → h3O+ SО2↑.
- Нерастворимые в воде кислоты: h3SiO3, h4BO3 и другие.
Определить, сильная кислота перед вами, или слабая, позволяет простой прием. Мы вычитаем из числа атомов O в кислоте число атомов H. Если получаем число 2 или 3, то кислота сильная. Если 1 или 0 — то кислота слабая.
Например: HClO: 1-1 = 0, следовательно, кислота слабая.
Соли – сложные вещества, состоящие из катиона металла (или металлоподобных катионов, например, иона аммония Nh5+) и аниона кислотного остатка. Также солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды.
Если рассматривать соли, как продукты взаимодействия кислоты и основания, то соли делят на средние, кислые и основные.
Средние соли – продукты полного замещения катионов водорода в кислоте на катионы металла (например, Na2CO3, K3PO4).
Кислые соли – продукты неполного замещения катионов водорода в кислоте на катионы металлов (например, NaHCO3, K2HPO4).
Основные соли – продукты неполного замещения гидроксогрупп основания на анионы кислотных остатков кислоты (например, малахит (CuOH)2CO3).
По числу катионов и анионов соли разделяют на:
Простые соли – состоящие из катиона одного типа и аниона одного типа (например, хлорид кальция CaCl2).
Двойные соли – это соли, состоящие из двух или более разных катионов и аниона одного типа (например, алюмокалиевые квасцы – KAl(SO4)2).
Смешанные соли – это соли, состоящие из катиона одного типа и двух или более анионов разного типа (например, хлорид-гипохлорит кальция Ca(OCl)Cl).
По структурным особенностям выделяют также гидратные соли и комплексные соли.
Гидратные соли (кристаллогидраты) – это такие соли, в состав которых входят молекулы кристаллизационной воды (например, декагидрат сульфата натрия Na2SO4·10 h3O).
Комплексные соли – это соли, содержащие комплексный катион или комплексный анион (K3[Fe(CN)6], [Cu(Nh4)4](OH)2).
Помимо основных классов неорганических соединений, существует большое количество других. Например, бинарные соединения элементов с водородом.
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водород образует солеобразные гидриды и летучие водородные соединения.
Солеобразные гидриды ЭНх – это соединения металлов IA, IIA групп и алюминия с водородом. Степень окисления водорода равна -1. Например, гидрид натрия NaH.
Летучие водородные соединения НхЭ – это соединения неметаллов с водородом, в которых степень окисления водорода равна +1. Например, аммиак Nh4, фосфин Ph4.
Поделиться ссылкой:
chemege.ru