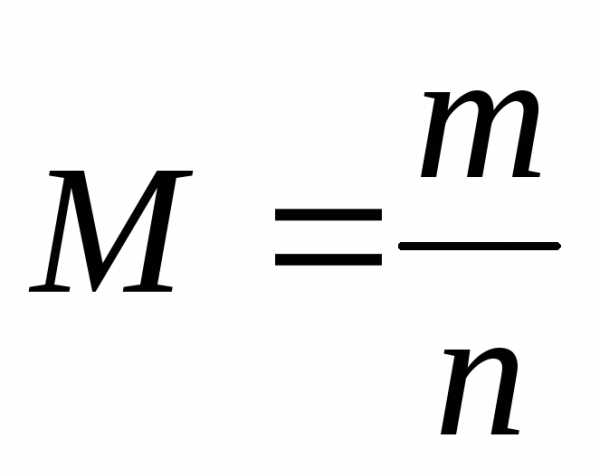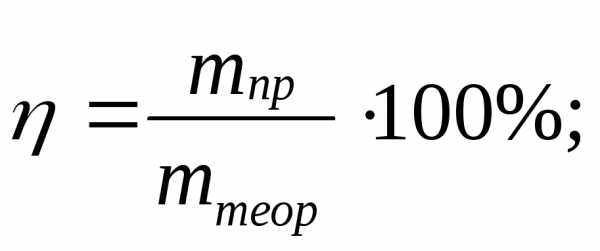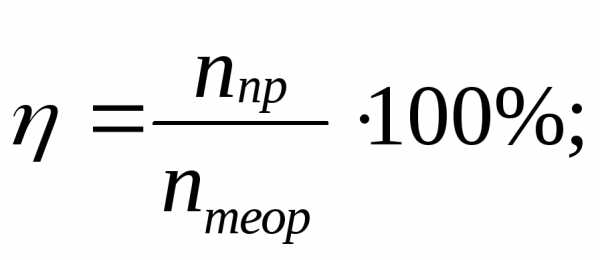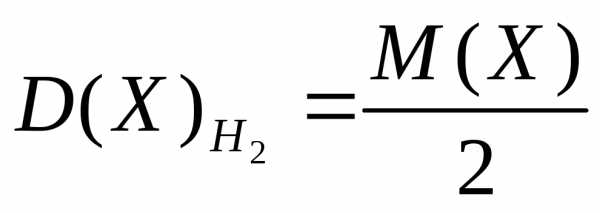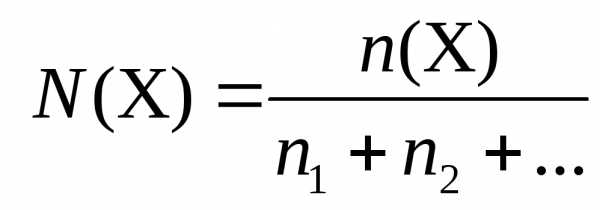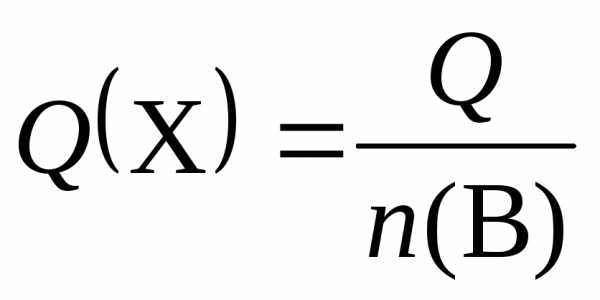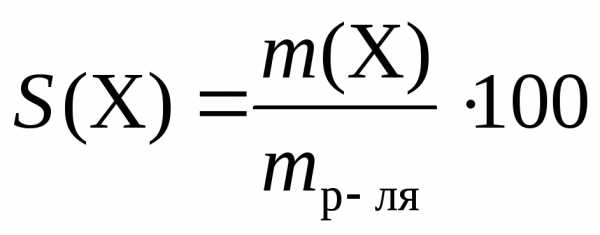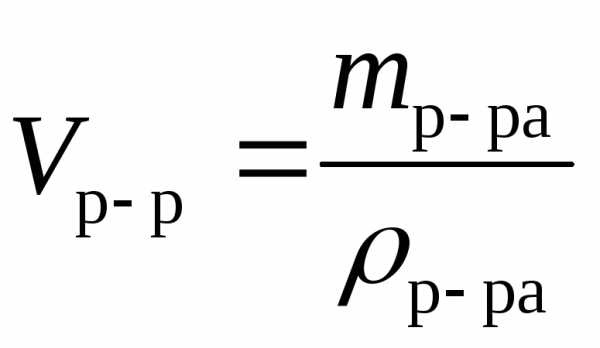как решать химические уравнения по химии 8 класс объясните пожалуйста. Как решать химические формулы
Основные Химические формулы для решения задач.
| Плотность вещества | ρ | кг/м³ | ρ = m / V(Массу делим на объем вещества) |
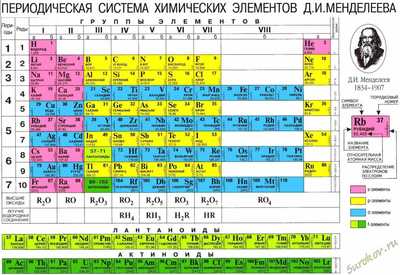
| Относительная атомная масса элемента | Аr | - | Ar = ma / uсм. в периодической система химических элементов |
| Атомная единица массы | uа.е.м. | кг | u = 1/12 * ma (12C)const = 1.66*10-27 |
| Масса атома (абсолютная) | ma | кг | ma = Ar * u |
| Относительная молекулярная (формульная) масса вещества | Mr | - | Mr (AxBy)=m(AB) / uMr(AxBy)=x*Ar(A) + y*Ar(B) |
| Масса молекулы (формульной единицы) | m M | кг | mM = Mr*u |
| Количество вещества | n | моль | n=m/Mn=N/NAn=V/VM |
| Молярная масса (масса 1 моль вещества) | M | г/моль | M=m/nM=MrM=Ar (для простых веществ) |
| Масса вещества | m | г (кг) | m=M*nm=ρ*V |
| Число структурных единиц | N | атомов, молекул, ионов, частиц, формульных единиц (Ф.Е.) | N=NA*n |
| Молярный объем - число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н.у.) | VM | л/моль | const=22,4 |
| Объем газа при н.у. | V | л | V=VM*nV=m/ρ |
| Постоянная Авогадро | NA | частиц/моль | const=6,02*1023 |
| Массовая доля вещества (омега) | ωЭ/В | % | ωЭ/В = (Ar(э) * k) / Mr(В) |
| HF | Фтороводород, плавиковая | F- | Фторид |
| HCl | Хлороводород, соляная | Cl- | Хлорид |
| HBr | Бромоводород | Br- | Бромид |
| HI | Йодоводород | I- | Йодид |
| h3S | Сероводород | S2- | Сульфид |
| HCN | Циановодородная | CN- | Цианид |
| HNO2 | Азотистая | NO2- | Нитрит |
| HNO3 | Азотная | NO3- | Нитрат |
| h4PO4 | Ортофосфорная | PO43- | Фосфат |
| h4AsO4 | Мышьяковая | AsO43- | Арсенат |
| h3SO3 | Сернистая | SO32- | Сульфит |
| h3SO4 | Серная | SO42- | Сульфат |
| h3CO3 | Угольная | CO32- | Карбонат |
| h3SiO3 | Кремниевая | SiO32- | Силикат |
| h3CrO4 | Хромовая | CrO42- | Хромат |
| h3Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| HMnO4 | Марганцовая | MnO4- | Перманганат |
| HClO | Хлорноватистая | ClO- | Гипохлорит |
| HClO2 | Хлористая | ClO2- | Хлорит |
| HClO3 | Хлорноватая | ClO3- | Хлорат |
| HClO4 | Хлорная | ClO4- | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO- | Формиат |
| Ch4COOH | Этановая, уксусная | Ch4COO- | Ацетат |
| h4C2O4 | Этандиовая, щавелевая | C2O42- | Оксалат |
5urokov.ru
Составление химических формул простым и доступным языком

Одной из самых главных задач в химии является правильное составление химических формул. Химическая формула — это письменное представление состава химического вещества с помощью латинского обозначения элемента и индексов. Для правильного составления формулы нам обязательно понадобится таблица Менделеева и знание простых правил. Они достаточно простые и запомнить их смогут даже дети.
Как составлять химические формулы
Основным понятием при составлении химических формул является «валентность«. Валентность — это свойство одного элемента удерживать определенное число атомов в соединении. Валентность химического элемента можно посмотреть в таблице Менделеева, а также нужно помнить и уметь применять простые общие правила.
- Валентность металла всегда равна номеру группы, при условии, что он находится в главной подгруппе. Например, калий имеет валентность 1, а кальций — 2.
- С неметаллами немного сложнее. Неметалл может иметь высшую и низшую валентности. Высшая валентность равна номеру группы. Низшую валентность можно определить вычтя номер группы элемента из восьми. При соединении с металлами неметаллы всегда имеют низшую валентность. Кислород всегда имеет валентность 2.
- В соединении двух неметаллов низшую валентность имеет тот химический элемент, который находится в таблице Менделеева правее и выше. Однако, фтор всегда имеет валентность 1.
- И еще одно важное правило при расстановке коэффициентов! Общее число валентностей одного элемента всегда должно быть равно общему количеству валентностей другого элемента!
Закрепим полученные знания на примере соединения лития и азота. Металл литий имеет валентность, равную 1. Неметалл азот располагается в 5 группе и имеет высшую валентность 5 и низшую — 3. Как мы уже знаем, в соединениях с металлами неметаллы всегда имеют низшую валентность, поэтому азот в данном случае будет иметь валентность равную трем. Расставляем коэффициенты и получаем искомую формулу: Li3N.
Вот так, достаточно просто, мы научились составлять химические формулы! А для лучшего запоминания алгоритма составления формул мы подготовили его графическое представление.
Составление химических формул: алгоритм
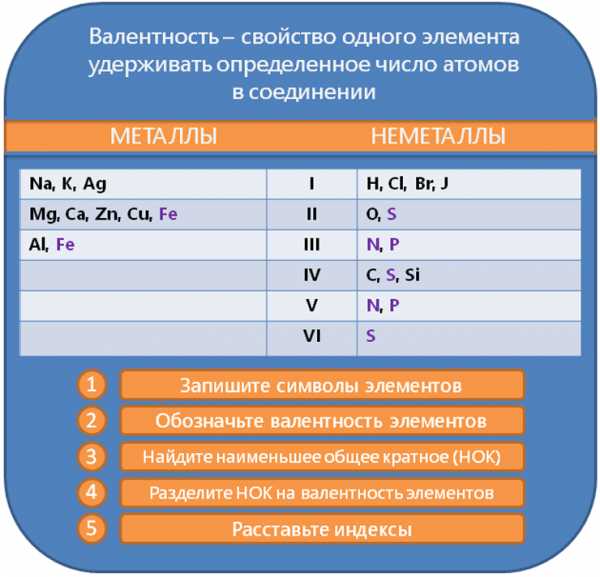 Алгоритм составления химических формул
Алгоритм составления химических формул
www.alto-lab.ru
Урок 5. Химическая формула – HIMI4KA
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.

Состав любого вещества выражается в виде химической формулы.
Химическая формула — это условная запись состава вещества с помощью химических знаков и индексов.
Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
Индекс — число атомов данного химического элемента в формуле вещества.
Например, химическая формула простого вещества водорода записывается так:
и читается «аш-два».
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — Nh4 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — h3SO4 («аш-два-эс-о-четыре»), а глюкозы — C6h22O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
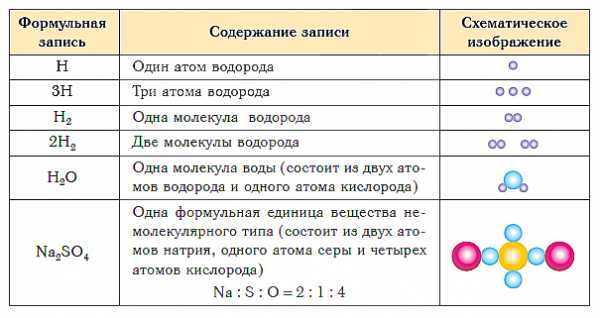
Краткие выводы урока:
- Качественный и количественный состав вещества выражается с помощью химических формул.
- Химическая формула вещества молекулярного строения показывает состав его молекулы, которая является элементарной структурной единицей данного вещества.
- Химическая формула вещества немолекулярного строения показывает простейшее соотношение атомов в его формульной единице.
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Основные формулы для решения задач
| Величина и ее размерность | Соотношение |
| |
|
| Порядковый номер элемента | Z = N(е–) = N(р+) |
| Массовая доля элемента Э в веществе Х, в долях единицы, в %) | |
| Количество вещества Х, моль |
|
| Количество вещества газа, моль | н.у. – р = 101 325 Па, Т = 273 К |
| Молярная масса вещества Х, г/моль, кг/моль | |
| Масса вещества X, г, кг | m(X) = n(X)M(X) |
| Молярный объем газа, л/моль, м3/моль | |
| Объем газа, м3 | V = Vm×n |
| Выход продукта | |
| Плотность вещества Х, г/л, г/мл, кг/м3 |
|
| Плотность газообразного вещества Х по водороду | |
| Плотность газообразного вещества Х по воздуху |
М(воздуха) = 29 г/моль |
| Объединенный газовый закон | |
| Уравнение Менделеева-Клапейрона | PV = nRT, R = 8,314 Дж/моль×К |
| Объемная доля газообразного вещества в смеси газов, в долях единицы или в % |
|
| Молярная масса смеси газов |
|
| Молярная доля вещества (Х) в смеси | |
| Количество теплоты, Дж, кДж | Q = n(X)Q(X) |
| Тепловой эффект реакции | Q =–H |
| Теплота образования вещества Х, Дж/моль, кДж/моль | |
| Скорость химической реакции (моль/лсек) |
|
| Закон действия масс (для простой реакции) | aA + вB = сС + dD u = kс a(A)с в(B) |
| Правило Вант-Гоффа | |
| Растворимость вещества (Х) (г/100 г растворителя) | |
| Массовая доля вещества Х в смеси А + Х, в долях единицы, в % |
|
| Масса раствора, г, кг | m(р-р) = m(X) + m(h3O) m(р-р) = V(р-р)(р-р) |
| Массовая доля растворенного вещества в растворе, в долях единицы, в % |
|
| Плотность раствора | |
| Объем раствора, см3, л, м3 | |
| Молярная концентрация, моль/л |
|
| Степень диссоциации электролита (Х), в долях единицы или % | |
| Ионное произведение воды | K(h3O) = [H+][OH–] |
| Водородный показатель | рН = –lg[H+] |
Рекомендуемая литература
Основная:
Кузнецова Н.Е. и др. Химия. 8 кл-10 кл.. – М.: Вентана-Граф, 2005-2007.
Кузнецова Н.Е., Литвинова Т.Н., Левкин А.Н. Химия.11 класс в 2-х частях, 2005-2007 гг.
Егоров А.С. Химия. Новое учебное пособие для подготовки в вузы. Ростов н/Д: Феникс, 2004.– 640 с.
Егоров а.С. Химия: современный курс для подготовки к егэ. Ростов н/д: Феникс, 2011. (2012)– 699 с.
Егоров А.С. Самоучитель по решению химических задач. – Ростов-на-Дону: Феникс, 2000.– 352 с.
Химия/пособие-репетитор для поступающих в вузы. Ростов-н/Д, Феникс, 2005– 536 с.
Хомченко Г.П.,Хомченко И.Г. Задачи по химии для поступающих в вузы. М.: Высшая школа. 2007.–302с.
Дополнительная:
Врублевский А.И. Учебно-тренировочные материалы для подготовки к централизованному тестированию по химии/ А.И. Врублевский –Мн.: ООО «Юнипресс», 2004.– 368 с.
Врублевский А.И. 1000 задач по химии с цепочками превращений и контрольными тестами для школьников и абитуриентов.– Мн.: ООО «Юнипресс», 2003.– 400 с.
Егоров А.С. Все типы расчетных задач по химии для подготовки к ЕГЭ.–Ростов н/Д: Феникс, 2003.–320с.
Егоров А.С., Аминова Г.Х. Типовые задания и упражнения для подготовки к экзамену по химии. – Ростов н/Д: Феникс, 2005.– 448 с.
Единый государственный экзамен 2007. Химия. Учебно-тренировочные материалы для подготовки учащихся/ФИПИ – М.: Интеллект-Центр, 2007.– 272 с.
ЕГЭ-2011. Химия. Учебно-тренировочный комплект под ред. А.А. Кавериной.– М.: Национальное образование, 2011.
Единственные реальные варианты заданий для подготовки к единому государственному экзамену. ЕГЭ.2007. Химия/В.Ю. Мишина, Е.Н. Стрельникова. М.: Федеральный центр тестирования, 2007.–151с.
Каверина А.А. Оптимальный банк заданий для подготовки учащихся. Единый государственный экзамен 2012.Химия. Учебное пособие./ А.А. Каверина, Д.Ю. Добротин, Ю.Н. Медведев, М.Г. Снастина.– М.: Интеллект-Центр, 2012.– 256 с.
Литвинова Т.Н., Выскубова Н.К., Ажипа Л.Т., Соловьева М.В. Тестовые задания в дополнение к контрольным работам для слушателей 10-месячных заочных подготовительных курсов (методические указания). Краснодар, 2004. – С. 18 – 70.
Литвинова Т.Н. Химия. ЕГЭ-2011. Тренировочные тесты. Ростов н/Д: Феникс, 2011.– 349 с.
Литвинова Т.Н. Химия. Тесты к ЕГЭ. Ростов н/Д.: Феникс, 2012. - 284 с.
Литвинова Т.Н. Химия. Законы, свойства элементов и их соединений. Ростов н/Д.: Феникс, 2012. - 156 с.
Литвинова Т.Н., Мельникова Е.Д., Соловьева М.В., Ажипа Л.Т., Выскубова Н.К. Химия в задачах для поступающих в вузы.– М.: ООО «Изд-во Оникс»: ООО «Изд-во «Мир и образование», 2009.– 832 с.
Учебно-методический комплекс по химии для учащихся медико-биологических классов под ред. Т.Н.Литвиновой.– Краснодар.: КГМУ, – 2008.
Химия. ЕГЭ–2008. Вступительные испытания, учебно-методическое пособие / под ред. В.Н. Доронькина. – Ростов н/Д: Легион, 2008.– 271 с
Список сайтов по химии:
1. Alhimik. http://www.alhimik.ru
2. Химия для всех. Электронный справочник за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
3. Школьная химия – справочник. http://www.schoolchemistry.by.ru
4. Репетитор по химии. http://www. chemistry.nm.ru
Интернет-ресурсы
Alhimik. http://www.alhimik.ru
Химия для всех. Электронный справочник за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
Школьная химия – справочник. http://www.schoolchemistry.by.ru
http://www.classchem.narod.ru
Репетитор по химии. http://www. chemistry.nm.ru
http://www.alleng.ru/edu/chem.htm - образовательные ресурсы Интернета по химии
http://schoolchemistry.by.ru/ - школьная химия. На этом сайте есть возможность пройти On-line тестирование по разным темам, а также демонстрационные варианты Единого Государственного Экзамена
Химия и жизнь–ХХ1 век: научно-популярный журнал. http://www.hij.ru
studfiles.net
4. Вывод химических формул соединений. Расчёты по химическим формулам и уравнениям
Химическая формула соединения показывает, из каких химических элементов оно состоит, и в каких количественных соотношениях входят в его состав атомы этих элементов. Различают понятия молекулярной и простейшей формул сложного вещества. Наиболее полную информацию о составе молекулы химического соединения дает его молекулярная формула, в которой указано точное число атомов каждого вида (например, запись h3SO4 означает, что молекулу серной кислоты образуют 2 атома водорода, один атом серы и четыре атома кислорода). Простейшая формула выражает лишь наиболее простой атомный состав соединения, который соответствует отношениям масс атомов элементов, его образующих. Для вывода простейшей формулы химического соединения достаточно знать, из каких элементов состоит сложное вещество и каковы массы их атомов.
Пример 4.1. Вывести простейшую формулу соединения, состоящего на 80 % из углерода и на 20 % из водорода.
Решение:
Обозначим число атомов углерода в формуле соединения через х, а число атомов водорода через у. Это означает, что формула соединения может быть записана как СхНy.
Поскольку атомные массы углерода и водорода соответственно равны 12 и 1 а.е.м., то можно считать, что масса атомов углерода в молекуле соединения будет относиться к массе атомов водорода, как . С другой стороны, по условию отношение этих масс равно . Приравняв к , получаем соотношение, откуда следует, что.
В общем виде этому соотношению числа атомов углерода и водорода могут отвечать соединения с формулами СН3, С2Н6, С3Н9 и т. д.
Простейшая же формула - СН3.
Ответ: Простейшая формула соединения - СН3.
Чтобы найти молекулярную формулу сложного вещества, надо знать его относительную молекулярную массу. Продемонстрируем, как устанавливается молекулярная формула химического соединения.
Пример 4.2. Найти молекулярную формулу соединения, молекулярная масса которого равна 98 и в котором водород составляет 3,06 %, фосфор — 31,63 % и кислород — 65,31 %.
Решение:
Обозначим искомую формулу как HxPyOz. Отношение масс атомов водорода, фосфора и кислорода в формуле:
.
Откуда получаем: х: у: z = 3 : 1 : 4.
Формула искомого соединения - Н3Р04.
Ответ: Молекулярная формула соединения - Н3РО4.
Задачи
4.1. Найти простейшую формулу соединения, содержащего (по массе) 43,4 % натрия, 11,3% углерода и 45,3 % кислорода.
4.2. Найти простейшую формулу вещества, в состав которого входят водород, углерод, кислород и азот в соотношении масс 1:3:4:7.
4.3. Найти простейшую формулу оксида ванадия, зная, что 2,73 г оксида содержат 1,53 г металла.
4.4. Вещество содержит (массовых процентов) 26,53 % калия, 35,37 % хрома и 38,10 % кислорода. Найти его простейшую формулу.
4.5. При взрыве смеси, полученной из 1 объема некоторого газа и 2 объемов кислорода, образуется 2 объема СО2 и 1 объем N2. Найти молекулярную формулу газа.
4.6. Вычислить массу азота, содержащегося в 1 кг:
1) калийной селитры KNO3;
2) аммиачной селитры Nh5NO3;
3) аммофоса (Nh5)2HP04.
4.7. К раствору, содержащему 10 г h3SO4, прибавили 9 г NaOH. Какое из веществ останется после реакции в избытке?
4.8. Раствор, содержащий 34,0 г AgNO3, смешивают с раствором, содержащим такую же массу NaCl. Весь ли нитрат серебра вступит в реакцию? Сколько граммов AgCl получилось в результате реакции?
4.9. К раствору, содержащему 0,20 моля FeCl3, прибавили 0,24 моля NaOH. Сколько молей Fe(OH)3 образовалось в результате реакции и сколько молей FeCl3 осталось в растворе?
4.10. Сколько граммов NaCl можно получить из 265 г Na,CO3?
4.11. Смешали 7,3 г НС1 и 4,0 г Nh4. Сколько граммов Nh5C1 образуется? Найти массу оставшегося после реакции газа.
4.12. К раствору, содержащему 6,8 г А1С13, прилили раствор, содержащий 5,0 г КОН. Найти массу образовавшегося осадка.
4.13. При разложении СаСО3 выделилось 11,2 л СО2. Чему равна масса КОН, необходимая для связывания выделившегося газа в карбонат?
4.14. Вычислить отношение масс элементов в оксиде железа Fe2O3.
4.15. Вычислить массовые доли (в %) элементов в оксиде меди СuО.
4.16. Вывести формулу соединения, в котором массовые доли составляют: 1,58 % водорода, 22,22 % азота и 76,20 % кислорода.
4.17. Соединение состоит из 42,07 % натрия, 18,91 % фосфора и 39,02 % кислорода. Вывести его формулу.
4.18. Массовые доли магния, фосфора и кислорода в соли соответственно составляют 21,83, 27,85 и 50,32 %. Вывести формулу соли.
4.19. При обезвоживании 4,3 г кристаллической соды Na2CO3*xh3O осталось 1,6 г вещества. Вывести формулу кристаллогидрата.
4.20. При соединении 6,2 г фосфора с кислородом получено 5,19 г оксида фосфора. Вывести его формулу.
4.21. Найдите формулу соединения, имеющего состав: калия 26,53%, хрома 35,37%, кислорода 38,10%.
4.22. Основной рудой, из которой получают хром, является хромистый железняк, в котором хром находится в трёхвалентном, а железо – в двухвалентном состоянии. Процентный состав хромистого железняка следующий: Fe - 25%, Cr - 46,43%, O -28,57%. Напишите формулу хлористого железняка в виде произведения оксидов.
4.23. Состав азотного удобрения следующий; С – 20,00%, О – 26,67%, N - 46,67%, Н – 6,67%. Выведите формулу этого удобрения.
4.24. Cостав слюды мусковит следующий: К – 9,80%, Н – 0,50%, Al - 20,35%, Si - 21,11%, О – 48,24%. Найдите формулу мусковита. Напишите формулу этого минерала в виде произведения оксидов.
4.25. При сварке и резке металлов в качеств флюса применяется соединение бора следующего состава: Н – 4,84%, В -17,74%, О – 77,42%. Найдите формулу этого соединения. Как оно называется?
studfiles.net
как решать химические уравнения по химии 8 класс объясните пожалуйста
Составление уравнения химической реакцииПроцесс составления уравнения химической реакции состоит из двух стадий (этапов).
1. Составление схемы реакции. Схема показывает, какие вещества вступили во взаимодействие и какие получились в результате реакции. Надо помнить, что молекулы простых газообразных веществ почти всегда состоят из двух атомов (O2, Cl2, h3 и т. д.)
2. Подбор коэффициентов к формулам веществ. Необходимо подобрать коэффициенты так, чтобы число атомов каждого элемента в левой и правой частях было одинаково.
Правила подбора коэффициентов:
- если число атомов элемента в одной части схемы реакции четное, а в другой нечетное, то перед формулой с нечетным числом атомов надо поставить коэффициент 2, а затем уравнивать число всех атомов.
- расстановку коэффициентов следует начинать с наиболее сложного по составу вещества и делать это в следующей последовательности:
сначала надо уравнять число атомов металлов, затем – кислотных остатков (атомов неметаллов), затем атомов водорода, и последним – атомов кислорода.
- если число атомов кислорода в левой и правой частях уравнения одинаково, то коэффициенты определены верно.
- после этого стрелку между частями уравнения можно заменить знаком равенства.
- коэффициенты в уравнении химической реакции не должны иметь общих делителей.
Пример. Составим уравнение химической реакции между гидроксидом железа (III) и серной кислотой с образованием сульфата железа (III).
1. Составим схему реакции:
Fe(OH)3 + h3SO4 → Fe2(SO4)3 + h3O
2. Подберем коэффициенты к формулам веществ. Мы знаем, что надо начать с наиболее сложного вещества и последовательно уравнять во всей схеме сначала атомы металлов, потом кислотных остатков, затем водорода и в конце – кислорода. В нашей схеме наиболее сложное вещество - Fe2(SO4)3. В нем два атома железа, а в составе Fe(OH)3 – один атом железа. Значит, перед формулой Fe(OH)3 надо поставить коэффициент 2:
2Fe(OH)3 + h3SO4 → Fe2(SO4)3 + h3O
Теперь уравниваем число кислотных остатков SO4. В составе соли Fe2(SO4)3 – три кислотных остатка SO4. Значит, в левой части перед формулой h3SO4 ставим коэффициент 3:
2Fe(OH)3 + 3h3SO4 → Fe2(SO4)3 + h3O.
Теперь уравниваем число атомов водорода. В левой части схемы в гидроксиде железа 2Fe(OH)3 – 6 атомов водорода (2
· 3), в серной кислоте 3h3SO4 – тоже 6 атомов водорода. Всего в левой части 12 атомов водорода. Значит, в правой части перед формулой воды h3O ставим коэффициент 6 – и теперь в правой части тоже 12 атомов водорода:
2Fe(OH)3 + 3h3SO4 → Fe2(SO4)3 + 6h3O.
Осталось уравнять число атомов кислорода. Но делать это уже не надо, потому что в левой и правой частях схемы уже одинаковое число атомов кислорода – по 18 в каждой части. Это значит, что схема записана полностью, и мы можем стрелку заменить знаком равенства:
2Fe(OH)3 + 3h3SO4 = Fe2(SO4)3 + 6h3O.
otvet.mail.ru
Расчёты по химическим уравнениям
Методическая разработка урока (2 часа)
Расчёты по химическим уравнениям
Хапугина Полина Ивановна, учитель химии ГБОУ СОШ 277 Кировского района Санкт-Петербурга
Цели урока: Научить восьмиклассников производить расчёты по химическим уравнениям: находить количество, массу и объём продуктов реакции по количеству, объёму и массе исходных веществ.
Ход урока:
Прежде чем перейти к изучению новой темы нам необходимо вспомнить уже известные вам величины и формулы. Вспомнить типы химических реакций. А также вы уже умеете составлять химические уравнения и уравнивать их. Давайте проверим ваши знания, для этого выполним следующий тест на оценку. (содержание теста можно посмотреть на моём личном сайте в папке файлы и фотографии )
Объяснение учителя:
1. Прежде чем научиться производить расчёты по химическим уравнениям необходимо ещё раз вспомнить уже известные нам формулы нахождения количество вещества, массы и объёма веществ, за одно вы сможете проверить себя, после выполненной вами работы. Для этого обратимся к следующей презентации, которая поможет восстановить наши знания в памяти. Презентация №1. (презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии)
Запишите уже известные вам формулы в тетрадь:
n– количество вещества (моль)
m– масса вещества (г)
М – молярная масса (г/моль)
V– объём газа (л)
Vm- молярный объём = 22,4 л/моль
n = m/M ; m = n•M
n = V/Vm; V = n•Vm
2. Теперь, мы должны понять, что химическое уравнение показывает не только качественную (превращение веществ) сторону процесса, но также и количественную сторону его. Для этого обратимся к следующей Презентации№2(презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии)
Запишите в тетрадь:
Коэффициент в уравнении реакции указывает на число частиц, а число частиц в свою очередь определяет количество молей!
2Н₂ + О₂ = 2Н₂О
Число частиц 2 молекулы 1 молекул 2 молекулы
Количество ↓ ↓ ↓
вещества, n 2 моль 1 моль 2 моль
2Fe(OH)3 = Fe2O3 + 3h3O
↓ ↓ ↓
n= 2моль 1моль 3моль
3. Следующий этап, который мы должны разобрать – это умение составлять по уравнению реакции пропорцию, а также решить её. Для этого обратимся к следующей Презентации 3. (презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии)
Запишите в тетрадь:
Известно по условию: 2 моль Х моль (числитель)
4P + 5O₂ = 2P₂O₅
Известно по уравнению: 4 моль 5 моль 2 моль (знаменатель)
Составим и решим пропорцию:
2 моль Х моль
_______ = _______
4 моль 2 моль
Х моль = 2 моль • 2 моль = 1 моль
4 моль
Х = n(P₂O₅)= 1 моль
4. Переходим к решению задач с использованием уравнений химических реакций.Для того чтобы решить расчетную задачу по химии, необходимо воспользоваться следующим алгоритмом – сделать пять шагов. Презентация 4. (презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии) Учебник стр. 101
В тетрадь:
Учащимся раздаётся уже готовый алгоритм решения, для вклейки в тетрадь.
Алгоритм решения расчётных задач с использованием уравнением химических реакций:
1. Составить уравнение химической реакции(т.е. обязательно – расставить коэффициенты!)
2. Над соответствующими формулами в уравнении записать количественные данные о веществах с единицами измерения, которые известны или их можно рассчитать, исходя из условия задачи, и искомую величину Х также с единицами измерения.
3. Под этими формулами записать соответствующие количественные величины, задаваемые самим уравнением, также с единицами измерения.
4. Составить и решить пропорцию.
5. Оформить ответ.
5. Решим задачу.
Рассчитайте массу воды, которая образуется в результате взаимодействия 0,5 моль оксида алюминия с серной кислотой при нагревании.
- Прочитайте задачу.
- Запишите условие задачи. ( Дано, найти.)
- Далее решаем задачу согласно, имеющемуся у вас алгоритму.
В тетрадь: (учащиеся записывают решение под объяснения учителя согласно Презентации 5) (презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии)
Дано:
n(Al₂O₃)=0,5 моль
_________________
Найти:
m(H₂O) - ?
Решение:
n=0,5 моль Х моль
Al₂O₃+3H₂SO₄=Al₂(SO₄)₃+3H₂O
n= 1 моль 3 моль
М = 102 г/моль 18 г/моль
Расчет молекулярной массы:
Мr(Al₂O₃)= 2•27+3•16= 54+48=102
Мr(H₂O)= 2•1+16=18
Составить и решить пропорцию.
0,5 моль = Х моль
1 моль 3 моль
Х моль = n(H₂O) = 0,5 моль • 3 моль = 1,5 моль
1 моль
Найдём массу воды.
m(H₂O) = n(H₂O) • M(H₂O)
m(H₂O) = 1,5 моль•18 г/моль = 27 г
Ответ:m(H₂O)=27 г
6. Решите задачи самостоятельно.
Два учащихся вызываются к доске, для решения на оценку.
1. Определите объѐм хлора (н.у.), необходимый для получения 634 г хлорида алюминия по уравнению: 2Al + 3Cl2= 2AlCl3. Ответ: 159, 6 л
2. Рассчитайте количество вещества и массу лития, необходимого для реакции с кислородом массой 128 г по уравнению: 4Li + O2= 2Li2O Ответ: 16 моль, 112 г
7. Домашнее задание.
§28, упр 3.
Задача.
Найти массу оксида цинка, который образуется при взаимодействии 13г цинка с кислородом.
ext.spb.ru


 Vm = 22,4 л/моль (н.у.)
Vm = 22,4 л/моль (н.у.)