Катализ и катализаторы. Катализатор в химии
Катализатор Википедия
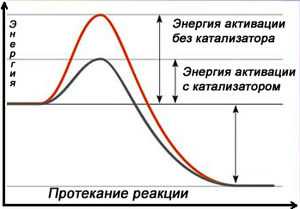 Схема протекания реакции с катализатором
Схема протекания реакции с катализатором Катализа́тор — химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции.
Противоположное понятие — ингибитор.
Катализаторы в химии[ | код]
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества[1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO[1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции[2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня[2].
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях[ | код]
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[4]
См. также[ | код]
ru-wiki.ru
Катализатор Википедия
 Схема протекания реакции с катализатором
Схема протекания реакции с катализатором Катализа́тор — химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции.
Противоположное понятие — ингибитор.
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества[1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO[1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции[2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня[2].
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[4]
См. также
Примечания
- ↑ 1 2 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ 1 2 Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано 25 августа 2011 года.
Ссылки
wikiredia.ru
Что такое катализаторы? Химия на практике
Любознательным на заметку
Рубрика: Любознательным на заметкуСто тридцать лет назад знаменитый шведский химик Берцелиус впервые описал «чудодейственные» вещества и дал им имя — катализаторы. Ничтожное их количество ускоряло химическую реакцию во много раз, а сами они выходили из реакции нетронутыми. И все же Берцелиус не был первооткрывателем катализа. За много столетий до создания основ химии в чанах созревал сыр, бродило вино, подымалось тесто. Ни один из этих процессов не прошел бы без биологических катализаторов — ферментов. Без них немыслимы и жизненные процессы в организмах.
При окислении органических соединений в клетке могут образоваться перекиси, обладающие большой разрушительной силой.
Природный катализатор — фермент каталаза — встает на защиту клетки. Попробуйте взять аптечную (трехпроцентную) перекись водорода и бросить в нее кусочек сырого картофеля, моркови или мяса. Сразу же начнется бурное разложение перекиси с выделением кислорода, Это сработала каталаза. Она присутствует в живой клетке в ничтожном количестве, но зато одна только молекула каталазы может разрушить за секунду свыше ста тысяч молекул перекиси. С вареным картофелем этого опыта не проделаешь. Каталаза — белковый катализатор и при нагреве теряет свои свойства.
Алхимики в поисках философского камня нашли немало веществ, помогающих превратить одно вещество в другое. Некоторыми из найденных ими катализаторов пользуются и поныне. Еще в VIII веке арабский алхимик Джабир ибн-Хайян, действуя на спирт серной кислотой, сумел получить из него эфир. До наших дней дошло название этого эфира — серный, хотя в его молекуле нет ни единого атома серы. Кислота в этой реакции не расходуется, она является лишь катализатором. Серный эфир и сейчас часто используют в медицине. Попробуйте воспроизвести реакцию, открытую больше тысячи лет назад.
Добавьте к 3 см3 спирта немного песку и около 2 см3 катализатора — концентрированной серной кислоты. Скоро почувствуется характерный запах эфира. Если поджечь его пары, они загорятся бледно-голубым пламенем.
Смешав немного спирта с равным количеством уксусной эссенции и добавив несколько капель серной кислоты при осторожном нагревании, получим другой эфир — уксусноэтиловый, известный под названием «туалетный уксус». И здесь серная кислота играет роль катализатора.
Одна из теорий, объясняющих явление катализа, предполагает образование промежуточных соединений с катализатором, которые намного активнее исходных веществ. Иногда даже удастся наблюдать эти соединения. Попробуйте проделать такой опыт.
Налейте в стакан насыщенный раствор катализатора — хромата или бихромата калия (хромпика), нагрейте его до 50—60° и добавьте несколько капель пергидроля (30% перекиси водорода). Если не найдете пергидроля, то его вполне заменят 3—4 см3 аптечной перекиси водорода. Желтый прозрачный раствор калиевой соли через минуту потемнеет: его окрасит сложное промежуточное соединение, которое, впрочем, тут же начнет быстро разлагаться с выделениеv кислорода. При этом жидкость в стакане вновь станет ярко-желтой, и в ней не останется даже следов перекиси. В большинстве других реакций промежуточные соединения существуют лишь доли секунды, и простым наблюдением их заметить нельзя.
На практике часто применяют целые комплексы катализаторов. Так, например, при получении аммиака из азота и водорода реакция идет намного интенсивнее, если к основному катализатору — железу — добавить немного окислов алюминия и калия. Преимущество двух катализаторов перед одним можно легко проверить на опыте с разложением хлорной извести.
В полстакана холодной воды насыпьте 15—20 г хлорной извести, тщательно размешайте. Раствор желательно отфильтровать через промокательную бумагу. После этого нагрейте раствор примерно до 50° и разлейте в три маленьких сосуда. В первый сосуд добавьте до 5 см3 разбавленного раствора медного купороса, во второй — столько же раствора железного купороса, а в сосуд третий — смесь этих растворов (по 2—2,5 см3). Через несколько минут вы убедитесь в том, что в третьем сосуде кислород будет выделяться в изобилии, а в первых двух — намного меньше. Если взять для реакции узкогорлые сосуды (маленькие колбочки) и заполнить их раствором хлорной извести почти доверху, то выделяющийся кислород можно опознать по вспыхиванию тлеющей лучинки, поднесенной к горлышку сосуда. Впрочем, лучинка вспыхнет только у колбы со смесью катализаторов; в других колбах она только слегка накалится.
Каталитические процессы широко распространены в химии высокомолекулярных соединений. Большинство полимеров получают из исходных мономеров с помощью катализаторов. Один из хорошо известных процессов полимеризации — образование на воздухе масляной пленки — ускоряется катализаторами, которые называют сиккативами. Сиккативы — как правило, соли органических кислот — способствуют взаимодействию высыхающего масла с кислородом воздуха и, как следствие этого, образованию нерастворимого полимера. Обычная олифа — это масло с сиккативом. Можно попытаться самим приготовить олифу и на опыте проверить действие сиккатива.
Сначала приготовьте сиккатив — плавленый резинат. Его готовят из канифоли, нагретой в фарфоровом стакане до 220—250°. Добавив в расплав 5 г негашеной извести, вы получите резинат кальция. Если вместо извести взять 15 г глета, растертого в пасту с льняным маслом, получится резинат свинца. Глет нужно вводить небольшими порциями. Нагрев реагентов проводите до получения однородной массы; ее капля должна казаться на стекле прозрачной.
Когда катализатор готов, его вводят в прогретое до 150—200° льняное или конопляное, лучше рафинированное, масло. На 100 частей масла возьмите 3—5 частей сиккатива, размешивайте смесь до полного его растворения. Полученную олифу нанесите тонким слоем на стекло или металл и рядом нанесите пленку чистого масла, Вы легко обнаружите, насколько сиккатив ускоряет высыхание масла.
Не все катализаторы ускоряют химические процессы. Существуют — и часто применяются —отрицательные катализаторы, ингибиторы, тормозящие те или иные реакции.
Особенно интересны ингибиторы коррозии, защищающие металл от разрушения. Некоторые органические соединения класса аминов препятствуют коррозии железа в кислой среде. Растворите несколько таблеток уротропина (его химическое название гексаметилентетрамин) в растворе соляной кислоты. Погрузите в полученный раствор железный гвоздь, а другой гвоздь для сравнения опустите в обычную соляную кислоту. По выделению пузырьков водорода можно легко заметить, где быстрее идет реакция. Защитными свойствами аминов часто пользуются при травлении металлов, когда нужно снять с поверхности слой окисла, но не затронуть деталь. Ингибиторы не препятствуют кислоте разъедать окисную пленку, но не подпускают кислоту к самому металлу.
О. Либкин.
| Числовые суеверия → |
Похожие публикации:
Источники ошибок при сварке Сварку необходимо изучать. Может пройти много времени, пока ученик будет в состоянии заварить качественный сварной шов. Самые первые хорошие сварные швы обычно являются просто совпадением. Помогает лишь постоянная практика. И в процессе обучения без ошибок не обойтись, но важно верить, что человеку все подвластно, вспомнив пословицу "Не боги горшки обжигают". В нашей статье мы расскажем о наиболее распространенных ош...
Подарки в нашей жизни. Что нельзя дарить и почему? Праздники – это настоящее украшение нашей жизни. Без них она казалась бы серой, скучной и однообразной. А какой праздник обходится без подарков? Будь то юбилей либо просто день рождения, годовщина свадьбы или Новый год, Рождество или Пасха – в эти и другие знаменательные дни, что называется, сам бог велел радовать наших родных, близких, друзей и коллег памятными презентами. Даже если виновник торжества словно отнеки...
А вы знаете, какого цвета любовь? Какие цветы дарить на свадьбу… В каждом цветке есть что-то таинственное, загадочное и волшебное. Нежные и хрупкие лепестки, которые так легко ломаются и облетают, но могут пробиться даже сквозь толщу асфальта. Притягательный завораживающий аромат, который без видимых причин нравится одним, но вызывает полнейшее отторжение у других. Оттенки и краски, которые могут символизировать одновременно и радость, и беду. ...
О грибах начинающему грибнику: как собирать и готовить грибы? Главное правило грибников Грибы - загадка природы, ее щедрый дар и полезный питательный продукт. Вдаваться в биологические подробности, природу и суть грибов, а также во все их разновидности мы не будем, поговорим лишь о тех, что растут в лесу и время от времени появляются на нашем столе, и о тех, что на них очень похожи, но не являются съедобными. Грибной сезон на территории России длится с мая по ноябрь, а в ...
Вербное воскресенье: традиции и обычаи За неделю до Светлого Пасхального воскресенья православные христиане украшают свой дом веточками вербы, ветлы, ивы в знак памяти о пальмовых ветвях, которыми был устлан путь Христа, входящего в Иерусалим. Издавна этот день на Руси носит название Вербного воскресенья. На столах главенствовали праздничные пироги – рыбники, а в сибирских городах и деревнях – икра. Несмотря на то, что праздник приходится на последнюю не...
Поделиться ссылкой:www.xn--80acabqu3b5cza.xn--p1ai
Катализатор — Википедия
 Схема протекания реакции с катализатором
Схема протекания реакции с катализатором Катализа́тор — химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции.
Противоположное понятие — ингибитор.
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества[1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO[1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции[2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня[2].
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Видео по теме
Катализаторы в автомобилях
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[4]
См. также
Примечания
- ↑ 1 2 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ 1 2 Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано 25 августа 2011 года.
Ссылки
wikipedia.green
Катализатор
Химия - Катализатор
01 марта 2011Оглавление:1. Катализатор2. Катализаторы в автомобилях
Схема протекания реакции с катализатором
химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. Количество катализатора, в отличие от других реагентов, после реакции не изменяется. Важно понимать, что катализатор участвует в реакции. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества . Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO .
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе.
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения. В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла. Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции . Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня.
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Просмотров: 2829
| Каталитическая грелка |
4108.ru
Катализаторы (в химии) - «Энциклопедия»
КАТАЛИЗАТОРЫ, функциональные материалы и вещества, ускоряющие или инициирующие химические реакции за счёт промежуточных химических взаимодействий с участниками реакции и восстановления своего химического состава после каждого цикла таких промежуточных взаимодействий (смотри в статье Катализ). По способу организации и фазовому составу реакционной системы принято различать гетерогенные и гомогенные катализаторы, а также катализаторы биологического происхождения - ферменты. В гетерогенном катализе катализаторы иногда называют контактами.
В общем случае носителем каталитической активности катализаторов (смотри в статьях Гетерогенный катализ, Гомогенный катализ) обычно является вещество, непосредственно вступающее в химическое взаимодействие, по крайней мере, с одним из исходных реагентов с образованием нестойких (в условиях проведения каталитической реакции) химических соединений, - активный компонент катализатора (для твёрдых гетерогенных катализаторов часто каталитическая активная фаза). Механизмы действия катализаторов достаточно разнообразны и зависят от типа осуществляемой каталитической реакции и природы вещества активного компонента катализатора; химическая природа активного компонента катализаторов также может быть самой разнообразной. Массовая доля активного компонента в катализаторах может варьировать от 100% до весьма малых величин (десятые доли процента).
Реклама
Основными характеристиками катализаторов являются каталитическая активность, селективность по отношению к целевым продуктам каталитических превращений, специфичность по отношению к реагентам каталитических реакций, стабильность, устойчивость к действию каталитических ядов; для промышленных катализаторов ещё и производительность (количество целевого продукта, полученного за единицу времени на единицу объёма или массы катализатора).
Обычно катализаторы подразделяют по типам каталитических процессов: глубокого и парциального (селективного) окисления, гидрирования, полимеризации, процессов нефтепереработки, органического синтеза и др. Типичными катализаторами окислительно-восстановительных реакций (окисления, гидрирования и пр.) являются переходные элементы в металлическом виде, а также их соли, комплексные соединения, оксиды и сульфиды. Типичными катализаторами кислотно-основных реакций (гидратации, дегидратации, алкилирования, полимеризации, крекинга и пр.) являются жидкие и твёрдые минеральные и органические кислоты и основания, кислые соли, алюмосиликаты, цеолиты и др.
В промышленности предпочитают использовать твёрдые гетерогенные катализаторы вследствие лёгкости их отделения от реакционной среды и возможности работы при повышенных температурах. Активный компонент (каталитически активная фаза) многих промышленных гетерогенных катализаторов является высокодисперсным и нередко нанесённым на прочный пористый носитель (обычно высокопористый углерод, оксид непереходного элемента, например, кремния, алюминия, титана, циркония, и др.). Для увеличения каталитической активности, селективности, химической устойчивости и термостабильности в катализаторы иногда вводят небольшое количество промотора (или активатора) - вещества, которое может не обладать самостоятельной каталитической активностью.
Твёрдые промышленные катализаторы должны обладать высокими каталитической активностью, специфичностью по отношению к заданной реакции, селективностью по отношению к целевому продукту, механической прочностью, термостойкостью, определённой теплопроводностью. Промышленные катализаторы должны быть также стойкими по отношению к дезактивации - снижению или полному подавлению их каталитической активности. Дезактивация катализаторов может происходить за счёт спекания или механического разрушения (например, истирания) активного компонента и/или вещества носителя, блокировки активных центров побочными продуктами процесса - плотными углеродными отложениями (коксом), смолистыми веществами и пр., отравления каталитическими ядами. Действие каталитических ядов обычно обусловлено блокировкой наиболее активных участков активного компонента катализаторов за счёт прочной хемосорбции и поэтому проявляется даже при наличии малых количеств ядов. Типичными каталитическими ядами являются соединения серы, азота, фосфора, мышьяка, свинца, ртути, цианистые соединения, кислород, монооксид углерода, производные ацетилена, иногда вода и др. В промышленности для предотвращения отравления катализаторов производят глубокую предварительную очистку реагирующих веществ от каталитических ядов. В промышленных каталитических процессах для восстановления каталитической активности катализаторы после их дезактивации регенерируют. Регенерацию катализаторов осуществляют, например, выжиганием кокса и смолистых веществ, промыванием водой или специально подобранными растворителями.
Каталитическая активность твёрдого катализатора зависит от величины и состояния доступной для реагентов поверхности катализатора, формы, размера и профиля пор катализатора (то есть его текстуры), что определяется способом приготовления катализатора и его предварительной обработкой. В условиях отсутствия диффузионных ограничений активность твёрдого катализатора прямо пропорциональна такой поверхности. Поэтому большинство промышленных гетерогенных катализаторов имеет развитую удельную поверхность, вплоть до нескольких сотен м2 на 1 г катализатора. Наиболее распространёнными методами получения активных твёрдых катализаторов являются осаждение гидроксидов и карбонатов металлов из растворов солей или комплексных соединений с последующим термическим разложением осадка до оксидов, разложение иных соединений на воздухе до оксидов, сплавление нескольких веществ с последующим выщелачиванием одного из них (так называемые сплавные, или «скелетные», катализаторы), а также нанесение активного компонента катализатора на носитель методом пропитки или из газовой фазы с последующей активацией катализатора. Типичными процедурами активации катализаторов являются их восстановление водородом, сульфидирование с помощью различных серосодержащих соединений и т.п.; для некоторых типов катализаторов используется термоактивация, осуществляемая с помощью прогрева катализатора до температуры формирования активной фазы. Механически прочные катализаторы изготавливают в виде прессованных таблеток, а также полученных специальными методами гранул, шариков, сплошных и полых цилиндров (колец Рашига), различного рода экструдатов и пр. В ряде случаев для снижения аэро- или гидродинамического сопротивления слоя катализаторов им придают и более специфические формы. Например, каталитические нейтрализаторы автомобильных выхлопов обычно изготавливают в виде керамических или металлических «сотовых» блоков со множеством параллельных каналов вдоль потока очищаемого газа. В промышленности применяют также суспензии катализаторов в жидкой фазе (суспензионный процесс) и пылевидные катализаторы, которые в ходе реакции оказываются взвешенными в парах компонентов реакции (так называемый флюид-процесс).
Стоимость катализатора зависит от его химического состава, способа приготовления и варьирует от 0,5 до нескольких тысяч долларов США за 1 кг катализатора. Тем не менее, в стоимости готовой продукции, полученной с помощью промышленных катализаторов, стоимость катализатора обычно составляет не более 0,1-1%.
Промышленные гетерогенные катализаторы являются мало- или среднетоннажной продукцией. Общий объём их годового потребления в России около 100 тысяч тонн.
Литературу смотри при статье Катализ.
В. Н. Пармон.
knowledge.su
Катализ и катализаторы - Энциклопедия wiki.MPlast.by
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов — веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = h3+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
Например, реакция:
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
Автор: Метельский А.ВИсточник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 годДата в источнике: 1999 год
mplast.by