Таблица валентностей химических элементов. Рассмотрите таблицу 7 какие металлы обладают постоянной валентностью
Ответы@Mail.Ru: Расскажите всё о валентности: как найти, сотавить формулы.
Вале́нтность (от лат. valēns «имеющий силу» ) — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов. Рассматривая формулы различных соединений, нетрудно заметить, что число атомов одного и того же элемента в молекулах различных веществ не одинаково. Например, HCl, Nh5Cl, h3S, h4PO4 и т. д. Число атомов водорода в этих соединениях изменяется от 1 до 4. Это характерно не только для водорода. Как же угадать, какой индекс поставить рядом с обозначением химического элемента? Как составляются формулы вещества? Это легко сделать, когда знаешь валентность элементов, входящих в состав молекулы данного вещества. Валентность – это свойство атома данного элемента присоединять, удерживать или замещать в химических реакциях определённое количество атомов другого элемента. За единицу валентности принята валентность атома водорода. Поэтому иногда определение валентности формулируют так: валентность – это свойство атома данного элемента присоединять или замещать определённое количество атомов водорода. Если к одному атому данного элемента прикрепляется один атом водорода, то элемент одновалентен, если два – двухвалентен и т. д. Водородные соединения известны не для всех элементов, но почти все элементы образуют соединения с кислородом О. Кислород считается постоянно двухвалентным. Постоянная валентность: I – H, Na, Li, K, Rb, Cs II – O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd III – B, Al, Ga, In Но как поступить в том случае, если элемент не соединяется с водородом? Тогда валентность необходимого элемента определяют по валентности известного элемента. Чаще всего её находят, используя валентность кислорода, потому что в соединениях его валентность всегда равно 2. Например, не составит труда найти валентность элементов в следующих соединениях: Na2O (валентность Na – 1, O – 2), Al2O3 (валентность Al – 3, O – 2). Химическую формулу данного вещества можно составить, только зная валентность элементов. Например, составить формулы таких соединений, как CaO, BaO, CO, просто, потому что число атомов в молекулах одинаково, так как валентности элементов равны. А если валентности разные? Когда мы действуем в таком случае? Необходимо запомнить следующее правило: в формуле любого химического соединения произведение валентности одного элемента на число его атомов в молекуле равно произведению валентности на число атомов другого элемента. Например, если известно, что валентность Mn в соединении равна 7, а O – 2, тогда формула соединения будет выглядеть так Mn2O7. Как же мы получили формулу? Рассмотрим алгоритм составления формул по валентности для состоящих из двух химических элементов. Существует правило, что число валентностей у одного химического элемента равно числу валентностей у другого. Рассмотрим на примере образования молекулы, состоящей из марганца и кислорода. Будем составлять в соответствии с алгоритмом: 1. Записываем рядом символы химических элементов: Mn O 2. Ставим над химическими элементами цифрами их валентности (валентность химического элемента можно найти в таблице периодической системы Менделева, у марганца – 7, у кислорода – 2. 3. Находим наименьшее общее кратное (наименьшее число, которое делится без остатка на 7 и на 2). Это число 14. Делим его на валентности элементов 14 : 7 = 2, 14 : 2 = 7, 2 и 7 будут индексами, соответственно у фосфора и кислорода. Подставляем индексы. Зная валентность одного химического элемента, следуя правилу: валентность одного элемента × число его атомов в молекуле = валентность другого элемента × число атомов этого (другого) элемента, можно определить валентность другого. Mn2O7 (7 · 2 = 2 · 7). х = 14, х = 7. Понятие о валентности было введено в химию до того, как стало известно строение атома. Сейчас установлено, что это свойство элемента связано с числом внешних электронов. Для многих элементов максимальная валентность вытекает из положения этих элементов в периодической системе.
Вале́нтность (от лат. valēns «имеющий силу» ) — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов. Рассматривая формулы различных соединений, нетрудно заметить, что число атомов одного и того же элемента в молекулах различных веществ не одинаково. Например, HCl, Nh5Cl, h3S, h4PO4 и т. д. Число атомов водорода в этих соединениях изменяется от 1 до 4. Это характерно не только для водорода. Как же угадать, какой индекс поставить рядом с обозначением химического элемента? Как составляются формулы вещества? Это легко сделать, когда знаешь валентность элементов, входящих в состав молекулы данного вещества. Валентность – это свойство атома данного элемента присоединять, удерживать или замещать в химических реакциях определённое количество атомов другого элемента. За единицу валентности принята валентность атома водорода. Поэтому иногда определение валентности формулируют так: валентность – это свойство атома данного элемента присоединять или замещать определённое количество атомов водорода. Если к одному атому данного элемента прикрепляется один атом водорода, то элемент одновалентен, если два – двухвалентен и т. д. Водородные соединения известны не для всех элементов, но почти все элементы образуют соединения с кислородом О. Кислород считается постоянно двухвалентным. Постоянная валентность: I – H, Na, Li, K, Rb, Cs II – O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd III – B, Al, Ga, In Но как поступить в том случае, если элемент не соединяется с водородом? Тогда валентность необходимого элемента определяют по валентности известного элемента. Чаще всего её находят, используя валентность кислорода, потому что в соединениях его валентность всегда равно 2. Например, не составит труда найти валентность элементов в следующих соединениях: Na2O (валентность Na – 1, O – 2), Al2O3 (валентность Al – 3, O – 2). Химическую формулу данного вещества можно составить, только зная валентность элементов. Например, составить формулы таких соединений, как CaO, BaO, CO, просто, потому что число атомов в молекулах одинаково, так как валентности элементов равны. А если валентности разные? Когда мы действуем в таком случае? Необходимо запомнить следующее правило: в формуле любого химического соединения произведение валентности одного элемента на число его атомов в молекуле равно произведению валентности на число атомов другого элемента. Например, если известно, что валентность Mn в соединении равна 7, а O – 2, тогда формула соединения будет выглядеть так Mn2O7. Как же мы получили формулу? Рассмотрим алгоритм составления формул по валентности для состоящих из двух химических элементов. Существует правило, что число валентностей у одного химического элемента равно числу валентностей у другого. Рассмотрим на примере образования молекулы, состоящей из марганца и кислорода. Будем составлять в соответствии с алгоритмом: 1. Записываем рядом символы химических элементов: Mn O 2. Ставим над химическими элементами цифрами их валентности (валентность химического элемента можно найти в таблице периодической системы Менделева, у марганца – 7, у кислорода – 2. 3. Находим наименьшее общее кратное (наименьшее число, которое делится без остатка на 7 и на 2). Это число 14. Делим его на валентности элементов 14 : 7 = 2, 14 : 2 = 7, 2 и 7 будут индексами, соответственно у фосфора и кислорода. Подставляем индексы. Зная валентность одного химического элемента, следуя правилу: валентность одного элемента × число его атомов в молекуле = валентность другого элемента × число атомов этого (другого) элемента, можно определить валентность другого. Mn2O7 (7 · 2 = 2 · 7). х = 14, х = 7. Понятие о валентности было введено в химию до того, как стало известно строение атома. Сейчас установлено, что это свойство
touch.otvet.mail.ru
Валентность | Учись легко
Валентность
23.11.2010 Автор: Т U
Валентность – способность элементов присоединять к себе другие элементы.
Говоря простым языком, это число, показывающее, сколько элементов может присоединить к себе определённый атом.
Ключевым моментом в химии является правильная запись формул соединений.
Существуют несколько правил, которые облегчают нам правильное составление формул.
- Валентность всех металлов главных подгрупп равна номеру группы:
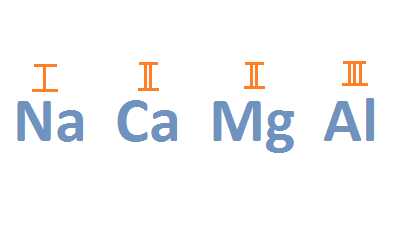

4schoolchild.wordpress.com
Как определить валентность? - Полезная информация для всех
Для того чтобы определить валентность того или иного вещества, вам нужно взглянуть на периодическую таблицу химических элементов Менделеева, обозначения римскими цифрами будут являться валентностями тех или иных веществ в этой таблице. К примеру, НО, водород (Н) будет всегда одновалентным а, а кислород (О) всегда двухвалентным. Вот ниже некая шпаргалка, которая как я полагаю поможет вам)

В первую очередь стоит отметить, что химические элементы могут иметь как постоянную, так и переменную валентность. Что касается постоянной валентности, то такие элементы вам просто напросто необходимо заучить
Итак:
Одновалентными считаются щелочные металлы, водород, а также галогены;
Двухвалентными принято считать щелочноземельные металлы, а также и кислород;
А вот трхвалентен бор и алюминий.
Итак, теперь давайте пройдмся по таблице Менделеева для определения валентности. Самая высокая валентность для элемента всегда приравнивается к его номеру группы
Низшая валентность же узнатся путм вычитания из 8 номера группы. Низшей валентностью наделены неметаллы в большей степени.
Химические элементы могут быть постоянной или переменной валентности. Элементы с постоянной валентностью необходимо выучить. Всегда
- одновалентны водород, галогены, щелочные металлы
- двухвалентны кислород, щелочноземельные металлы.
- трехвалентны алюминий (Al) и бор (B).
Валентность можно определить по таблице Менделеева. Высшая валентность элемента всегда равна номеру группы, в которой он находится.
Низшей переменной валентностью чаще всего обладают неметаллы. Чтобы узнать низшую валентность, из 8 вычитают номер группы - в результате будет искомая величина. Например, сера находится в 6 группе и е высшая валентность - VI, низшая валентность будет II (86=2).
Согласно школьному определению валентность это способность химического элемента образовывать то или иное количество химических связей с другими атомами.
Как известно, валентность бывает постоянной (когда химический элемент образует всегда одно и то же количество связей с другими атомами) и переменной (когда в зависимости от того или иного вещества валентность одного и того же элемента изменяется).
Определить валентность нам поможет периодическая система химических элементов Д. И. Менделеева.
Действуют такие правила:
1) Максимальная валентность химического элемента равняется номеру группы. Например, хлор находится в 7-й группе, а значит, у него максимальная валентность равна 7. Сера: она в 6-й группе, значит, у не максимальная валентность равна 6.
2) Минимальная валентность для неметаллов равна 8 минус номер группы. Например, минимальная валентность того же хлора равна 8 7, то есть 1.
Увы, из обоих правил имеются исключения.
Например, медь находится в 1-й группе, однако максимальная валентность меди равна не 1, а 2.
Кислород находится в 6-й группе, но у него валентность почти всегда 2, а вовсе не 6.
Полезно помнить ещ следующие правила:
3) Все щелочные металлы (металлы I группы, главной подгруппы) всегда имеют валентность 1. Например, валентность натрия всегда равна 1, потому что это щелочной металл.
4) Все щлочно-земельные металлы (металлы II группы, главной подгруппы) всегда имеют валентность 2. Например, валентность магния всегда равна 2, потому что это щлочно-земельный металл.
5) Алюминий всегда имеет валентность 3.
6) Водород всегда имеет валентность 1.
7) Кислород практически всегда имеет валентность 2.
8) Углерод практически всегда имеет валентность 4.
Следует помнить, что в разных источниках определения валентности могут отличаться.
Более или менее точно валентность можно определить как количество общих электронных пар, посредством которых данный атом связан с другими.
Согласно такому определению, валентность азота в HNO3 равна 4, а не 5. Пятивалентным азот быть не может, потому что в таком случае вокруг атома азота кружилось бы 10 электронов. А такого не может быть, потому что максимум электронов составляет 8.
Валентность любого химического элемента - это его свойство, а точнее свойство его атомов (атомов этого элемента) удерживать какое - то количество атомов, но уже другого хим - ого элемента.
Существуют Хим - ие элементы как с постоянной, так и с переменной валентностью, которая меняется в зависимости от того в соединение с каким элементом он (данный элемент) находится или же вступает.
Валентности некоторых химических элементов:
Перейдем теперь к тому, как же определяется валентность элемента по таблице.
Итак, валентность можно определить по таблице Менделеева:
- высшая валентность соответстует (равна) номеру группы;
- низшая же валентность определяется формулой: номер группы - 8.

Из школьного курса по химии мы знаем, что все химические элементы могут быть с постоянной или же переменной валентностью. Элементы у которых постоянная валентность нужно просто запомнить (например водород, кислород, щелочные металлы и другие элементы). Валентность легко определить по таблице Менделеева, которая есть в любом учебнике по химии. Высшая валентность соответствует своему номеру группы, в которой она расположена.
Валентность какого-либо элемента можно определить по самой таблице Менделеева, по номеру группы.
По крайней мере, так можно поступать в случае с металлами, ведь их валентность равна номеру группы.
С неметаллами немного другая история: их высшая валентность (в соединениях с кислородом) также равна номеру группы, а вот низшую валентность (в соединениях с водородом и металлами) нужно определять по следующей формуле: quot;8 - номер группыquot;.
Чем больше работаешь с химическими элементами, тем лучше запоминаешь и их валентность. А для начала хватит и такой quot;шпаргалкиquot;:

Розовым цветом выделены те элементы, чья валентность непостоянна.
Валетность- это способность атомов одних химических элементов присоединить к себе атомы других элементов. Для успешного написания формул, правильного решения задач необходимо хорошо знать , как определить валентность. Для начала нужно выучить все элементы с постоянной валентностью. Вот они: 1. Водород, галогены, щелочные металлы( всегда одновалентны) ; 2. Кислород и щелочноземельные металлы ( двухвалентны) ; 3. B и Al ( трехвалентны). Чтобы определить валентность по таблице Менделеева , нужно выяснить в какой группе стоит химический элемент и определить, находится он в основной группе или побочной.
Элемент может иметь одну или несколько валентностей.
Максимальная валентность элементов равна числу валентных электронов. Мы можем определить валентность, зная расположение элемента в периодической таблице. Максимальное число валентности равно номеру группы, в которой находится необходимый элемент.
Валентность обозначается римской цифрой и, как правило, пишется в правом верхнем углу символа элемента.
Некоторые элементы могут иметь разную валентность в разных соединениях.
Например, сера имеет следующие валентности:
- II в соединении h3S
- IV в соединении SO2
- VI в соединении SO3
Правила определения валентности не как просты в использовании, поэтомуих нужно запомнить.
Определять валентность по таблице Менделеева просто. Как правило она соответствует номеру группы в которой элемент расположен. Но есть элементы, которые в разных соединениях могут иметь разную валентность. В этом случае речь идет о постоянной и переменной валентности. Переменная может быть максимальной, равной номеру группы, а может быть минимальной или промежуточной.
Но гораздо интереснее определять валентность в соединениях. Для этого существует ряд правил. Прежде всего легко определить валентность элементов если один элемент в соединении обладает постоянной валентностью, например это кислород или водород. Слева ставится восстановитель, то есть элемент с положительной валентностью, справа - окислитель, то есть элемент с отрицательной валентностью. Индекс элемента с постоянной валентностью умножается на эту валентность и делится на индекс элемента с неизвестной валентностью.
Пример: оксиды кремния. Валентность кислорода -2. Найдем валентность кремния.
SiO 1*2/1=2 Валентность кремния в моноксиде равна +2.
SiO2 2*2/1=4 Валентность кремния в диоксиде равна +4.
info-4all.ru
Валентность. Как найти валентность. Элементы с постоянной валентностью
Валентность - это способность атома данного элемента образовывать определенное количество химических связей.
Образно говоря, валентность - это число "рук", которыми атом цепляется за другие атомы. Естественно, никаких "рук" у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность - это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить:
| Элементы | Постоянная валентность |
| щелочные металлы (Li, Na, K, Rb , Cs, Fr) | I |
| металлы II группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| алюминий (Al) | III |
| кислород (О) | II |
| фтор (F) | I |
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений: максимальная (и единственная) валентность фтора равна I (а не VII), кислорода - II (а не VI), азота - IV (способность азота проявлять валентность V - популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления - это не тождественные понятия.
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность - нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Делается это весьма просто. Запомните формальное правило: произведение числа атомов первого элемента в молекуле на его валентность должно быть равно аналогичному произведению для второго элемента.
В соединении AxBy: валентность (А) • x = валентность (В) • y
Пример 1. Найти валентности всех элементов в соединении Nh4.
Решение. Валентность водорода нам известна - она постоянна и равна I. Умножаем валентность Н на число атомов водорода в молекуле аммиака: 1 • 3 = 3. Следовательно, для азота произведение 1 (число атомов N) на X (валентность азота) также должно быть равно 3. Очевидно, что Х = 3. Ответ: N(III), H(I).
Пример 2. Найти валентности всех элементов в молекуле Cl2O5.
Решение. У кислорода валентность постоянна (II), в молекуле данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора = Х. Составляем уравнение: 5 • 2 = 2 • Х. Очевидно, что Х = 5. Ответ: Cl(V), O(II).
Пример 3. Найти валентность хлора в молекуле SCl2, если известно, что валентность серы равна II.
Решение. Если бы авторы задачи не сообщили нам валентность серы, решить ее было бы невозможно. И S, и Cl - элементы с переменной валентностью. С учетом дополнительной информации, решение строится по схеме примеров 1 и 2. Ответ: Cl(I).
Зная валентности двух элементов, можно составить формулу бинарного соединения.
В примерах 1 - 3 мы по формуле определяли валентность, попробуем теперь проделать обратную процедуру.
Пример 4. Составьте формулу соединения кальция с водородом.
Решение. Валентности кальция и водорода известны - II и I соответственно. Пусть формула искомого соединения - CaxHy. Вновь составляем известное уравнение: 2 • x = 1 • у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: Cah3.
"А почему именно Cah3? - спросите вы. - Ведь варианты Ca2h5 и Ca4H8 и даже Ca10h30 не противоречат нашему правилу!"
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
"Значит, соединения типа N2O4 или C6H6 невозможны? - спросите вы. - Следует заменить эти формулы на NO2 и CH?"
Нет, возможны. Более того, N2O4 и NO2 - это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (в отличие от С6Н6).
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Пример 5. Составьте формулу соединения серы с фтором, если известно, что валентность серы равна шести.
Решение. Пусть формула соединения - SxFy. Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем уравнение: 6 • x = 1 • y. Несложно понять, что наименьшие возможные значения переменных - это 1 и 6. Ответ: SF6.
Вот, собственно, и все основные моменты.
А теперь проверьте себя! Предлагаю пройти небольшой тест по теме "Валентность".
Хотите узнать, почему "классическое" определение валентности часто не "работает"? Почему валентность железа в FeO не равна двум? Почему для описания комплексных веществ используется понятие "координационное число"?
Смотрите продолжение этой статьи →
www.repetitor2000.ru
Как определить валентность?
Валентностью называется способность атомов одних химических элементов присоединять к себе точное число атомов других элементов или атомные группы. Благодаря этому понятию мы можем узнать, сколько атомов каждого элемента входят в состав молекулы, а также составить ее графическую формулу. Поэтому для успешного написания формул, уравнений реакций, а также для правильного решения задач важно хорошо знать, как определить валентность элемента.
Химические элементы могут иметь постоянную или переменную валентность. Необходимо выучить наизусть все элементы с постоянной валентностью. Вот их список:
- Водород, галогены и щелочные металлы всегда одновалентны.
- Валентность, равную двум, всегда проявляют кислород и щелочноземельные металлы.
- Всегда трехвалентны B и Al.
Как определить валентность по таблице Менделеева
Если вы по каким-либо причинам, ну например, разволновавшись на экзамене, забыли этот список, можно определить валентность по таблице Менделеева. Для этого нужно выяснить, в какой группе стоит интересующий нас химический элемент, т.е. узнать номер группы, а также определить, находится он в основной или в побочной группе. Высшая валентность всегда равна номеру группы.
Для определения низшей переменной валентности, которой чаще всего обладают неметаллы, необходимо из 8 вычесть номер группы. Полученный результат и будет искомой величиной.
Чтобы стало более понятно, как определить валентность по таблице Менделеева, приведем несколько примеров:
- Все щелочные металлы входят в главную подгруппу первой группы и имеют постоянную валентность – I.
- Для щелочноземельных металлов (главная подгруппа второй группы) валентность соответственно будет равна II.
- Большинство неметаллов имеют переменную валентность. Высшая степень их валентности равна номеру группы, а низшая определяется, как уже писалось выше. Возьмем к примеру серу. Т.к. этот элемент расположен в 6 группе – его высшая валентность равна VI, а низшая – II ( 8 – 6 = 2).
- В отличие от всех остальных неметаллов галогены, входящие в основную подгруппу восьмой группы, о
elhow.ru
Как Определить Валентность?
Согласно школьному определению валентность — это способность химического элемента образовывать то или иное количество химических связей с другими атомами. Как известно, валентность бывает постоянной (когда химический элемент образует всегда одно и то же количество связей с другими атомами) и переменной (когда в зависимости от того или иного вещества валентность одного и того же элемента изменяется). Определить валентность нам поможет периодическая система химических элементов Д. И. Менделеева. Действуют такие правила: 1) Максимальная валентность химического элемента равняется номеру группы. Например, хлор находится в 7-й группе, а значит, у него максимальная валентность равна 7. Сера: она в 6-й группе, значит, у неё максимальная валентность равна 6. 2) Минимальная валентность для неметаллов равна 8 минус номер группы. Например, минимальная валентность того же хлора равна 8 – 7, то есть 1. Увы, из обоих правил имеются исключения. Например, медь находится в 1-й группе, однако максимальная валентность меди равна не 1, а 2. Кислород находится в 6-й группе, но у него валентность почти всегда 2, а вовсе не 6. Полезно помнить ещё следующие правила: 3) Все щелочные металлы (металлы I группы, главной подгруппы) всегда имеют валентность 1. Например, валентность натрия всегда равна 1, потому что это щелочной металл. 4) Все щёлочно-земельные металлы (металлы II группы, главной подгруппы) всегда имеют валентность 2. Например, валентность магния всегда равна 2, потому что это щёлочно-земельный металл. 5) Алюминий всегда имеет валентность 3. 6) Водород всегда имеет валентность 1. 7) Кислород практически всегда имеет валентность 2. 8) Углерод практически всегда имеет валентность 4. Следует помнить, что в разных источниках определения валентности могут отличаться. Более или менее точно валентность можно определить как количество общих электронных пар, посредством которых данный атом связан с другими. Согласно такому определению, валентность азота в HNO3 равна 4, а не 5. Пятивалентным азот быть не может, потому что в таком случае вокруг атома азота кружилось бы 10 электронов. А такого не может быть, потому что максимум электронов составляет 8.
otvet.expert
| ПОЛЕЗНЫЕ ССЫЛКИ: БОНУСЫ ИНЖЕНЕРАМ!: МЫ В СОЦ.СЕТЯХ: | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Таблица валентностей химических элементов.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
tehtab.ru











