Как составить химическое уравнение: правила, примеры. Запись химической реакции. Составьте уравнение химической реакции
правила, примеры. Запись химической реакции
Поговорим о том, как составить химическое уравнение, ведь именно они являются основными элементами данной дисциплины. Благодаря глубокому осознанию всех закономерностей взаимодействий химических процессов и веществ, можно управлять ими, применять их в различных сферах деятельности.
Теоретические особенности
Составление химических уравнений - важный и ответственный этап, рассматриваемый в восьмом классе общеобразовательных школ. Что должно предшествовать данному этапу? Прежде чем педагог расскажет своим воспитанникам о том, как составить химическое уравнение, важно познакомить школьников с термином «валентность», научить их определять данную величину у металлов и неметаллов, пользуясь таблицей элементов Менделеева.

Составление бинарных формул по валентности
Для того чтобы понять, как составить химическое уравнение по валентности, для начала нужно научиться составлять формулы соединений, состоящих из двух элементов, пользуясь валентностью. Предлагаем алгоритм, который поможет справиться с поставленной задачей. Например, необходимо составить формулу оксида натрия.
Сначала важно учесть, что тот химический элемент, который в названии упоминается последним, в формуле должен располагаться на первом месте. В нашем случае первым будет записываться в формуле натрий, вторым кислород. Напомним, что оксидами называют бинарные соединения, в которых последним (вторым) элементом обязательно должен быть кислород со степенью окисления -2 (валентностью 2). Далее по таблице Менделеева необходимо определить валентности каждого из двух элементов. Для этого используем определенные правила.
Так как натрий – металл, который располагается в главной подгруппе 1 группы, его валентность является неизменной величиной, она равна I.
Кислород - это неметалл, поскольку в оксиде он стоит последним, для определения его валентности мы из восьми (число групп) вычитаем 6 (группу, в которой находится кислород), получаем, что валентность кислорода равна II.
Между определенными валентностями находим наименьшее общее кратное, затем делим его на валентность каждого из элементов, получаем их индексы. Записываем готовую формулу Na2O.
Инструкция по составлению уравнения
А теперь подробнее поговорим о том, как составить химическое уравнение. Сначала рассмотрим теоретические моменты, затем перейдем к конкретным примерам. Итак, составление химических уравнений предполагает определенный порядок действий.
- 1-й этап. Прочитав предложенное задание, необходимо определить, какие именно химические вещества должны присутствовать в левой части уравнения. Между исходными компонентами ставится знак «+».
- 2-й этап. После знака равенства необходимо составить формулу продукта реакции. При выполнении подобных действий потребуется алгоритм составления формул бинарных соединений, рассмотренный нами выше.
- 3-й этап. Проверяем количество атомов каждого элемента до и после химического взаимодействия, в случае необходимости ставим дополнительные коэффициенты перед формулами.
Пример реакции горения
Попробуем разобраться в том, как составить химическое уравнение горения магния, пользуясь алгоритмом. В левой части уравнения записываем через сумму магний и кислород. Не забываем о том, что кислород является двухатомной молекулой, поэтому у него необходимо поставить индекс 2. После знака равенства составляем формулу получаемого после реакции продукта. Им будет оксид магния, в котором первым записан магний, а вторым в формуле поставим кислород. Далее по таблице химических элементов определяем валентности. Магний, находящийся во 2 группе (главной подгруппе), имеет постоянную валентность II, у кислорода путем вычитания 8 - 6 также получаем валентность II.
Запись процесса будет иметь вид: Mg+O2=MgO.
Для того чтобы уравнение соответствовало закону сохранения массы веществ, необходимо расставить коэффициенты. Сначала проверяем количество кислорода до реакции, после завершения процесса. Так как было 2 атома кислорода, а образовался всего один, в правой части перед формулой оксида магния необходимо добавить коэффициент 2. Далее считаем число атомов магния до и после процесса. В результате взаимодействия получилось 2 магния, следовательно, в левой части перед простым веществом магнием также необходим коэффициент 2.
Итоговый вид реакции: 2Mg+O2=2MgO.
Пример реакции замещения
Любой конспект по химии содержит описание разных видов взаимодействий.
В отличие от соединения, в замещении и в левой, и в правой части уравнения будет два вещества. Допустим, необходимо написать реакцию взаимодействия между цинком и раствором соляной кислоты. Алгоритм написания используем стандартный. Сначала в левой части через сумму пишем цинк и соляную кислоту, в правой части составляем формулы получаемых продуктов реакции. Так как в электрохимическом ряду напряжений металлов цинк располагается до водорода, в данном процессе он вытесняет из кислоты молекулярный водород, образует хлорид цинка. В результате получаем следующую запись: Zn+HCL=ZnCl2+h3.
Теперь переходим к уравниванию количества атомов каждого элемента. Так как в левой части хлора был один атом, а после взаимодействия их стало два, перед формулой соляной кислоты необходимо поставить коэффициент 2.
В итоге получаем готовое уравнение реакции, соответствующее закону сохранения массы веществ: Zn+2HCL=ZnCl2+h3.

Заключение
Типичный конспект по химии обязательно содержит несколько химических превращений. Ни один раздел этой науки не ограничивается простым словесным описанием превращений, процессов растворения, выпаривания, обязательно все подтверждается уравнениями. Специфика химии заключается в том, что с все процессы, которые происходят между разными неорганическими либо органическими веществами, можно описать с помощью химических символов, знаков, коэффициентов, индексов.
Чем еще отличается от других наук химия? Химические уравнения помогают не только описывать происходящие превращения, но и проводить по ним количественные вычисления, благодаря которым можно осуществлять лабораторное и промышленное получение разных веществ.
Составление уравнений химических реакций
Урок посвящен изучению алгоритма составления уравнения химической реакции. В ходе урока вы научитесь составлять схему и уравнение химической реакции, зная формулы исходных веществ и продуктов реакции.
I. Схема химической реакции
Сущность химической реакции с позиции атомно-молекулярной теории заключается в том, что продукты реакции образуются из тех же атомов, которые входили в состав исходных веществ.
Пример 1. При разложении воды образуются простые вещества – водород и кислород (Рис.1.).

Рис. 1. Разложение воды под действие электрического тока
Запишем формулу исходного вещества воды слева, а формулы продуктов реакции - водорода и кислорода – справа. Между ними поставим стрелку:
Н2О → Н2 + О2
Эта запись является схемой реакции.
Схема реакции показывает только состав исходных веществ и продуктов реакции, но не может полностью отражать сущность реакции. В состав молекулы воды входит один атом кислорода, а в состав простого вещества кислорода входят два атома. Это значит, что не выполняется закон сохранения массы веществ.
II. Химические уравнения реакций
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
Видео - эксперимент: “Нагревание смеси железа и серы”
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Fe + S = FeS
Рассмотрим еще один пример: 2Н2О = 2Н2 + О2
Чтобы не было противоречий с законом сохранения массы веществ, нужно уравнять число атомов каждого химического элемента слева и справа от стрелки.
Чтобы образовалась одна молекула кислорода, в реакцию должны вступить две молекулы воды. Поставив коэффициент «2» перед формулой воды. Теперь уравняем количество атомов водорода, поставив коэффициент «2» перед формулой Н2, вместо стрелки поставим знак равенства:
Эта запись является уравнением химической реакции. В отличие от схемы реакции, уравнение учитывает, что число атомов каждого химического элемента в реакции не меняется.
Цифры, стоящие перед формулой вещества, называются коэффициентами. Коэффициент показывает количество молекул вещества.
Прочитать записанное уравнение можно так: «Из двух молекул воды образуется две молекулы водорода и 1 молекула кислорода».
III. Алгоритм составления уравнения химической реакции
|
Составим уравнение химической реакции взаимодействия фосфора и кислорода |
|
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – h3; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку: P + O2 → |
|
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов: P + O2 → P2O5 |
|
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
4P + 5O2 = 2P2O5 |
IV. Работа с тренажерами
V. Задания для закрепления
Задание №1
Преобразуйте следующие схемы в уравнения химических реакций расставив необходимые коэффициенты и заменив стрелки на знак равенства:Zn + O2 → ZnO
Fe + Cl2→ FeCl3
Mg + HCl → MgCl2 + h3
Al(OH)3 → Al2O3 + h3O
HNO3→ h3O+NO2+O2
CaO+h3O→ Ca(OH)2
h3+Cl2→ HCl
KClO3→ KClO4+KCl
Fe(OH)2+h3O+O2→ Fe(OH)3
KBr+Cl2→ KCl+Br2
Задание №2
Используя алгоритм составления уравнений химических реакций, составьте уравнения реакций взаимодействия между следующими парами веществ:
1) Na и O2 2) Na и Cl23) Al и S
kardaeva.ru
Урок 13. Составление химических уравнений – HIMI4KA
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.

Химическое уравнение
В результате реакции горения метана Ch5 в кислороде O2 образуются диоксид углерода CO2 и вода h3O. Эта реакция может быть описана химическим уравнением:
- Ch5 + O2 → CO2 + h3O (1)
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу Ch5 и сколько молекул CO2 и h3O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
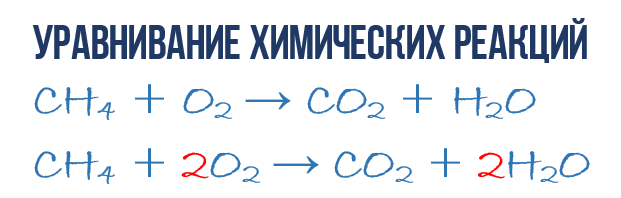
Начнем с углерода. В левой части один атом С входит в состав молекулы Ch5, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
- 1Ch5 + O2 → 1CO2 + h3O (2)
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле h5 = 4H) в составе молекулы Ch5, а в правой – всего 2 атома H в составе молекулы h3O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой h3O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
- 1Ch5 + O2 → 1CO2 + 2h3O (3)
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды h3O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2h3O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
- 1Ch5 + 2O2 → 1CO2 + 2h3O или Сh5 + 2O2 → CO2 + 2h3O (4)
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя h3O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
- C7H5N3O6 + O2 → CO2 + h3O + N2 (5)
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + h3O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
- 2C7H5N3O6 + O2 → 14CO2 + 5h3O + 3N2 (7)
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
- 2C7H5N3O6 + 10,5O2 → 14CO2 + 5h3O + 3N2 (8)
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
- 4C7H5N3O6 + 21O2 → 28CO2 + 10h3O + 6N2 (9)
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
- C7H5N3O6 + 5,25O2 → 7CO2 + 2,5h3O + 1,5N2 (10)
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·1023, мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей h3O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C7H5N3O6 = 227,13 г/моль
- O2 = 31,999 г/моль
- CO2 = 44,010 г/моль
- h3O = 18,015 г/моль
- N2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г h3O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO2 | |
| 671,98 г CO2 | 180,15 г h3O | |
| 168,08 г N2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2:
- CaCO3 + 2HCl → CaCl2 + CO2 + h3O (11)
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и h3O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H+ и Cl—. Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
- CaCO3(тв.) + 2H+(водн.) → Ca2+(водн.) + CO2(г.) + h3O(ж.) (12)
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H+, образуя при этом положительный ион Ca2+, CO2 и h3O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Урок 12. Составление уравнений химических реакций – HIMI4KA
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.

Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
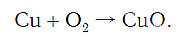
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
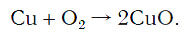
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
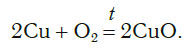
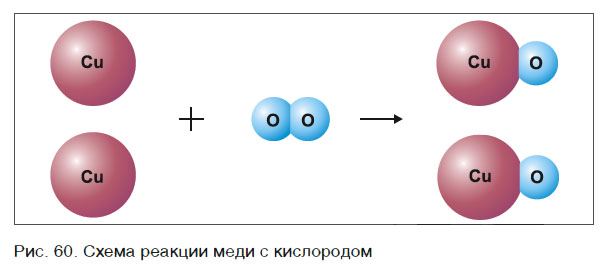
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
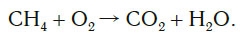
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
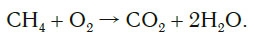
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
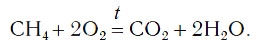
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
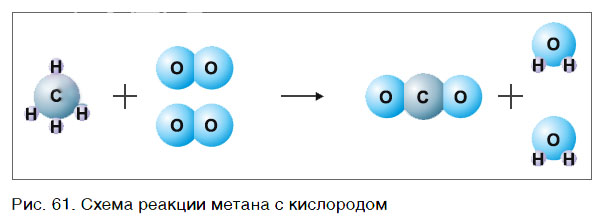
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
himi4ka.ru
Как составить уравнение химической реакции: последовательность действий :: SYL.ru
Поговорим о том, как составить уравнение химической реакции. Именно этот вопрос в основном вызывает серьезные затруднения у школьников. Одни не могут понять алгоритм составления формул продуктов, другие неправильно расставляют коэффициенты в уравнении. Учитывая, что все количественные вычисления осуществляются именно по уравнениям, важно понять алгоритм действий. Попробуем выяснить, как составлять уравнения химических реакций.
Составление формул по валентности
Для того чтобы правильно записывать процессы, происходящие между различными веществами, нужно научиться записывать формулы. Бинарные соединения составляют с учетом валентностей каждого элемента. Например, у металлов главных подгрупп она соответствует номеру группы. При составлении конечной формулы между этими показателями определяется наименьшее кратное, затем расставляются индексы.
Что такое уравнение
Под ним понимают символьную запись, которая отображает взаимодействующие химические элементы, их количественные соотношения, а также те вещества, которые получаются в результате процесса. Одно из заданий, предлагаемых ученикам девятого класса на итоговой аттестации по химии, имеет следующую формулировку: «Составьте уравнения реакций, характеризующих химические свойства предложенного класса веществ». Для того чтобы справиться с поставленной задачей, ученики должны владеть алгоритмом действий.
Алгоритм действий
Например, нужно написать процесс горения кальция, пользуясь символами, коэффициентами, индексами. Поговорим о том, как составить уравнение химической реакции, воспользовавшись порядком действий. В левой части уравнения через "+" записываем знаками вещества, которые участвуют в данном взаимодействии. Так как горение происходит с участием кислорода воздуха, который относится к двухатомным молекулам, его формулу пишем О2.
За знаком равенства формируем состав продукта реакции, используя правила расстановки валентности:
2Ca + O2 = 2CaO.
Продолжая разговор о том, как составить уравнение химической реакции, отметим необходимость использования закона постоянства состава, а также сохранения состава веществ. Они позволяют проводить процесс уравнивания, расставлять в уравнении недостающие коэффициенты. Данный процесс является одним из простейших примеров взаимодействий, происходящих в неорганической химии.
Важные аспекты
Для того чтобы понять, как составить уравнение химической реакции, отметим некоторые теоретические вопросы, касающиеся этой темы. Закон сохранения массы веществ, сформулированный М. В. Ломоносовым, объясняет возможность расстановки коэффициентов. Так как количество атомов каждого элемента до и после взаимодействия остается неизменным, можно проводить математические расчеты.
При уравнивании левой и правой частей уравнения используют наименьшее общее кратное, аналогично тому, как составляется формула соединения с учетом валентностей каждого элемента.
Окислительно-восстановительные взаимодействия
После того как у школьников будет отработан алгоритм действий, они смогут составить уравнение реакций, характеризующих химические свойства простых веществ. Теперь можно переходить к разбору более сложных взаимодействий, например протекающих с изменением степеней окисления у элементов:
Fe + CuSO4 = FeSO4 + Cu.
Существуют определенные правила, согласно которым расставляют степени окисления в простых и сложных веществах. Например, у двухатомных молекул этот показатель равен нулю, в сложных соединениях сумма всех степеней окисления также должна быть равна нулю. При составлении электронного баланса определяют атомы или ионы, которые отдают электроны (восстановитель), принимают их (окислитель).
Между этими показателями определяется наименьшее кратное, а также коэффициенты. Завершающим этапом разбора окислительно-восстановительного взаимодействия является расстановка коэффициентов в схеме.
Ионные уравнения
Одним из важных вопросов, который рассматривается в курсе школьной химии, является взаимодействие между растворами. Например, дано задание следующего содержания: «Составьте уравнение химической реакции ионного обмена между хлоридом бария и сульфатом натрия». Оно предполагает написание молекулярного, полного, сокращенного ионного уравнения. Для рассмотрения взаимодействия на ионном уровне необходимо по таблице растворимости указать ее для каждого исходного вещества, продукта реакции. Например:
BaCl2 + Na2SO4 = 2NaCl + BaSO4
Вещества, которые не растворяются на ионы, записывают в молекулярном виде. Реакция обмена ионами протекает полностью в трех случаях:
- образование осадка;
- выделение газа;
- получение малодиссоциируемого вещества, например воды.
При наличии у вещества стереохимического коэффициента он учитывается при написании полного ионного уравнения. После того как будет написано полное ионное уравнение, проводят сокращение тех ионов, которые не были связаны в растворе. Конечным итогом любого задания, предполагающего рассмотрение процесса, протекающего между растворами сложных веществ, будет запись сокращенной ионной реакции.
Заключение
Химические уравнения позволяют объяснять с помощью символов, индексов, коэффициентов те процессы, которые наблюдаются между веществами. В зависимости от того, какой именно протекает процесс, существуют определенные тонкости записи уравнения. Общий алгоритм составления реакций, рассмотренный выше, основывается на валентности, законе сохранения массы веществ, постоянстве состава.
www.syl.ru
Составление уравнений химических реакций
-
Как ещё можно назвать химические явления?
-
По каким признакам можно судить о том, что прошла химическая реакция?
-
Химическое уравнение это?
-
Коэффициент – что это такое?
-
Операционно-познавательный этап:
1.Актуализация опорных знаний:
Химический элемент —► Химический символ
Вещество —► Химическая формула
Химическая реакция —► Химическое уравнение
(запись учащимися в тетрадь!)
Исходные продукты Вещества реакции
2Н2+ О2= 2Н2О.
2 моль 1 моль 2 моль
:
AgNО3+ НС1 = AgCl↓ + HNО3,
СаСО3= СаО + СО2↑
2.Изучение нового материала:
Учитель показывает, как составляются уравнения химических реакций, используя схемы реакций меди и кислорода, метана с кислородом (рис. 60, 61 учебника)
!!!Обращение внимания на прочтение уравнений!!!
Запись в тетради алгоритма составления уравнений химической реакции:
-
Установить состав исходных веществ и продуктов реакции
-
Записать формулы исходных веществ слева, продуктов реакции – справа
-
Между правой и левой частями уравнений сначала поставить стрелку
-
Расставить коэффициенты, т.е. уравнять числа атомов каждого химического элемента до и после реакции
-
Связать левую и правую части уравнений знаком «=» (равно)
3.Закрепление изученного материала: С целью контроля ЗУН по изученной теме учащимся предлагается выполнить проверочную работу.
1. Расставьте коэффициенты в приведенных схемах реакций:
a) Li + O2→ Li2Ob) Fe(OH)3→ Fe2O3+ h3O
c) K + Cl2→ KCl
d) KNO3→ KNO2+ O2
2.В приведенных схемах химических реакций вместо знаков вопроса напишите формулы соответствующих веществ и расставьте коэффициенты:
a) N2O → N2+ ?b) FeCl2+ ? → FeCl3
c) h3O2→ h3O + ?
d) Cu2O + ? → CuO
В следующих схемах химических реакций назовите продукты реакции и исходные вещества:
infourok.ru
Предлагаем Вам алгоритм составления уравнения химической реакции. Алгоритм составления уравнения химической реакции
Предлагаем Вам алгоритм составления уравнения химической реакции.
Алгоритм составления уравнения химической реакции.
| Составим уравнение химической реакции взаимодействия фосфора и кислорода |
| 1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – h3; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку: P + O2 → |
| 2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
P + O2 → P2O5
|
| 3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
4P + 5O2 = 2P2O5
|
Составьте уравнения химических реакций взаимодействия следующих веществ (расставьте коэффициенты):
1 вариант:
Mg + O2 → MgO
Zn + Cl2 → ZnCl2
Al + S → Al2S3
h4O → h4↑ + O2↑
Al + HCl → AlCl3 + h4↑
2 вариант:
Fe + S → FeS
Na + S → Na2S
HgO → Hg + O2↑
Zn + HCl → ZnCl2 + h4↑
Ca + O2 → CaO
проверить
вариант:
2Mg + O2 → 2MgO
Zn + Cl2 → ZnCl2
2Al + 3S → Al2S3
2h4O → 2h4↑ + O2↑
2Al + 6HCl →2 AlCl3 + 3h4↑
вариант:
Fe + S → FeS
2Na + S → Na2S
2HgO → 2Hg + O2↑
Zn + 2HCl → ZnCl2 + h4↑
2Ca + O2 → 2CaO
gigabaza.ru














