Урок 6. Валентность. Валентность no
Валентность азота (N), формулы и примеры
Общие сведения о валентности азота
Азот – типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду.
Природный азот состоит из двух устойчивых изотопов 14N (99,635%) и 15N (0,365%).
Молекула азота двухатомна. Между атомами азота в молекуле есть тройная связь, вследствие чего молекула N2 исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.
В обычных условиях молекулярный азот – газ. Температуры плавления (-210oС) и кипения (-195,8oС) азота очень низкие; он плоха растворяется в воде и других растворителях.
Валентность азота в соединениях
Азот — седьмой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VA группе. В ядре атома азота содержится 7 протонов и 7 нейтронов (массовое число равно 14). В атоме азота есть два энергетических уровня, на которых находятся 7 электронов (рис. 1).
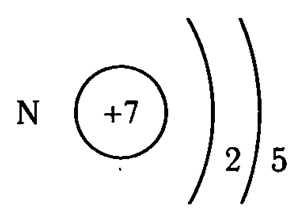
Рис. 1. Строения атома азота.
Электронная формула атома азота в основном состоянии имеет следующий вид:
1s22s22p3.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие трех неспаренных электронов свидетельствует о том, что азот может проявлять валентность III в своих соединения (NIII2O3, NIIIh4, HNIIIO2).
Известно, что помимо трех ковалентных связей, образуемых по обменному типу, азот способен образовывать ещё одну (т.е. в сумме четыре) по донорно-акцепторому механизму за счет наличия неподеленной пары электронов, находящейся на 2s-подуровне. Это означает, что азот также может проявлять в своих соединениях валентность IV (NIVO2).
Так как на 2 энергетическом слое нет подуровней кроме 2s и 2p, которые уже заняты электронами, возбужденного состояния у азота нет.
Ранее считалось, что высшая валентность азота равна V – соответствует номеру группы, в которой этот элемент расположен (NV2O5, HNVO3). Однако, квантово-механические исследования показали, что такая валентность для азота не характерна (рис. 2). Степень окисления +5 у азота есть, а валентности равной V – нет.
Рис. 2. Структурные формулы азотной кислоты и оксида азота (V).
Также для азота характерно проявление валентностей I (NI2O) и II (NO).
Примеры решения задач
ru.solverbook.com
Урок 6. Валентность – HIMI4KA
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.

Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле h3O у атома кислорода валентность равна двум. По той же причине в молекуле Nh4 валентность атома азота равна трем, а в молекуле Ch5 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды h3O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х·1 = II·2, откуда х = IV.
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х·1 = II·1, откуда х = II:
Постоянная и переменная валентность
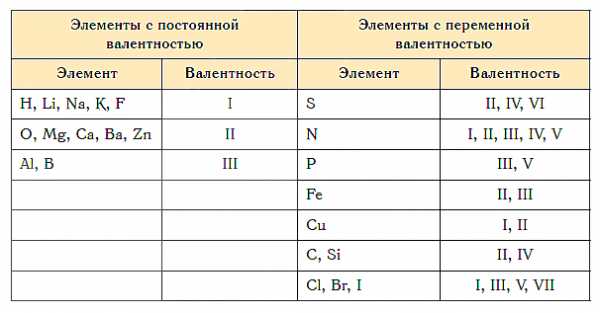
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.

Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV·III).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Валентность. Определение валентности. - Ида Тен
Валентность элементов
До сих пор вы пользовались химическими формулами веществ, приведенными в учебнике, или теми, которые вам называл учитель. Как же правильно составлять химические формулы?
Химические формулы веществ составляются на основе знания качественного и количественного состава вещества. Веществ существует гигантское количество, естественно запомнить все формулы невозможно. Это и не нужно! Важно знать определенную закономерность, согласно которой атомы способны соединяться друг с другом с образованием новых химических соединений. Такая способность называется валентностью.
Валентность – свойство атомов элементов присоединять определенное число атомов других элементов
Рассмотрим модели молекул некоторых веществ, таких, как вода, метан и углекислый газ.
Видно, что в молекуле воды атом кислорода присоединяет два атома водорода. Следовательно, его валентность равна двум. В молекуле метана атом углерода присоединяет четыре атома водорода, его валентность в данном веществе равна четырем. Валентность водорода в обоих случаях равна одному. Такую же валентность углерод проявляет и в углекислом газе, но в отличие от метана, атом углерода присоединяет два атома кислорода, так как валентность кислорода равна двум.
Существуют элементы, валентность которых не меняется в соединениях. О таких элементах говорят, что они обладают постоянной валентностью. Если же валентность элемента может быть различной – это элементы с переменной валентностью. Валентность некоторых химических элементов приведена в таблице 2. Валентность принято обозначать римскими числами.
Таблица 2. Валентность некоторых химических элементов
| Символ элемента | Валентность | Символ элемента | Валентность |
| H, Li, Na, K, F, Ag | I | C, Si, Sn, Pb | II, IV |
| Be, Mg, Ca, Ba, Zn, O | II | N | I, II, III, IV |
| Al, B | III | P, As, Sb | III, V |
| S | II, IV, VI | Cl | I, II,III, IV,V, VII |
| Br, I | I, III, V | Ti | II, III, IV |
Стоит отметить, что высшая валентность элемента численно совпадает с порядковым номером группы Периодической Системы, в которой он находится. Например, углерод находиться в IV группе, его высшая валентность равна IV.
Исключение составляют три элемента:
- азот – находится в V группе, но его высшая валентность IV;
- кислород – находится в VI группе, но его высшая валентность II;
- фтор – находится в VII группе, но его высшая валентность – I.
Исходя из того, что все элементы расположены в восьми группах Периодической Системы, валентность может принимать значения от I до VIII.
Составление формул веществ при помощи валентности
Для составления формул веществ при помощи валентности воспользуемся определенным алгоритмом:
| Алгоритм | Пример |
| Записать химические формулы элементов | |
| Вверху, над символами элементов записать значение их валентности. Для элементов с переменной валентностью конкретная валентность указана в условии | |
| Найти наименьшее общее кратное (НОК) значений валентности, записать его вверху | |
| Поделить НОК на значения валентностей элементов – это индексы, выражающие число атомов | 10:V=2(P)10:II=5(O)P2O5 |
Определение валентности по формуле вещества
Чтобы определить валентность элементов по формуле вещества, необходим обратный порядок действий. Рассмотрим его также при помощи алгоритма:
| Алгоритм | Пример |
| Записать формулу вещества | |
| Указать известную валентность элемента (для элементов с постоянной валентностью) | |
| Найти наименьшее общее кратное (НОК) валентности и индекса элемента | |
| Поделить значение НОК на индекс элемента, валентность которого неизвестна |
При изучении данного параграфа были рассмотрены сложные вещества, в состав которых входят только два вида атомов химических элементов. Формулы более сложных веществ составляются иначе.
Бинарные соединения – соединения, в состав которых входит два вида атомов элементов
Для определения порядка последовательности соединения атомов используют структурные (графические) формулы веществ. В таких формулах валентности элементов обозначают валентными штрихами (черточками). Например, молекулу воды можно изобразить как
Н─О─Н
Графическая формула изображает только порядок соединения атомов, но не структуру молекул. В пространстве такие молекулы могут выглядеть иначе. Так, молекула воды имеет угловую структурную формулу:
- Валентность – способность атомов элементов присоединять определенное число атомов других химических элементов
- Существуют элементы с постоянной и переменной валентностью
- Высшая валентность химического элемента совпадает с его номером группы в Периодической Системе химических элементов Д.И. Менделеева. Исключения: азот, кислород, фтор
- Бинарные соединения – соединения, в состав которых входит два вида атомов химических элементов
- Графические формулы отражают порядок связей атомов в молекуле при помощи валентных штрихов
- Структурная формула отражает реальную форму молекулы в пространстве
idaten.ru
Валентность — Википедия
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей.
История возникновения понятия «валентность»
Этимологию термина валентность возможно отследить начиная с 1425 года, когда его начали использовать в научных текстах в значении «экстракт», «препарат». Использование в рамках современного определения зафиксировано в 1884 году (нем. Valenz)[1]. В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества[2].
Однако точное и позже полностью подтверждённое понимание феномена валентности было предложено в 1852 году химиком Эдуардом Франклендом в работе, в которой он собрал и переосмыслил все существовавшие на тот момент теории и предположения на этот счёт[3]. Наблюдая способность к насыщению разных металлов и сравнивая состав органических производных металлов с составом неорганических соединений, Франкленд ввёл понятие о «соединительной силе» (соединительном весе), положив этим основание учению о валентности. Хотя Франкленд и установил некоторые частные закономерности, его идеи не получили развития.
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле. В 1857 году он показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является метан СН4. Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора — фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес. В 1858 году взгляды, почти совпадающие с идеями Кекуле, высказал в статье «О новой химической теории» Арчибальд Скотт Купер.
Уже три года спустя, в сентябре 1861-го, А. М. Бутлеров внёс в теорию валентности важнейшие дополнения. Он провёл чёткое различие между свободным атомом и атомом, вступившим в соединение с другим, когда его сродство «связывается и переходит в новую форму». Бутлеров ввёл представление о полноте использования сил сродства и о «напряжении сродства», то есть энергетической неэквивалентности связей, которая обусловлена взаимным влиянием атомов в молекуле. В результате этого взаимного влияния атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Теория Бутлерова позволила дать объяснение многим экспериментальным фактам, касавшимся изомерии органических соединений и их реакционной способности.
Молекулярные модели ГофманаОгромным достоинством теории валентности явилась возможность наглядного изображения молекулы. В 1860-х годах появились первые молекулярные модели. Уже в 1864 году А. Браун предложил использовать структурные формулы в виде окружностей с помещёнными в них символами элементов, соединённых линиями, обозначающими химическую связь между атомами; количество линий соответствовало валентности атома. В 1865 году А. фон Гофман продемонстрировал первые шаростержневые модели, в которых роль атомов играли крокетные шары. В 1866 году в учебнике Кекуле появились рисунки стереохимических моделей, в которых атом углерода имел тетраэдрическую конфигурацию.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, h3O, Nh4, Ch5 валентность по водороду хлора равна единице, кислорода — двум, азота — трём, углерода — четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода — двум, азота — трём, кремния — четырём, серы — шести.
У большинства элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (h3S), а по кислороду шести (SO3). Кроме того, большинство элементов проявляют в разных своих соединениях различную валентность [некоторые элементы могут не иметь ни гидридов, ни оксидов]. Наприм., углерод образует с кислородом два оксида: монооксид углерода CO и диоксид углерода CO2. В монооксиде углерода валентность углерода равна двум, а в диоксиде — четырём (некоторые элементы способны образовывать также пероксиды). Из рассмотренных примеров следует, что охарактеризовать валентность элемента каким-нибудь одним числом и/или методом, как правило, нельзя.
Видео по теме
Современные представления о валентности
С момента возникновения теории химической связи понятие «валентность» претерпело существенную эволюцию. В настоящее время оно не имеет строгого научного толкования, поэтому практически полностью вытеснено из научной лексики и используется, преимущественно, в методических целях.
Резонансная модель образования ковалентных связей в молекуле HNO3В основном, под валентностью химических элементов обычно понимается способность свободных его атомов (в более узком смысле — мера его способности) к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей, предложенной в 1927 году В. Гайтлером и Ф. Лондоном. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами[4]. При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бора, углерода и азота равна 4 (например, в [BF4]−, Ch5 и [Nh5]+), фосфора — 5 (PCl5), серы — 6 (h3SO4), хлора — 7 (Cl2O7).Число связей, которые может образовывать атом, равно числу его неспаренных электронов, идущих на образование общих электронных пар (молекулярных двухэлектронных облаков). Ковалентная связь может образовываться также по донорно-акцепторному механизму. При этом в обоих случаях не учитывается полярность образовавшихся связей, а потому валентность не имеет знака — она не может быть ни положительной, ни отрицательной, в отличие от степени окисления (N2, NO2, Nh4 и [Nh5]+).
Структурная формула молекулы этанаКроме валентности по водороду и по кислороду, способность атомов данного элемента соединяться друг с другом или с атомами других элементов в ряде случаев можно выразить [часто и отождествить] иными способами: как, например, степень окисления элемента (условный заряд атома в предположении, что вещество состоит из ионов), ковалентность (число химических связей, образуемых атомом данного элемента, в том числе и с одноимённым элементом; см. ниже), координационное число атома (число атомов, непосредственно окружающих данный атом) и т. п. Эти характеристики могут быть близки и даже совпадать количественно, но ни коим образом не тождественны друг другу[5]. Например, в изоэлектронных молекулах азота N2, монооксида углерода CO и цианид-ионе CN− реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления элементов равна, соответственно, 0, +2, −2, +2 и −3. В молекуле этана (см. рис.) углерод четырёхвалентен, как и в большинстве органических соединений, тогда как степень окисления равна −3.
Особенно это справедливо для молекул с делокализованными химическими связями, например в азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4. Известное из многих школьных учебников правило — «Максимальная валентность элемента численно равна номеру группы в Периодической таблице» — относится исключительно к степени окисления. Понятия «постоянной валентности» и «переменной валентности» также преимущественно относятся к степени окисления.
Семиполярные и донорно-акцепторные (дативные) связи по своей сути являются «двойными» связями, поскольку при их образовании происходят оба процесса: перенос электрона (образование ионной связи) и обобществление электронов (образование ковалентной связи).
Понятие валентности нельзя использовать и в очень многих случаях, когда невозможно применить модель двухэлектронных двухцентровых связей[6] — нельзя говорить о валентности элементов в соединениях, где отсутствуют ковалентные связи (чаще в таких случаях корректнее говорить о степени окисления). Представления о валентности не применимы для описания кластерных соединений, бороводородов, карборанов, π-комплексов, соединений благородных газов и многих других. Например, катионы щелочных металлов в комплексах с краун-эфирами проявляют валентность, намного превышающую их степень окисления.
Некорректным будет использование валентности для описания соединений с ионной кристаллической структурой. Так в кристалле хлорида натрия NaCl у каждого иона Na+ или Cl− — центра элементарной ячейки — реальное число соседних ионов — координационное число — равно 6, а степень окисления — +1 и −1 соответственно. Локализованных же электронных пар вовсе нет.
В современной химии активно используется метод молекулярных орбиталей, в котором отсутствуют какие-либо аналоги понятия валентности атома. Между тем, понятие кратности химической связи наиболее близко к характеристике числа образуемых связей. Отождествление единичной связи с двухэлектронной молекулярной орбиталью возможно лишь в предельном, локализованном случае[5]. В квантовой химии аналога понятия валентности как характеристики атома в молекуле не существует, а используемое понятие спин-валентности относится к изолированному атому[7].
Ковалентность элемента (мера валентных возможностей элементов; ёмкость насыщения) определяется общим числом неспаренных электронов [валентных электронных пар[8]] как в нормальном, так и в возбуждённом состоянии атома, или, иначе говоря, число образуемых атомом ковалентных связей (углерод 2s22p2 II-ковалентен, а в возбуждённом состоянии C* 2s12p3 — IV-ковалентный; таким образом в CO и CO2 валентность составляет II или IV, а ковалентность — II и/или IV). Так, ковалентность азота в молекулах N2, Nh4, Al≡N и цианамиде Ca=N-C≡N равна трём, ковалентность кислорода в молекулах h3O и CO2 — двум, ковалентность углерода в молекулах Ch5, CO2 и кристалле C (алмаза) — четырём.
В классическом и/или пост-квантовохимическом представлении по электронным спектрам поглощения двухатомных молекул можно определять число оптических (валентных) электронов при данной энергии возбуждения[9]. Согласно этому методу, обратная величина тангенса угла наклона корреляционной прямой/прямых (при релевантных значениях молекулярных электронных термов, которые образованы относительными суммами атомных) соответствует числу пар валентных электронов, то есть валентности в её классическом понимании[10].
Между валентностью [стехиометрической] в данном соединении, мольной массой его атомов и его эквивалентной массой существует простое соотношение, непосредственно вытекающее из атомной теории и определения понятия «эквивалентная масса».
Стехиометрическая валентность [расчётная] элемента в данном соединении[11] равна молекулярной массе его атомов (в г/моль), делённой на эквивалентную массу элемента (в г/моль):
V=ME{\displaystyle V={\frac {M}{E}}}V — Стехиометрическая валентностьM — Молекулярная масса (г/моль)E — Эквивалентная масса (г/моль)Так, стехиометрическая валентность углерода в CO 12 (г/моль) /6 (г/моль) = 2, а в CO2 12 /3 = 4.
В неорганической химии во многих случаях понятие валентности элемента теряет определённость: эта величина зависит от знания химического строения соединения, во многих случаях она может быть больше номера группы (таблицы ПСХЭ). В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как большинство неорганических веществ имеет немолекулярное строение, а органических — молекулярное. Нельзя отождествлять эти два понятия, даже если они численно совпадают. Широко применяется также термин «валентные электроны», то есть наиболее слабо связанные с ядром атома, чаще всего внешние электроны.
По валентности элементов можно составлять истинные формулы соединений, и, наоборот, исходя из истинных формул можно определять валентности элементов в данных соединениях. При этом необходимо придерживаться принципа, согласно которому произведение валентности одного элемента на число его атомов равно произведению валентности второго элемента на число его атомов. Так, чтобы составить формулу оксида азота (III), следует записать сверху над символом валентности элементов NIII{\displaystyle {\stackrel {III}{\mbox{N}}}} OII{\displaystyle {\stackrel {II}{\mbox{O}}}}. Определив наименьший общий знаменатель и разделив его на соответствующие валентности, получим атомное соотношение азота к кислороду, а именно 2 : 3. Следовательно, формула оксида азота (III) соответствует N+32O−23{\displaystyle {\stackrel {+3}{\mbox{N}}}_{2}{\stackrel {-2}{\mbox{O}}}_{3}}. Для определения валентности поступают таким же образом наоборот.
Примечания
- ↑ Valence — Online Etymology Dictionary.
- ↑ Partington, J.R. A Short History of Chemistry. — Dover Publications, Inc, 1989. — ISBN 0-486-65977-1.
- ↑ Frankland E. On a New Series of Organic Bodies Containing Metals. // Phil. Trans. 1852. Vol. 142. P. 417—444.
- ↑ Неорганическая химия / Б. Д. Степин, А. А. Цветков ; Под ред. Б. Д. Степина. — М.: Высш. шк., 1994. — С. 71—72
- ↑ 1 2 Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126
- ↑ Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. стр.19.
- ↑ Татевский В. М. Квантовая механика и теория строения молекул. М.: Изд-во МГУ, 1965. Глава 3.
- ↑ в том числе в донорно-акцепторной связи
- ↑ Серов Н. В. Электронные термы простых молекул // Оптика и спектроскопия, 1984, Т.56, вып.3, с. 390—406.
- ↑ Ionov S.P. and Kuznetsov N.T. Excited and Ionized and States of h3 in Terms of the Structural Thermodynamic Model// Russian Journal of Inorganic Chemistry Vol. 50, No. 2, February 2005, pp. 233—237
- ↑ В предположении что Валентность неизвестна, но известны молекулярная масса и эквивалентная масса соединения.
См. также
Ссылки
Литература
- Л. Паулинг Природа химической связи. М., Л.: Гос. НТИ хим. литературы, 1947.
- Картмелл, Фоулс. Валентность и строение молекул. М.: Химия, 1979. 360 с.]
- Коулсон Ч. Валентность. М.: Мир, 1965.
- Маррел Дж., Кеттл С., Теддер Дж. Теория валентности. Пер. с англ. М.: Мир. 1968. (недоступная ссылка)
- Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. 248с.
- Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126.
wikipedia.green
Ответы@Mail.Ru: какая валентность у азота?
Переменная. Он может находиться в самом разном валентном состоянии в зависимости от соединения. И даже дробная валентность бывает.. . :) Очень хорошо видно на примере окислов азота: N2O -- одновалентный азот (веселящий газ) NO -- двухвалентный. N2O3 -- трёхвалентный NO2 -- четырёхвалентный (лисий хвост -- рыжий дым, который шёл из труб хим. заводов) N2O5, HNO3 (азотная кислота) -- пятивалентный азот
Третья-смотри таблицу менеделеева
Азот бывает: 1 валентным, 2-х, 3-х. А по секрету скажу: Я недавно сделал открытие, что азот может быть еще 7-ми и 8-ми валентным. Учитель будет приятно шокирован, что Ваш интерес к химии идет так далеко:)))
Первая (N2O), вторая (NO), третья (N2O3), четвертая (NO2), пятая (N2O5).
Степени окисления азота в соединениях −3, −2, −1, +1, +2, +3, +4, +5. Соединения азота в степени окисления −3 представлены нитридами, из которых практически наиболее важен аммиак; Соединения азота в степени окисления −2 менее характерны, представлены пернитридами, из которых самый важный пернитрид водорода N2h5 или гидразин (существует также крайне неустойчивый пернитрид водорода N2h3, диимид) ; Соединения азота в степени окисления −1 Nh3OH (гидроксиламин) — неустойчивое основание, применяющееся, наряду с солями гидроксиламмония, в органическом синтезе; Соединения азота в степени окисления +1 оксид азота (I) N2O (закись азота) ; Соединения азота в степени окисления +2 оксид азота (II) NO (монооксид азота) ; Соединения азота в степени окисления +3 оксид азота (III) N2O3, азотистая кислота, производные аниона NO2-, трифторид азота NF3; Соединения азота в степени окисления +4 оксид азота (IV) NO2 (диоксид азота, бурый газ) ; Соединения азота в степени окисления +5 — оксид азота (V) N2O5, азотная кислота и её соли — нитраты, и др.
То что вы написали, это степень окисления, к вашему сведению, а валентность это совсем другая вещь. ..
высшая валентность азота равна 4. а степень окисления в соединениях -3, +1,+2,+3,+4,+5.
touch.otvet.mail.ru
Ответы@Mail.Ru: Как определить ВАЛЕНТНОСТЬ элементов?
Сян, ну ты даешь. Отвечаешь на вопрос правильно, но так, как философ - перестаешь понимать сам вопрос.Девушка ПРОПУСТИЛА УРОК в школе. А ты - самый умный,это факт. Валентность можно определить также с помощью таблицы Менделеева - № группы у многих элементов совпадает с валентностью. У кальция, цинка - 2, у алюминия - 3, у фосфора -5. ПО формуле: у кислорода валентность 2,хотя он и в 6 группе ( почему, потом расскажут!). Известную валентность умножаем на количество атомов кислорода (1). Получили 2(общий множитель) Делим на 1 (число атомов цинка).Валентность цинка =2. Попробуй по этой схеме посчитать валентности в Аl2O3 (3х2 9вал. О)=6; 6:2=3( вал. Аl)
ну вообщем называется эта формула оксид цинка....валентность Zn- II валентнось O-II
валентность 2 , а ваще стыдно должно быть за это;))
У цинка и у кислорода валентность 2,так что пишется без коэффициентов!!!!Если, что обращайся,помогу!
Odnim slovom....eto sposobnost odnogo atoma prisoedinyat drugoi. to est obrazovyvat svyaz. No eto ne nzachit chto odin i tot zhe atom elementa mozhet prisoedinit vse gda odinakovoe kolichestvo i proyavit odinakovuu valentnost.
пропустила, обратись к учителю, есть же работа по помощи отстающим. вообще вся валентность есть просто в табличках в параграфе учебника.
Обычно надо идти от того элемента, валентность которого известна заранее. Скажем, у водорода валентность всегда 1 (потому как что ещё с него взять). У кислорода валентность ПОЧТИ ВСЕГДА (за редчайшими исключениями) равна -2. Валентность всей нейтральной молекулы, ессно, равна 0. Значит, валентность цинка в этом соединении равна +2.
Имею шанс поправить Гения :) Валентность не имеет знака! Со знаком - это СТЕПЕНЬ окисления! В простых случаях модуль степени окисления совпадает с величиной валентности. Бывает так, что в одном и том же веществе атомы одного элемента находятся в разной степени окисления.
тут окись цинка, кислород всегда имеет неменяемую валентность...2. От того и можно сколько цинка кислород тянет к себе, вернее электронов цинка... Цинк тоже значет 2 валентный. посложнее был бы...например комплексные соед.я.... ну лан. Овет: обеих атомов валентность равен II
Нет элемента с "неменяемой валентностью". С водорода можно "поиметь" и больше, например в пентаборане (B5H9)... В общем, понятие валентности на настоящем этапе весьма и весьма спорно, а попросту устарело. Актуальным, вернее, бесспорным, оно остается лишь для молекул с двухцентровыми ковалентными связями. Правда, в данном случае все так и есть.
Ну как, так как надо.
Природа кристаллических структур. Физическая таблица элементов. Читаем в инете.
touch.otvet.mail.ru
Чем отличается степень окисления от валентности?
Разумеется, степень окисления и валентность химического элемента - разные понятия. По определению, степень окисления - это ФОРМАЛЬНЫЙ заряд атома в веществе, вычисленный в предположении, что данное вещество состоит из ионов. Валентность элемента - это количество электронов соответствующего атома, идущее на образование КОВАЛЕНТНЫХ связей (связывающих электронных пар и пи-связей) в молекуле. Например, в нитрат-ионе NO3(-) валентность азота равна пяти (три электрона идут на образование трёх электронных пар (сигма- связей) и два - на образование делокализованной пи-связи. С другой стороны, в молекуле аммиака Nh4 азот - трёхвалентный, так как только три электрона участвуют в образовании трёх элетронных пар (сигма-связей) , а оставшиеся два - идут на образование несвязыващей (неподелённой) электронной пары. Как видно, степень окисления - более универсальное и удобное понятие, чем валентность. Понятие "валентность" в значительной степени привязано к теории локализованных электронных пар, которая может описать далеко не все виды химических связей.
они не чем не различаются!
У отрицательно заряженного элемента -только валентность, т. к. он сам окислитель и его окислить нельзя, а у положительно заряженного - степень окисления (равная валентности) , т. е. сколько к нему может присоединиться компонентов со знаком (-) и тем самым окислить его.
Валентность это способность атома отдавать свои или захватывать чужие электроны. А степень окисления это уже реализованная в конкретном случае валентность (полностью или частично) , причем конкретно с атомами кислорода.
Так как с кислородом все элементы электроположительны, только фтор исключение из этого правила. то по степенью окисления понимается варианты соединения элемента с кислородом и валентность положительная его при этом. Так сера имеет степень окисления предельную в SO3 и его по тому называют ангидридом, и не предельную в SO2. У азота таких окислов больше
touch.otvet.mail.ru











