Атомное ядро: заряд ядра. Заряд ядра
Заряд ядра, теория и примеры задач
Определение и заряд ядра
Заряд ядра (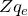 ) определяет местоположение химического элемента в таблице Д.И. Менделеева. Число Z – это количество протонов в ядре.
) определяет местоположение химического элемента в таблице Д.И. Менделеева. Число Z – это количество протонов в ядре. 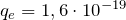 Кл — заряд протона, который равен по величине заряду электрона.
Кл — заряд протона, который равен по величине заряду электрона.
Еще раз подчеркнем, что заряд ядра определяет количество положительных элементарных зарядов, носителями которых являются протоны. А так как атом является в целом нейтральной системой, то заряд ядра определяет и количество электронов в атоме. А мы помним, что электрон имеет отрицательный элементарный заряд. Электроны в атоме распределяются по энергетическим оболочкам и подоболочкам в зависимости от их количества, следовательно, заряд ядра оказывает существенное влияние на распределение электронов по их состояниям. От количества электронов на последнем энергоуровне зависят химические свойства атома. Получается, заряд ядра определяет химические свойства вещества.
В настоящее время принято обозначать различные химические элементы следующим образом: 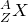 , где X – символ химического элемента в периодической таблице, который соответствует заряду
, где X – символ химического элемента в периодической таблице, который соответствует заряду 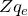 .
.
Элементы, у которых равны Z, но разные атомные массы (A) (это означает, что в ядре одинаковое число протонов, но разное количество нейтронов) называют изотопами. Так, водород имеет два изотопа: 11H-водород; 21H-дейтерий; 31H-тритий
Существуют устойчивые и неустойчивые изотопы.
Ядра, обладающие одинаковыми массами, но разными зарядами называются изобарами. Изобары в основном, встречаются среди тяжелых ядер, причем парами или триадами. Например,  и
и  .
.
Первым косвенное измерение заряда ядра сделал Мозли в 1913 г. Он установил связь между частотой характеристического рентгеновского излучения (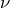 ) и зарядом ядра (Z):
) и зарядом ядра (Z):
![Rendered by QuickLaTeX.com \[\sqrt{\nu}=CZ-B \qquad (1)\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-88658a719a84edead4ade60af2ecc0be_l3.png)
где C и B постоянные не зависящие от элемента для рассматриваемой серии излучения.
Напрямую заряд ядра был определен Чедвиком в 1920 г. при исследовании рассеяния ядер атома гелия на металлических пленках.
Состав ядра
Ядро атома водорода 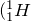 ) называется протоном. Масса протона равна:
) называется протоном. Масса протона равна:
![Rendered by QuickLaTeX.com \[m_p=1,67\cdot {10}^{-27}\left(kg\right)\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7428956bc6dacdaa8e6e5e8f479963ec_l3.png)
Ядро состоит из протонов и нейтронов (вместе их называют нуклонами). Нейтрон был открыт в 1932 г. Масса нейтрона очень близка к массе протона. Нейтрон электрического заряда не имеет.
Сумму количества протонов (Z) и числа нейтронов (N) в ядре называют массовым числом A:
![Rendered by QuickLaTeX.com \[A=Z+N \qquad (2)\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c03d7dde1c134bc5e91ff43171328557_l3.png)
Поскольку массы нейтрона и протона очень близкие, каждая из них равна почти атомной единице массы. Масса электронов в атоме много меньше, массы ядра, поэтому считают, что массовое число ядра приблизительно равно относительной атомной массе элемента, если округлить его до целого.
Примеры решения задач
ru.solverbook.com
Заряд ядра атома, теория и примеры
Атомы любых веществ являются электрически нейтральными частицами. Атом состоит из ядра и совокупности электронов. Ядро несет положительный заряд, суммарный заряд которого равен сумме зарядов всех электронов атома.
Общие сведения о заряде ядра атома
Заряд ядра атома определяет местоположение элемента в периодической системе Д.И. Менделеева и соответственно химические свойства вещества, состоящего их этих атомов и соединений этих веществ. Величина заряда ядра равна:
![Rendered by QuickLaTeX.com \[q=Ze \qquad (1)\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1c4acd50b57e7d9bce590340a8eb38af_l3.png)
где Z – номер элемента в таблице Менделеева, e – величина заряда электрона или 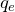 .
.
Элементы с одинаковыми числами Z, но разными атомными массами называют изотопами. Если элементы имеют одинаковые Z, то у них ядро имеет равное число протонов, а если атомные массы различны, то число нейтронов в ядрах этих атомов разное. Так, у водорода имеется два изотопа: дейтерий и тритий.
Ядра атомов имеют положительный заряд, так как состоят из протонов и нейтронов. Протоном называют стабильную частицу, принадлежащую классу адронов, являющуюся ядром атома водорода. Протон – это положительно заряженная частица. Ее заряд равен по модулю элементарному заряду, то есть величине заряда электрона. Заряд протона часто обозначают как 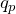 , тогда можно записать, что:
, тогда можно записать, что:
![Rendered by QuickLaTeX.com \[q_p=\left|e\right|=1,6\cdot {10}^{-19}Kl\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e9707b9d58b8c8b8b86848a3f9df5e42_l3.png)
Масса покоя протона ( ) примерно равна:
) примерно равна:
![Rendered by QuickLaTeX.com \[m_p=1,6\cdot {10}^{-27}\ kg\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-23ac42b3ea6ff820c58e9ff380ff4aca_l3.png)
Подробнее о протоне можно узнать, прочитав раздел «Заряд протона».
Эксперименты по измерению заряда ядра
Первым заряды ядер измерил Мозли в 1913 г. Измерения были косвенными. Ученый определил связь между частотой рентгеновского излучения (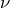 ) и зарядом ядра Z.
) и зарядом ядра Z.
![Rendered by QuickLaTeX.com \[\sqrt{\nu}=CZ-B \qquad (2)\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-cabc5202be136217e983016449d1f15f_l3.png)
где C и B – постоянные не зависящие от элемента для рассматриваемой серии излучения.
Напрямую заряд ядра измерил Чедвик в 1920 г. Он проводил рассеивание 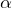 – частиц на металлических пленках, по сути, повторяя опыты Резерфорда, которые привели Резерфорда к построению ядерной модели атома.
– частиц на металлических пленках, по сути, повторяя опыты Резерфорда, которые привели Резерфорда к построению ядерной модели атома.
В этих экспериментах 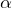 – частицы пропускались через тонкую металлическую фольгу. Резерфорд выяснил, что в большинстве случаев частицы проходили сквозь фольгу, отклоняясь на малые углы от первоначального направления движения. Это объясняется тем, что
– частицы пропускались через тонкую металлическую фольгу. Резерфорд выяснил, что в большинстве случаев частицы проходили сквозь фольгу, отклоняясь на малые углы от первоначального направления движения. Это объясняется тем, что 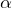 – частицы отклоняются под воздействием электрических сил электронов, которые имеют значительно меньшую массу, чем
– частицы отклоняются под воздействием электрических сил электронов, которые имеют значительно меньшую массу, чем  – частицы. Иногда, довольно редко
– частицы. Иногда, довольно редко  – частицы отклонялись на углы превышающие 90o. Этот факт Резерфорд объяснил наличием в атоме заряда, который локализован в малом объеме, и этот заряд связан с массой, которая много больше, чем у
– частицы отклонялись на углы превышающие 90o. Этот факт Резерфорд объяснил наличием в атоме заряда, который локализован в малом объеме, и этот заряд связан с массой, которая много больше, чем у  – частицы.
– частицы.
Для математического описания результатов своих экспериментов Резерфорд вывел формулу, которая определяет угловое распределение  – частиц после их рассеяния атомами. При выводе этой формулы ученый использовал закон Кулона для точечных зарядов и при этом считал, что масса ядра атома много больше, чем масса
– частиц после их рассеяния атомами. При выводе этой формулы ученый использовал закон Кулона для точечных зарядов и при этом считал, что масса ядра атома много больше, чем масса 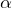 – частицы. Формулу Резерфорда можно записать как:
– частицы. Формулу Резерфорда можно записать как:
![Rendered by QuickLaTeX.com \[\frac{dN}{N}=n{\left(\frac{Ze^2}{m_{\alpha}v^2}\right)}^2\frac{d\Omega}{{\sin}^4\frac{\theta}{2}} \qquad (3)\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b1afba06b20f669cdab3663473c053ce_l3.png)
где n – количество рассеивающих ядер на единицу площади фольги; N – число 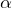 – частиц, которые проходят за 1 секунду через единичную площадку, перпендикулярно к направлению потока
– частиц, которые проходят за 1 секунду через единичную площадку, перпендикулярно к направлению потока 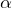 – частиц;
– частиц;  – количество частиц, которые рассеиваются внутри телесного угла
– количество частиц, которые рассеиваются внутри телесного угла 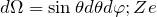 – заряд центра рассеяния;
– заряд центра рассеяния; 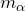 – масса
– масса 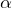 – частицы;
– частицы;  – угол отклонения
– угол отклонения 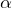 – частиц; v – скорость
– частиц; v – скорость 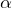 – частицы.
– частицы.
Формулу Резерфорда (3) можно использовать для того, чтобы найти заряд ядра атома (Z), если провести сравнение числа падающих 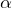 – частиц (N) с числом (dN) частиц рассеянных под углом
– частиц (N) с числом (dN) частиц рассеянных под углом  , то функция
, то функция 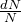 будет зависеть только от заряда рассеивающего ядра. Проводя опыты и применяя формулу Резерфорда Чедвик нашел заряды ядер платины, серебра и меди.
будет зависеть только от заряда рассеивающего ядра. Проводя опыты и применяя формулу Резерфорда Чедвик нашел заряды ядер платины, серебра и меди.
Примеры решения задач
ru.solverbook.com
ЗАРЯД ЯДРА
Количество просмотров публикации ЗАРЯД ЯДРА - 1146
Физические свойства атомных ядер. Размещено на реф.рфЗаряд ядра. Размер ядра. Моменты ядер. Размещено на реф.рфСпин ядра. Магнитный и электрический моменты ядра. Масса ядра и масса атома. Дефект массы. Энергия связи. Основные особенности энергии связи. Основное правило. Ядерные силы: основные характеристики, кулоновский и ядерный потенциалы ядра. Обменный характер ядерных сил.
Закон Мозли. Электрический заряд ядра образуют протоны, входящие в его состав. Число протонов Z называют его зарядом, имея ввиду, что абсолютное значение заряда ядра равно Ze. Заряд ядра совпадает с порядковым номером Z элемента в периодической системе элементов Менделеева. Впервые заряды атомных ядер определил английский физик Мозли в 1913 году. Измерив с помощью кристалла длину волны λ характеристического рентгеновского излучения для атомов некоторых элементов, Мозли обнаружил регулярное изменение длины волны λ у элементов, следующих друг за другом в периодической системе (рис.2.1). Это наблюдение Мозли интерпретировал зависимостью λ от некоторой константы атома Z, изменяющейся на единицу от элемента к элементу и равной единице для водорода:
, (2.1)
где и
- постоянные. Из экспериментов по рассеянию рентгеновских квантов атомными электронами и α-частиц атомными ядрами уже было известно, что заряд ядра примерно равен половине атомной массы и, следовательно, близок к порядковому номеру элемента. Поскольку испускание характеристического рентгеновского излучения является следствием электрических процессов в атоме, Мозли сделал вывод, что найденная в его опытах константа атомов, определяющая длину волны характеристического рентгеновского излучения и совпадающая с порядковым номером элемента͵ должна быть только зарядом атомного ядра (закон Мозли).
Рис. 2.1. Рентгеновские спектры атомов соседних элементов, полученные Мозли
Измерение длин волн рентгеновского излучения выполняется с большой точностью, так что на базе закона Мозли принадлежность атома к химическому элементу устанавливается абсолютно надежно. Вместе с тем тот факт, что константа Z в последнем уравнении является зарядом ядра, хотя и обоснован косвенными экспериментами, в конечном счете держится на постулате – законе Мозли. По этой причине после открытия Мозли заряды ядер многократно измерялись в опытах по рассеянию α-частиц на базе закона Кулона. В 1920 году Чедвиг усовершенствовал методику измерения доли рассеянных α-частиц и получил заряды ядер атомов меди, серебра и платины (см. таблицу 2.1). Данные Чедвига не оставляют сомнений в справедливости закона Мозли. Помимо указанных элементов в экспериментах были определены также заряды ядер магния, алюминия, аргона и золота.
Таблица 2.1. Результаты опытов Чедвика
| Элемент | Порядковый номер Z | Заряд Z из эксперимента |
| Cu | 29,3 | |
| Ag | 46,3 | |
| Pt | 77,4 |
Определения. После открытия Мозли стало ясно, что основной характеристикой атома является заряд ядра, а не его атомная масса, как это предполагали химики 19 века, ибо заряд ядра определяет число атомных электронов, а значит, химические свойства атомов. Причина различия атомов химических элементов как раз и состоит в том, что их ядра имеют разное число протонов в своем составе. Напротив, разное число нейтронов в ядрах атомов при одинаковом числе протонов никак не меняет химические свойства атомов. Атомы, различающиеся только числом нейтронов в ядрах, называются изотопами химического элемента.
Атом с определенным числом протонов и нейтронов в составе ядра принято называть нуклидом. Состав ядра задается числами Z и A. Об изотопе говорят только имея ввиду принадлежность к химическому элементу, к примеру, 235U есть изотоп урана, но 235U – делящийся нуклид, а не делящийся изотоп.
Атомы, ядра которых содержат одинаковое число нейтронов, но разное число протонов, называются изотонами. Атомы с одинаковыми массовыми числами, но различным протон-нейтронным составом ядер, называются изобарами.
referatwork.ru
Заряд, масса, размер и состав атомного ядра
Исследуя прохождение α-частицы через тонкую золотую фольгу (см. п. 6.2), Э. Резерфорд пришёл к выводу о том, что атом состоит из тяжёлого положительного заряженного ядра и окружающих его электронов.
Ядром называется центральная часть атома, в которой сосредоточена практически вся масса атома и его положительный заряд.
В состав атомного ядра входят элементарные частицы: протоны и нейтроны (нуклоны от латинского слова nucleus – ядро). Такая протонно-нейтронная модель ядра была предложена советским физиком в 1932 г. Д.Д. Иваненко. Протон имеет положительный заряд е+=1,06·10–19 Кл и массу покоя mp = 1,673·10–27кг = 1836me. Нейтрон (n) – нейтральная частица с массой покоя mn = 1,675·10–27кг = 1839me (где масса электрона me, равна 0,91·10–31кг). На рис. 9.1 приведена структура атома гелия по представлениям конца XX - начала XXI в.
Заряд ядра равен Ze, где e – заряд протона, Z– зарядовое число, равное порядковому номеру химического элемента в периодической системе элементов Менделеева, т.е. числу протонов в ядре. Число нейтронов в ядре обозначается N. Как правило Z > N.
В настоящее время известны ядра с Z = 1 до Z = 107 – 118.
Число нуклонов в ядре A = Z + N называется массовым числом. Ядра с одинаковым Z, но различными А называются изотопами. Ядра, которые при одинаковом A имеют разные Z, называются изобарами.

Рис. 9.1
Ядро обозначается тем же символом, что и нейтральный атом  , где X – символ химического элемента. Например: водород Z = 1 имеет три изотопа:
, где X – символ химического элемента. Например: водород Z = 1 имеет три изотопа:  – протий (Z = 1, N = 0),
– протий (Z = 1, N = 0),  – дейтерий (Z = 1, N = 1),
– дейтерий (Z = 1, N = 1),  – тритий (Z = 1, N = 2), олово имеет 10 изотопов и т.д. В подавляющем большинстве изотопы одного химического элемента обладают одинаковыми химическими и близкими физическими свойствами. Всего известно около 300 устойчивых изотопов и более 2000 естественных и искусственно полученных радиоактивных изотопов.
– тритий (Z = 1, N = 2), олово имеет 10 изотопов и т.д. В подавляющем большинстве изотопы одного химического элемента обладают одинаковыми химическими и близкими физическими свойствами. Всего известно около 300 устойчивых изотопов и более 2000 естественных и искусственно полученных радиоактивных изотопов.
Размер ядра характеризуется радиусом ядра, имеющим условный смысл ввиду размытости границы ядра. Ещё Э. Резерфорд, анализируя свои опыты, показал, что размер ядра примерно равен 10–15 м (размер атома равен 10–10 м). Существует эмпирическая формула для расчета радиуса ядра:
 , , |
(9.1.1) |
где R0 = (1,3 – 1,7)·10–15м. Отсюда видно, что объём ядра пропорционален числу нуклонов.
Плотность ядерного вещества составляет по порядку величины 1017 кг/м3 и постоянна для всех ядер. Она значительно превосходит плотности самых плотных обычных веществ.
Протоны и нейтроны являются фермионами, т.к. имеют спин ħ/2.
Ядро атома имеет собственный момент импульса – спин ядра:
 , , |
(9.1.2) |
где I – внутреннее (полное) спиновое квантовое число.
Число I принимает целочисленные или полуцелые значения 0, 1/2, 1, 3/2, 2 и т.д. Ядра с четными А имеют целочисленный спин (в единицах ħ) и подчиняются статистике Бозе–Эйнштейна (бозоны). Ядра с нечетными А имеют полуцелый спин (в единицах ħ) и подчиняются статистике Ферми–Дирака (т.е. ядра – фермионы).
Ядерные частицы имеют собственные магнитные моменты, которыми определяется магнитный момент ядра  в целом. Единицей измерения магнитных моментов ядер служит ядерный магнетонμяд:
в целом. Единицей измерения магнитных моментов ядер служит ядерный магнетонμяд:
 . . |
(9.1.3) |
Ядерный магнетон в mp/me = 1836,5 раз меньше магнетона Бора, отсюда следует, что магнитные свойства атомов определяются магнитными свойствами его электронов.
Между спином ядра  и его магнитным моментом имеется соотношение:
и его магнитным моментом имеется соотношение:
 , , |
(9.1.4) |
где γяд – ядерное гиромагнитное отношение.
Нейтрон имеет отрицательный магнитный момент μn ≈ – 1,913μяд так как направление спина нейтрона и его магнитного момента противоположны. Магнитный момент протона положителен и равен μр ≈ 2,793μяд. Его направление совпадает с направлением спина протона.
Распределение электрического заряда протонов по ядру в общем случае несимметрично. Мерой отклонения этого распределения от сферически симметричного является квадрупольный электрический момент ядра Q. Если плотность заряда считается везде одинаковой, то Q определяется только формой ядра. Так, для эллипсоида вращения
 , , |
(9.1.5) |
где b – полуось эллипсоида вдоль направления спина, а – полуось в перпендикулярном направлении. Для ядра, вытянутого вдоль направления спина, b > а и Q > 0. Для ядра, сплющенного в этом направлении, b < a и Q < 0. Для сферического распределения заряда в ядре b = a и Q = 0. Это справедливо для ядер со спином, равным 0 или ħ/2.
Для просмотра демонстраций щелкните по соответствующей гиперссылке: Деление ядер. Радиоактивность. Атомная электростанция.ens.tpu.ru
Атомное ядро: заряд ядра
Из планетарной модели строения атомов нам известно, что атом представляет собой ядро, и вращающееся вокруг него облако электронов. Причем расстояние между электронами и ядром в десятки и сотни тысяч раз больше, чем размер самого ядра.
Что же представляет собой само ядро? Это маленький твердый неделимый шарик или оно состоит из более мелких частиц? Ни один существующий в мире микроскоп не в состоянии наглядно показать нам, что происходит на таком уровне. Там все слишком маленькое. Тогда как быть? Возможно ли вообще изучить физику атомного ядра? Как узнать состав и характеристики атомного ядра, если исследовать его нет возможности?
Заряд ядра атома
Самыми разнообразными косвенными опытами, высказывая гипотезы и проверяя их на практике, путем проб и ошибок, ученым удалось исследовать строение атомного ядра. Оказалось, что ядро состоит из еще более мелких частиц. От количества этих частиц зависит размер ядра, его заряд и химические свойства вещества. Причем частицы эти обладают положительным зарядом, что и компенсирует отрицательный заряд электронов атома. Частицы эти назвали протонами. Их количество в нормальном состоянии всегда равно количеству электронов. Вопрос, как определить заряд ядра, больше не стоял. Заряд ядра атома в нейтральном состоянии всегда равен числу вращающихся вокруг него электронов и противоположен по знаку заряду электронов. А определять количество и заряд электронов физики уже научились.
Строение атомного ядра: протоны и нейтроны
Однако в процессе дальнейших исследований возникла новая проблема. Оказалось, что протоны, обладая одинаковым зарядом, в некоторых случаях вдвое различаются по массе. Это вызвало множество вопросов и не состыковок. В конце концов, удалось установить, что в состав атомного ядра, кроме протонов входят еще некие частицы, практически равные протонам по массе, однако не обладающие никаким зарядом. Частицы эти назвали нейтронами. Обнаружение нейтронов разрешило все не состыковки в расчетах. В итоге протоны и нейтроны, как составляющие элементы ядра получили название нуклонов. Расчет любых значений, касающихся характеристик ядра, стал значительно более простым понятным. В образовании заряда ядра нейтроны участия не принимают, поэтому влияние их на химические свойства вещества практически не проявляется, однако нейтроны участвуют в образовании массы ядер, соответственно, влияют на гравитационные свойства ядра атома. Таким образом, присутствует некоторое косвенное влияние нейтронов на свойства вещества, но оно крайне незначительно.
Нужна помощь в учебе?
 Предыдущая тема: Планетарная модель атома: опыт Резерфорда Следующая тема:   Ядерные реакции: деление ядер
Предыдущая тема: Планетарная модель атома: опыт Резерфорда Следующая тема:   Ядерные реакции: деление ядерВсе неприличные комментарии будут удаляться.
www.nado5.ru
Строение и заряд ядра атома
То, что все предметы состоят из элементарных частиц, предполагали еще ученые Древней Греции. Но ни доказать этот факт, ни опровергнуть в те времена не было никакой возможности. Да и о свойствах атомов в древности могли лишь догадываться, основываясь на собственных наблюдениях за различными веществами.
 Доказать, что все вещества состоят из элементарных частиц, удалось лишь в 19-м веке и то косвенно. В это же время физики и химики по всему миру пытались создать единую теорию элементарных частиц, описывающую их строение и объясняющую различные свойства, такие, например, как заряд ядра.
Доказать, что все вещества состоят из элементарных частиц, удалось лишь в 19-м веке и то косвенно. В это же время физики и химики по всему миру пытались создать единую теорию элементарных частиц, описывающую их строение и объясняющую различные свойства, такие, например, как заряд ядра.
Изучению молекул, атомов и их строения были посвящены труды многих ученых. Физика постепенно перешла в изучение микромира - элементарных частиц, их взаимодействия и свойств. Ученые стали интересоваться, из чего состоит атомное ядро, выдвигать гипотезы и пытаться их доказать, хотя бы косвенно.
В результате в качестве базовой теории была принята планетарная модель строения атома, предложенная Эрнестом Резерфордом и Нильсом Бором. Согласно этой теории, заряд ядра любого атома положительный, в то время как по его орбитам вращаются отрицательно заряженные электроны, в итоге делая атом электрически нейтральным. Со временем данная теория была многократно подтверждена разного рода экспериментами, начиная с опытов одного из ее соавторов.
 Современная ядерная физика считает теорию Резерфорда-Бора фундаментальной, все исследования атомов и их элементов основываются на ней. С другой стороны большинство гипотез, появившихся за последние 150 лет, практически так и не были подтверждены. Получается, что ядерная физика в своем большинстве является теоретической ввиду сверхмалых размеров изучаемых объектов.
Современная ядерная физика считает теорию Резерфорда-Бора фундаментальной, все исследования атомов и их элементов основываются на ней. С другой стороны большинство гипотез, появившихся за последние 150 лет, практически так и не были подтверждены. Получается, что ядерная физика в своем большинстве является теоретической ввиду сверхмалых размеров изучаемых объектов.
Конечно же, в современном мире определить заряд ядра алюминия, например (или любого другого элемента) намного проще, чем в 19-м веке и тем более — в Древней Греции. Но делая новые открытия в данной области, ученые порой приходят к удивительным заключениям. Пытаясь найти решение одной задачи, физика элементарных частиц сталкивается с новыми проблемами и парадоксами.
 Изначально теория Резерфорда говорит о том, что химические свойства вещества зависят от того, каков заряд ядра его атома и, как следствие, от числа электронов, вращающихся по его орбитам. Современная химия и физика в полной мере подтверждают данную версию. Несмотря на то, что изучение структуры молекул изначально отталкивалось от простейшей модели — атома водорода, заряд ядра которого равен 1, теория в полной мере распространяется на все элементы таблицы Менделеева, включая редкоземельные металлы и радиоактивные вещества, полученные искусственным путем в конце прошлого тысячелетия.
Изначально теория Резерфорда говорит о том, что химические свойства вещества зависят от того, каков заряд ядра его атома и, как следствие, от числа электронов, вращающихся по его орбитам. Современная химия и физика в полной мере подтверждают данную версию. Несмотря на то, что изучение структуры молекул изначально отталкивалось от простейшей модели — атома водорода, заряд ядра которого равен 1, теория в полной мере распространяется на все элементы таблицы Менделеева, включая редкоземельные металлы и радиоактивные вещества, полученные искусственным путем в конце прошлого тысячелетия.
Любопытно, что еще задолго до исследований Резерфорда английский химик, врач по образованию Вильям Проут заметил, что удельный вес различных веществ кратен данному показателю водорода. Он тогда предположил, что все иные элементы попросту состоят из водорода на каком-то простейшем уровне. Что, например, частица азота — это 14 таких минимальных частиц, кислорода - 16 и т. д. Если рассматривать данную теорию глобально в современной интерпретации, то в целом она верна.
fb.ru
Заряд ядра - Справочник химика 21
Массовое число и порядковый номер элемента (число протонов) обозначают числовыми индексами слева от символа химического элемента верхний индекс означает массовое число, нижний — заряд ядра. [c.9]Записать электронные формулы атамов элементов с зарядом ядра а) 8 б) 13 в) 1электронами валентных орбиталей этих атомов. [c.44]
Атом представляет собой сложную микросистему находящихся в движении элементарных-частиц. Он состоит из положительно заряженного ядра и отрицательно заряженных электронов. Носителем положительного заряда ядра является п ротон. В ядра атомов всех элементов, за исключением ядра легкого изотопа водорода, входят протоны и н е й тр о к ы. Основные характеристики электрона, протона и нейтрона приведены в табл. 1. [c.8]Величина заряда ядра получила название порядкового номера элемента, или атомного номера. Сразу же стало понятно, что, располагая элементы в порядке увеличения атомной массы, Менделеев по сути дела расположил элементы в порядке возрастания их атомных номеров. О тех двух случаях, когда он поместил атомы с большей массой впереди атомов с меньшей массой (см. гл. 8), поскольку эти атомы с меньшей массой тем не менее имеют больший порядковый номер, мы будем говорить особо. [c.156]
При дальнейшем возрастании эффективного заряда ядра у еле-дующего после кальция элемента — скандия состояние Зd становится энергетически более выгодным, чем 4р. [c.27]
Еще в 1920 г. Чедвик экспериментально доказал равенство заряда ядра па-рядковому номеру элемента.— Прим. перев. [c.154]
Изменение атомных и ионных радиусов в периодической системе имеет периодический характер (рис. 17). В периодах атомные и ионные радиусы по мере увеличения заряда ядра в общем уменьшаются. Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, так как у них происходит заполнение внешнего электронного слоя. В больших же периодах в пределах семейств й- и /-элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называется соответственно й- и -сжатием. [c.38]
На этом этапе, наконец, стало возможным заменить определение элемента, данное Бойлем. Согласно Бойлю, элемент — это вещество, которое нельзя разложить на более простые вещества, новое определение элемента звучит так элемент — это совокупность атомов с одинаковым зарядом ядра. [c.156]
У следующих за лантаном 14 элементов (Се—Ьи) вследствие роста эффективного заряда ядра 4/-состояние энергетически более выгодное, чем 5 -состояние (рис. 11). Поэтому у этих элементов происходит заполнение 4/-орбитали (второй снаружи квантовый слой). Затем продолжается заполнение 5 -орбитали (НГ—Hg). И этот период завершается шестью 5-элементами (Т1—Ни). Таким образом, в 6-м периоде кроме двух 5-элементов, десяти -элементов и шести р-элементов располагаются еще четырнадцать -элементов. [c.28]
Химический элемент — это вид атомов, характеризующихся определенным зарядом ядра. [c.7]
Связь между атомами разных элементов всегда более или менее полярна, что обусловлено различием размеров и электроотрица-т(льностей атомов. Например, в молекуле хлорида водорода НС1 стязующее электронное облако смещено в сторону более электро-огрицательного атома хлора. Вследствие этого заряд ядра водорода уже не компенсируется, а на атоме хлора электронная плотность становится избыточной по сравнению с зарядом ядра. Иными словами, атом водорода в НС1 поляризован положительно, а атом хлора отрицательно на атоме водорода возникает положительный заряд, на атоме хлора — отрицательный. Этот заряд б, называемый эффективным, можно установить экспериментально. Согласно имеющимся данным эффективный заряд на атоме водорода молекулы H I составляет бн = +0,18, а на атоме хлора 6 i = —0>18 абсолютного за-р 1да электрона. Можно сказать, что связь в молекуле НС1 имеет на 18% ионный характер, т. е. полярна. Ниже приведены значения эффективных зарядов на атомах кислорода в оксидах элементов 3-го периода [c.80]
Зависимость атомных радиусов от заряда ядра атома 2 имеет периодический характер, В пределах одного периода с увеличением 2 проявляется тенденция к уменьшению размеров атома, что особенно четко наблюдается в коротких периодах (радиусы атомов приведены в нм) [c.99]
Изложенное показывает, что по мере роста заряда ядра происходит закономерная периодическая повторяемость сходных электронных структур, а следовательно, и повторяемость свойств элементов. [c.28]
В настоящее время периодический закон формулируется следующим образом свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов. [c.28]
В подгруппах элементов радиусы атомов и однотипных ионов в общем увеличиваются. Однако увеличение радиусов при том же возрастании заряда ядра в подгруппах 5- и р-элементов больше такового в подгруппах -элементов, например в V группе [c.38]
Ес. 1и бы не было влияния кристаллического поля, то радиусы ионов должны были бы монотонно уменьшаться по мере увеличения заряда ядра (порядкового номера элемента), что на рис. 211 показано пунктирной кривой. Она проходит через точки, соответствующие сферически симметричным ионам Са2+ ( ), Мп2+ 2п2- - ( 10). [c.509]
Период полураспада трансурановых элементов быстро уменьшается с ростом заряда ядра. Так, для наиболее устойчивого изотопа Ри период полураспада составляет 70 млн. лет, Вк — 7000 лет, Ез — 2 года, Мс1 — 80 дней. Для изотопов Ки период полураспада оценивается в 70—0,1 с, для 105-го элемента 40— 1,5 с. [c.664]
Потому что 1) прн переходе от Ве к В возрастает заряд ядра 2) электронные конфигурации с полностью заполненным подуровнем обладают повышенной устойчивостью 3) при переходе от Ве к В уменьшается размер атома. [c.47]
Приводимые в этом разделе химические символы обозначают не атомы элементов, а их ядра. Нижний индекс указывает заряд ядра, численно совпадающий с но.мером элемента в периодической системе элементов, верхний — массовое число А, представляющее собой сумму 2 + Л/, где 2 — число протонов (р) в ядре, определяющее заряд ядра, а М-—число нейтронов (п) в ядре. Ядра всех атомов данного элемента имеют одинаковый заряд, т. е. содержат одно и то же число протонов число нейтронов может быть различным. [c.47]
Электроны наружного слоя, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженными положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот, атомы, присоединившие [c.99]
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Это иллюстрируется следующими примерами (радиусы ионов даны в нм) [c.100]
Английский физик Чарльз Гловер Баркла (1877—1944) сделал следующий важный шаг. Он установил, что при рассеивании рентгеновских лучей различными элементами образуются пучки рентгеновских лучей, которые проникают в вещество на характеристические величины. Каждый элемент создает особый набор рентгеновских лучей. В трубке Крукса источником таких рентгеновских лучей становился под действием пучка катодных лучей антикатод (который изготавливали из различных металлов). Другой английский физик, Генри Гвин Джефрис Мозли (1887—1915), используя в качестве антикатода различные элементы, в 1913 г. установил, что чем больше атомная масса элемента, тем меньше длина волны образующихся рентгеновских лучей. Эта обратная зависимость, доказывал Мозли, связана с величиной положительного заряда ядра атома. Чем больше заряд, тем короче длина волны рентгеновских лучей. [c.156]
Исходя из длины волны, можно вычислить заряд ядра атома любого элемента. Таким образом в итоге удалось показать, что згряд ядра водорода равен +1, гелия +2, лития +3 и так далее вплоть до урана , заряд ядра которого равен +92. [c.156]
Характер заполнения орбиталей атомов К, Са, и Зс показывает, что энергия электронов зависит не только от заряда ядра, но и от взаимодействия между электропами. На рис. 11 показана зависимость энергии атомных орбиталей от порядкового номера элемента (логарифмическая шкала). За единицу энергии электрона принято значение 13,6 эВ (энергия электрона пенозбуждеиного атО ма водорода). Анализ рис. II показывает, что с уаеличениеу порядкового но мера эле мента Z энергия электронов данного состояния (1,5, 2 , 2/ и т. д.) уменьшается. Одпако характер этого уменьшения для электронов разных энергетических состояний различен, что выражается в пересечении хода кривых. В частности, поэтому при Л = 19 и 20 кривые энергии 45-электрона лежат ниже кривой энергии З -электрона, а при 2 =. 21 кривая энергии Зсг-электрона лежит ииже к(1Ивой 4/7-электрона. Таким образом, у калия и кальция заполняется 4х-орби аль, а у скандия 3 /-орбиталь. [c.27]
Наряду с резко выраженными максимумами и минимумами на кривой энергии ионизации наблюдаются слабо выраженные, что можно объяснить с помощью двух взаимосвязанных представлений об экранировании заряда ядра и о пронгкновении электронов к ядру. [c.32]
Э( х )ект экранирования заряда ядра обусловлен наличием в атоме между данным электроном и ядром других электронов, которые экранируют, ослабляют воздействие на этот электрон положительного заряда ядра и тем самым ослабляют связь его с ядром. Понятно, чтб экранирование возрастает с увеличением числа внут-эенних электронных слоев. [c.32]
Уменьшение энергии ионизации в подгруппах 5- и р-элементов объясняется усиливающимся (по мере увеличения числа электронных слоев) экранированием заряда ядра электронами, предшествующими внешиим электронам. [c.35]
При позитронном распаде заряд ядра уменьшается на единицу, а массовое число (как и при Р -распаде) не изменяется. Примером р""-заспада является превраш,ение легкого изотопа углерода-И в изотоп бора-11 [c.658]
Наибольшие изменения исходного ядра наблюдаются при альфа-оаспаде. Выделение ядром а-частицы (ядра гелия-4) приводит к об-зазованию изотопа элемента с зарядом ядра на две единицы меньше 1СХ0ДН0Г0. Массовое число при этом уменьшается на четыре единицы. а-Распад наиболее характерен для тяжелых элементов, например для изотопа урана-234 [c.658]
При прочих равных условиях потенциал нонизации тем больше, чем больше заряд ядра и меньше радиус атома или иона. С этой точки зрения в периоде с ростом заряда ядра должна наблюдаться тенденция к возрастанию потенциала иоиизацни (при удалении электрона с одним н тем же главным квантовым числом). Действительно, значения и /2 для Ве меньше, чем соответствующие значения для С. [c.43]
Атомы, обладающие одинаковым зарядом ядра, по разными массои1)1ми числами, называются изотопами (например, С и [c.48]
Решение. Заряд ядра атома искомого элемента 92 численно совпадает с номером элемента п псриояптеском снстемс. Элемент Л 92 — урап, символ — и. [c.48]
Число элсктронон в атоме равно заряду ядра в данном случае число электронов равно 92. [c.48]
Это открытие дало повое обоснование расположению элементов в периодической системе. Вместе с тем оно устраняло и кажущееся противоречие в системе Менделеева — положение некоторых элементов с большей атомной массой впереди элементов с меньшей атомной массой (теллур и иод, аргон и калнй, кобальт и никель). Оказалось, что противоречия здесь нет, так как место элемента в системе определяется зарядом атомного ядра. Было экспериментально установлено, что заряд ядра атома теллура равен 52, а атома иода—53 поэтому теллур, несмотря иа большую атомную массу, должен стоять впереди иода. Точно так же заряды ядер аргона и калия, никеля и кобальта полностью отвечают по-следоиатольмостп расположения этих элементов в системе. [c.61]
Упомянутые выше нарушения нормального порядка заполнения энергетических состояний в атомах лантана (появление Ъс1-, а не 4/-электрона) и керня (появление сразу двух 4/-электр(люи) и аналогичные особенности в построении электронных структур атомов элементов седьмого периода объясняются следующим. При увеличении заряда ядра электростатическое притяжение к ядру электрона, находящегося на данном энергетическом подуровне, становится более сильным, и энергия электрона уменьшается. При этом энергия электронов, находяншхся на разных подуровнях, иэмеипстся неодинаково, поскольку по отношению к этим электронам заряд ядра экранируется в разной степени. В частности, энергия 4/-электронов уменьшается с ростом заряда ядра более резко, чем энергия 5 -электроиов. (см. рис. 24). Поэтому оказывается, что у лантана (2 = 57) энергия 5с электронов ниже, а у церия (2 = 58) выше, чем энергия 4/-электронов. В соответствии с этим, элек- [c.98]
Распад. --Частица — электрон. р -Распаду предшествует процесс Че + р, протекающий в ядре таким обраяом, при испускании электрона заряд ядра увеличивается на единицу, а массовое число ие изменяется. Дочернее ядро — изобар исходного—принадлежит элементу, смещеино.му на одну клетку к концу периодической системы от места матсрниского элемента Э Че . [c.49]
Электронный захват. При захвате ядром электрона с ближайшего к ядру /(-слоя в ядре уменьшается число протонов вследствие протекания процесса /7 + е" = я. Заряд ядра уменьшается на единицу, а массовое число остается прежним. Дочернее ядро принадлежит элементу (изобару исходного элемента), смещенному по отнои1епию к материнскому на одну клетку к началу периодической системы элементов лэ + Ое- лэ + /гу. [c.49]
Ял )о атома некоторого элемента содержит 16 нейтронов, а электронная оболочки этого атома — 15 эле]гг110П0в. Назвать элемент, изотопом ь оторого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа. [c.51]
Был установлен физический смысл порядкового номера элемента в периодической системе порядковый номер оказа.лся важнейшей константой элемента, выралсаюш ей положительный заряд ядра его атома. Из электронейтральности атома следует, что и число вращающихся вокруг ядра электронов равно порядковому номеру элемента. [c.61]
Свойстна элементов а образуемых ими простых и сложных веществ ниходятсп в периодической зависимости от заряда ядра атомов элементов. [c.61]
Наиболее устойчивое состояние электрона в атоме соответствует минимальному возможному значению его энергии. Любое другое его состояние является в о з б у ж д е и н ы м, неустсзйчнвым нл него электрон самопроизвольно переходит в состояние с более иизкои энергией. Поэтому в невозбужденном атоме водорода (заряд ядра 2 = 1) единственный электрон нахо.днтся в самом низком из возможных энергетических состояний, т. е. на 15-подуровне.. Электронную структуру атома водорода мо кно представит ) схемой [c.88]
Прн увеличении заряда ядра еще иа единицу, т. е. прн переходе к углероду (Z = 6), ЧИСЛО электронов на 2 -подуровне возрастает до 2 электронное строение атома углерода выражается формулой ls 2,s 2p . Однако этой формуле могла бы соогиетсгво-вать любая из трех схем [c.90]
Последовательность заполнения атомных электронных орбита-лей в зависимости от значений главного и орбитального квантовых чисел была исследована советским ученым В. М. Клечков-ским, который установил, что энергия эле[орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (л + /) к орбиталям с большим значением этой суммы. [c.93]
С началом застронки нового электронного слоя, более удален ного от ядра, т. е. при переходе к следующему периоду, атомные радиусы возрастают (сравните, например, радиусы атомов фтора и натрия). В результате в пределах подгруппы с возрастанием заряда ядра размеры атомов увеличиваются. Приведем в качестве примера значения атомных радиусов (в нм) элементов некоторых главных подгрупп [c.99]
chem21.info











