Электронно-графическая формула натрия и его свойства. Гафний электронно графическая формула
Электронные и электронно-графические формулы атомов элементов. Правило Хунда
Электронные формулы фиксируют занятые электронами уровни и подуровни и количество электронов на них. В электронных формулах используется обозначение уровней и подуровней, т.е. первым, цифровым символом обозначают уровень (номер), а вторым буквенным символом (s, p, d, f) обозначают подуровни. Число электронов на подуровне обозначают верхним первым индексом.
Например: 1Н 1S , для азота N 7 1S2 2S2 2p3
Электронно-графические формулы изображают атом в виде совокупности орбиталей, которые называют квантовыми ячейками. Например, для азота 1S2 2S2 2p3
S-подуровень
n =1, l=0, m=0
S
S= -1/2 S = +1/2
n =2
P-подуровень, l=1 m=-1,m=0,m=+1
Заполнение орбиталей – ячеек электронами осуществляется в соответствии с принципом Паули, минимизация энергии и правилами Хунда
При данном значении l электроны в атоме располагаются так, что суммарное спиновое число их максимально.
∑S = 1/2+ 1/2+1/2 =3/2
Если заполнили так, т.е. s = +1/2 s = - 1/2, спаренные электроны
∑s= 1/2 + (-1/2) + 1/2 =1/2
Химические свойства атомов определяются в основном строением наружных электронных уровней, которые называются валентными.
Заполненные энергетические подуровни, соответствующие электронным структурам атомов благородных газов, называют электронным остовом. Например: для натрия, имеющего электронную формулу 1S 22S2 2p6 благородного газа неона. Сокращенно электронную формулу благородного газа обозначают его химическим символом в квадратных скобках, например: 1S2 2S2 2p6 = [Ne]
Это позволяет упростить запись электронных формул, например для калия вместо 1S 22S2 2p6 3S2 3p6 4S1 можно написать [Ar] 4S1. Одновременно эта запись наглядно выделяет валентные электроны, определяющие химические свойства атомов элемента.
В электронно-графических (структурных) формулах в отличие от электронных изображают не только заполненные, но и вакантные орбитали валентных подуровней. Это позволяет предсказать изменение валентности элемента в результате перехода его атома в возбужденное состояние, что обозначают символом соответствующего элемента со звездочкой.
Например: 15P * [Ne] 3S2 3P3 n=3 ↓↑ S ↓↓↓ P
В невозбужденном состоянии атом фосфора имеет три неспаренных электрона на p-подуровне. При переходе атома в возбужденное состояние электронная пара s-подуровня может разделиться, и один из электронов с S- подуровня может переходить на d-подуровень. Валентность фосфора при этом меняется с трех в основном состоянии до пяти в возбужденном состоянии.
Контрольные вопросы
1 Какие элементарные частицы входят в состав атома?
2 Что такое электрон, протон, нейтрон?
3 Объясните, почему у многих элементов при одном и том же заряде ядра атома могут быть разные массовые числа. Почему у ряда элементов, например у хлора, нецелочисленные атомные массы?
4 Дайте характеристику квантовым числам. Почему в атоме не могут быть два электрона с одинаковыми квантовыми числами? Принцип Паули.
5 Объясните физический смысл графических изображений
S и р-орбиталей: S p
6 Изобразите электронно-структурные формулы атомов углерода, азота и кислорода. Подсчитайте суммы спиновых квантовых чисел электронов в этих атомах. Как изменяются эти суммы при нарушении правила Хунда.
7 Напишите электронную и электронно-структурную формулу атома бора. Какую дополнительную информацию содержит электронно-структурная формула по сравнению с электронной.
8 Правило Клечковского. Какой энергетический уровень и подуровень заполняется вперед 4S или 3d, 5S или 4p, 4f или 6p?
9 Какое основное отличие р-орбиталей от d-орбиталей?
10 Какое число электронов может находиться в энергетических состояниях 2S, 3p, 3d, 5f?
11 Опишите форму орбитали, характеризующейся квантовыми числами: а) n=3, 1=0, m=0 ; б) n=3, 1=1, m=0+1-1; в) n=3, 1=2, m=0+1-1+2-2 Приведите символы орбиталей
12 Охарактеризуйте набором квантовых чисел каждую из следующих орбиталей: 1S, 2p, 3d.
13 Сформулируйте правила, которыми определяется число орбиталей и электронов данного электронного слоя. Например 1=0,1,2 n=1,2,3
14 Какова максимальная емкость электронных слоев К, М, L, N?
15 Зависит ли число орбиталей с данным значением 1 от номера энергетического уровня? Приведите буквенные обозначения орбиталей с указанными значениями 1.
Рекомендуемая литература
Основная
1 Хомченко Г.П., Цитович И.К. Неорганическая химия. М.: Высшая школа, 1998, глава 2, стр 53-75
2 Князев Д.А., Смарыгин С.Н. Неоганическая химия. М.: Высшая школа, 1990, глава 10, стр 102 -112
Дополнительная
3 Глинка Н.Л. Общая химия.(Под ред. А.И.Ермакова, - 28-е изд., перераб. и доп. – М.; Интеграл-Пресс, 2000 – 728с.)
4 Глинка Н.Л. Задачи и упражнения по общей химии. М.;1988.
5 Павлов Н.Н Теоретические основы общей химии. М.,Высшая химия 1978.
megaobuchalka.ru
Электронная формула химических элементов
Что такое электронная формула
Наиболее часто электронные формулы записывают для атомов в основном или возбужденном состоянии и для ионов.
Существует несколько правил, которые необходимо учитывать при составлении электронной формулы атома химического элемента. Это принцип Паули, правила Клечковского или правило Хунда.
При составление электронной формулы следует учитывать, что номер периода химического элемента определяет число энергетических уровней (оболочек) в атоме, а его порядковый номер количество электронов.
Согласно правилу Клечковского, заполнение энергетических уровней происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n:
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 5d ≈ 4f < 6p и т.д.
Так, значению n + l = 5 соответствуют энергетические подуровни 3d (n = 3, l=2), 4d (n=4, l=1) и 5s (n=5, l =0). Первым из этих подуровней заполняется тот, у которого ниже значение главного квантового числа.
Поведение электронов в атомах подчиняется принципу запрета, сформулированному швейцарским ученым В. Паули: в атоме не может быть двух электронов, у которых были бы одинаковыми все четыре квантовых числа. Согласно принципу Паули, на одной орбитали, характеризуемой определенными значениями трех квантовых чисел (главное, орбитальное и магнитное), могут находиться только два электрона, отличающиеся значением спинового квантового числа. Из принципа Паули вытекает следствие: максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа.
Электронная формула атома
Электронную формулу атома изображают следующим образом: каждому энергетическому уровню соответствует определенное главное квантовое число n, обозначаемое арабской цифрой; за каждой цифрой следует буква, соответствующая энергетическому подуровню и обозначающая орбитальное квантовое число. Верхний индекс у буквы показывает число электронов, находящихся в подуровне. Например, электронная формула атома натрия имеет следующий вид:
11N 1s22s22p63s1.
При заполнение электронами энергетических подуровней также необходимо соблюдать правило Хунда: в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным (это наиболее наглядно отражается при составлении электронно-графических формул).
Примеры решения задач
ru.solverbook.com
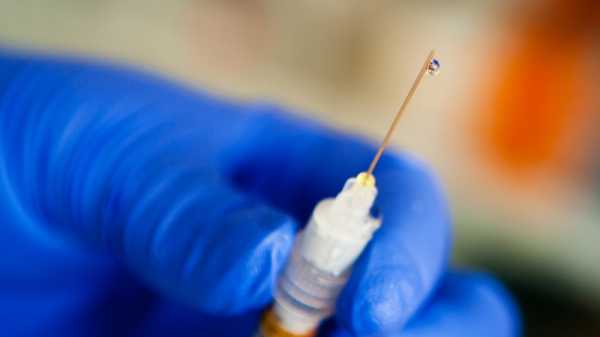
Электронно-графическая формула натрия и его свойства
Многие металлы распространены в природе не только в составе различных горных пород или минералов, но и в свободном – самородном виде. К таким, например, относятся золото, серебро и медь. Однако активные металлические элементы, такие как натрий, электронно-графическую формулу которого мы изучим, не встречаются как простое вещество. Причина заключается в их высокой реакционной способности, приводящей к быстрому окислению вещества кислородом воздуха. Именно поэтому в лаборатории металл сберегают под слоем керосина или технического масла. Химическую активность всех щелочных металлических элементов можно объяснить особенностями строения их атомов. Рассмотрим электронно-графическую формулу натрия и выясним, как ее характеристика отражается на физических свойствах и особенностях взаимодействия с другими веществами.
Атом натрия
Положение элемента в главной подгруппе первой группы периодической системы влияет на строение его электронейтральной частицы. Данная схема иллюстрирует расположение электронов вокруг ядра атома и определяет количество энергетических уровней в нем:
Число протонов, нейтронов, электронов в атоме натрия будет соответственно равно 11, 12, 11. Протонное число и количество электронов определяем по порядковому номеру элемента, а количество нейтральных ядерных частиц будет равным разности между нуклонным числом (атомной массой) и протонным числом (порядковым номером). Для записи распределения отрицательно заряженных частиц в атоме можно воспользоваться следующей электронной формулой: 1s22s22p63s1.
Взаимосвязь между строением атома и свойствами вещества
Свойства натрия как щелочного металла можно объяснить тем, что он относится к s-элементам, его валентность равна 1, а степень окисления +1. Один неспаренный электрон на третьем, последнем, слое обуславливает его восстановительные характеристики. В реакциях с другими атомами натрий всегда отдает собственную отрицательную частицу более электроотрицательным элементам. Например, окисляясь кислородом воздуха, атомы Na становятся положительно заряженными частицами – катионами, входящими в состав молекулы основного оксида Na2O. Данная реакция имеет следующий вид:
4Na +O2 = 2Na2O.

Физические свойства
Электронно-графическая формула натрия и его кристаллическая решетка определяют такие параметры элемента, как агрегатное состояние, температуры плавления и кипения, а также способность проводить тепло и электрический ток. Натрий – это легкий (плотность 0,97 г/см3) и очень мягкий серебристый металл. Наличие в кристаллической решетке свободно движущихся электронов обуславливает высокую тепло- и электропроводность. В природе он встречается в составе таких минералов, как поваренная соль NaCl и сильвинит NaCl × KCl. Натрий является очень распространенным не только в неживой природе, например в составе залежей каменной соли или морской воды морей и океанов. Он, наряду с хлором, серой, кальцием, фосфором и другими элементами, входит в десятку важнейших органогенных химических элементов, образующих живые биологические системы.
Особенности химических свойств
На электронно-графической формуле натрия хорошо видно, что единственный s-электрон, вращающийся на последнем, третьем энергетическом слое атома Na, слабо связан с положительно заряженным ядром. Он легко покидает пределы атома, поэтому натрий в реакциях с кислородом, водой, водородом и азотом ведет себя как сильный восстановитель. Приведем примеры уравнений реакций, типичных для щелочных металлов:
2Na + Н2 = 2NaH;
6Na + N2 = 2Na3N;
2Na + 2Н2O = 2NaOH + h3.

Реакция с водой заканчивается образованием химически агрессивных соединений – щелочей. Гидроксид натрия, еще называемый едким натром, проявляет свойства активных оснований и в твердом состоянии нашел применение в качестве осушителя газов. Металлический натрий в промышленности получают электролизом расплава соли – хлорида натрия или соответствующего гидроксида, при этом на катоде образуется слой металлического натрия.
В нашей статье мы рассмотрели электронно-графическую формулу натрия, а также изучили его свойства и получение в промышленности.
fb.ru
Формула углерода в химии
Атомная масса: 12,0107 а.е.м.
Электронная формула углерода
Электронная формула: 1s2 2s2 2p2
Электронно-графическая формула углерода
Электронно-графическая формула углерода в основном состоянии:
Углерод имеет два неспаренных электрона, проявляет валентность II.
Электронно-графическая формула углерода в возбужденном состоянии:
Углерод имеет четыре неспаренных электрона, проявляет валентность IV.
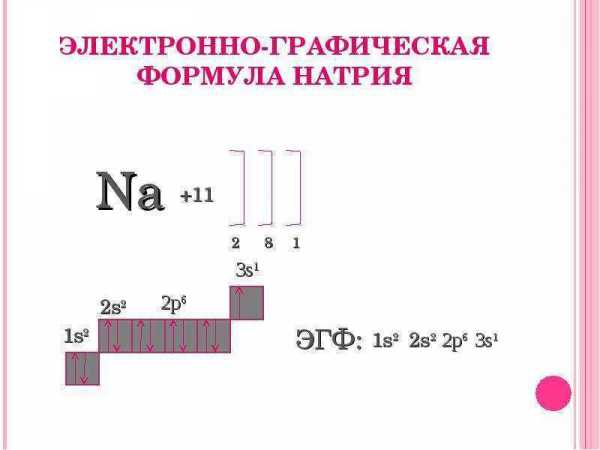
Углерод образует множество аллотропных модификаций, которые очень сильно различаются между собой по внешнему виду, твердости, электропроводности, химической активности и другим свойствам.
Модификации углерода
Среди аллотропных модификаций углерода выделяют кристаллические:
аморфные:

и кластерные формы:

При нормальных условиях термодинамически устойчивым является только графит, а алмаз и другие кристаллические формы – метастабильны.
Большинство аморфных аллотропных форм являются химическими соединениями с высоким содержанием углерода (обычно мелкодисперсного графита), а не чистой аллотропной формой углерода.
Содержание углерода в земной коре составляет 0,023% по массе. Свободный углерод встречается в природе в виде алмаза и графита. Углерод главным образом накапливается в верхней части земной коры, в биосфере. Содержание углерода в живом веществе – 18%,в древесине – 50%, каменном угле – 80%, нефти – 85%, антраците – 96%. Большая часть углерода литосферы сосредоточена в виде карбонатов (известняков и доломитов).
Примеры решения задач
ru.solverbook.com
Как написать электронно-графическую формулу
Чтобы научиться составлять электронно-графические формулы, важно понять теорию строения атомного ядра. Ядро атома составляют протоны и нейтроны. Вокруг ядра атома на электронных орбиталях находятся электроны.
Вам понадобится- ручка;- бумага для записей;- периодическая система элементов (таблица Менделеева).
Спонсор размещения P&G Статьи по теме "Как написать электронно-графическую формулу" Как определить главное квантовое число Как найти квантовые числа Как определить протон, нейтрон, электронИнструкция
1
Электроны в атоме занимают свободные орбитали в последовательности, называемой шкалой энергии:1s / 2s, 2p / 3s, 3p / 4s, 3d, 4p / 5s, 4d, 5p / 6s, 4d, 5d, 6p / 7s, 5f, 6d, 7p. На одной орбитали могут располагаться два электрона с противоположными спинами – направлениями вращения.2
Структуру электронных оболочек выражают с помощью графических электронных формул. Для записи формулы используйте матрицу. В одной ячейке могут располагаться один или два электрона с противоположными спинами. Электроны изображаются стрелками. Матрица наглядно показывает, что на s-орбитали могут располагаться два электрона, на p-орбитали – 6, на d – 10, на f -14.
3
Рассмотрите принцип составления электронно-графической формулы на примере марганца. Найдите марганец в таблице Менделеева. Его порядковый номер 25, значит в атоме 25 электронов, это элемент четвертого периода.4
Запишите порядковый номер и символ элемента рядом с матрицей. В соответствии со шкалой энергии заполоните последовательно 1s, 2s, 2p, 3s, 3p, 4s уровни, вписав по два электрона в ячейку. Получится 2+2+6+2+6+2=20 электронов. Эти уровни заполнены полностью.
5
У вас осталось еще пять электронов и незаполненный 3d-уровень. Расположите электроны в ячейках d-подуровня, начиная слева. Электроны с одинаковыми спинами расположите в ячейках сначала по одному. Если все ячейки заполнены, начиная слева, добавьте по второму электрону с противоположным спином. У марганца пять d-электронов, расположенных по одному в каждой ячейке.
6
Электронно-графические формулы наглядно показывают количество неспаренных электронов, которые определяют валентность. Как простоmasterotvetov.com
Графические электронные формулы - Справочник химика 21
Изобразите графические электронные формулы следующих элементов а) фтора б) фосфора в) калия. [c.27]Напишите графические электронные формулы цинка (N30) и селена (N34). [c.44]
Напишите электронные и графические электронные формулы хлора в степенях окисления —1 0 +1 +3 +5 и +7. [c.129]
Пример 6. Напишите электронные формулы атома бора В, находящегося в нормальном и возбужденном состояниях. Представьте графические электронные формулы для этих двух состояний атома бора. [c.19]
В качестве примера запишем графическую электронную формулу атома азота [c.26]Составляем электронную и графическую электронную формулы атома кислорода [c.34]
Напишите электронные и графические электронные формулы атомов натрия, калия и рубидия. [c.169]
Изобразите электронные и графические электронные формулы атомов титана и ванадия и следующлч ионов титана (II), титана, (1П), титана (IV), ванадия (II), ванадия (IV), ванадия (V). [c.135]
Решение. Запишем электронные и графические электронные формулы атомов углерода и кислорода [c.30]
Как представить графической схемой заполнение электронами атомных орбиталей (графические электронные формулы) [c.18]
Приведите графическую электронную формулу атома железа. Как располагаются -электроны в атоме железа Объясните порядок заполнения -орбиталей. [c.21]
Напишите электронную и графическую электронную формулы атома элемента галлия (элемент №31). Исходя нз положения галлия в периодической системе Д. И. Менделеева, охарактеризуйте его свойства н свойства оксида и гидроксида. У какого элемента — бора или галлия — более выражены металлические свойства [c.148]
Составьте графические электронные формулы ионов Fe и Ре +. Объясните, почему ион Ре + более устойчив, чем Ре +. [c.24]
Чтобы показать распределение электронов по орбиталям, составляем графическую электронную формулу [c.27]
Определите строение электронных оболочек атомов хлора, кислорода и неона. Изобразите их графические электронные формулы. [c.29]
Графические электронные формулы показывают распределение электронов по энергетическим уровням, подуровням и орбиталям. При этом используются следующие обозначения [c.26]
Напишите электронную и графическую электронную формулы элемента, атом которого содержит на Зр-поду ровне два электрона. [c.27]
Графические электронные формулы. Электронные формулы часто изображают графически, используя приведенные выше графические обозначения орбитали и электронов. Графические электронные формулы иока-зывают распределение электронов не только ио уровням и подуровням, но и по орбиталям. [c.43]
В пределах подуровня электроны заполняют максимальное число орбиталей, что видно на примере 2/ -подуровня в графической электронной формуле атома азота. [c.26]
Назовите элементы подгруппы азота и изобразите графические электронные формулы азота и фосфора. [c.203]
Изобразите графические электронные формулы атомов С, N. О, С1 и укажите, в каком порядке заполняются электронами орбитали подуровней [c.52]
Изобразите электронные и графические электронные формулы натрия и рубидия. Какой из этих металлов проявляет более сильные восстановительные свойства [c.122]
Какая из графических электронных формул атома фосфора (невозбужденное состояние) является правильной Ответ мотивируйте с привлечением правила Гунда. [c.97]
Назовите элементы подгруппы кислорода и изобразите графические электронные формулы кислорода и серы. [c.181]
Напишите общие электронную и графическую электронную формулы внешнего энергетического уровня для атомов элементов главной подгруппы четвертой группы периодической системы Д. И. Менделеева. [c.32]
Льюисовыми структурами (валентаыми структурами, валентными схемами) называются графические электронные формулы молекул и комплексных ионов, где для обозначения обобществленных между атомами связьшающих электронных пар (связей) используются прямые линии (валентные штрихи), а для обозначения неподеленных пар электронов используются две точки. Для молекул и комплексных ионов, содержащих только элементы первого и второго периодов, наилучшие льюисовы структуры характеризуются тем, что в них каждый атом окружен таким же числом электронов, как атом благородного газа, ближайшего к данному элементу по периодической системе. Это означает, что атом Н должен быть окружен двумя электронами (одна электронная пара, как у Не), а атомы неметаллических элементов второго периода (В, С, К, О, Г) должны быть окружены восемью электронами (четыре электронные пары, как у 1 е). Поскольку восемь электронов образуют замкнутую конфигуращ1Ю 2х 2р , правило записи льюисовых структур требует окружать каждый атом элемента второго периода октетом (восьмеркой) электронов, и поэтому называется правилом октета. [c.501]
Часто записывают не всю графическую электронную формулу, а лишь ее окончание (т. е. подуровни, на которых расположены валентные электроны), например [c.43]
Очень часто структуру электронных оболочек изображают с помощью квантовых ячеек — это так называемые графические электронные формулы или схемы. Каждая такая ячейка обозначается клеткой клетка — орбиталь, стрелка — электрон, направление стрелки — направление спина, свободная клетка — свободная орбиталь, которую может занимать электрон при возбуждении. Согласно принципу Паули в ячейке может быть один или два электрона (если два, то они спарены). [c.43]
Кроме того, структура электронных оболочек изображается с помощью энергетических или квантовых ячеек (орбиталей) — это так называемые графические электронные формулы. Каждая такая ячейка обозначается прямоугольником [ , электрон направление стрелки характеризует спин электрона. По принципу Паули в ячейке (орбитали) размещается один (неспаренный) или два (спаренных) электрона. Электронную структуру атома натрия можно представить схемой [c.96]
Рассмотрим это положение на примере азота N2. гидразина N2h5, аммиака NH,, аммоний-иона NHi и азотной кислоты HNO3. Схема распределения электронов по орбиталям атома азота представлена на с. 19. Из графической электронной формулы атома азота легко сделать вывод, что поскольку азот и> еет три несп. рен-ных электрона, он может образовывать три химические сиязи. [c.58]
Рассмотрим это положение на примере азота N2, гидразина N2114, аммиака ННз, аммоний-иона и азотной кислоты ННОз. Из графической электронной формулы атома азота легко сделать вывод, что поскольку азот имеет три неспаренных электрона, он может образовьшать три химические связи. Обозначая каждую электронную пару ковалентной связи черточкой, получим структурные формулы для N2, и ННз [c.75]
Очень часто структуру электронных оболочек изображают с помощью энергетических, или квантовых, ячеек — это так называемые графические электронные формулы. Каждая такая ячейка обозначается клеткой клетка — орбиталь, стрелка — электрон, направление стрелки — направление спина , свободная [c.18]
chem21.info
Электронные формулы и электронно-графические схемы
Химия Электронные формулы и электронно-графические схемы
просмотров - 1031
Электронное строение атома можно показать электронной формулой и электронно-графической схемой. В электронных формулах последовательно записываются энергетические уровни и подуровни в порядке их заполнения и общее число электронов на подуровне. При этом состояние отдельного электрона, в частности его магнитное и спиновое квантовые числа, в электронной формуле не отражено. В электронно-графических схемах каждый электрон «виден» полностью, ᴛ.ᴇ. его можно охарактеризовать всеми четырьмя квантовыми числами. Электронно-графические схемы обычно приводятся для внешних электронов.
Пример 1. Напишите электронную формулу фтора, состояние внешних электронов выразите электронно-графической схемой. Сколько неспаренных электронов в атоме этого элемента?
Решение. Атомный номер фтора равен девяти, следовательно, в его атоме имеется девять электронов. В соответствии с принципом наименьшей энергии, пользуясь рис. 7 и учитывая следствия принципа Паули, записываем электронную формулу фтора: 1s22s22p5. Для внешних электронов (второй энергетический уровень) составляем электронно-графическую схему (рис. 8), из которой следует, что в атоме фтора имеется один неспаренный электрон.
Рис. 8. Электронно-графическая схема валентных электронов атома фтора
Пример 2.Составьте электронно-графические схемы возможных состояний атома азота. Какие из них отражают нормальное состояние, а какие – возбужденное?
Решение. Электронная формула азота 1s2s22p3, формула внешних электронов: 2s22p3. Подуровень 2p незавершен, т.к. число электронов на нем меньше шести. Возможные варианты распределения трех электронов на 2р-подуровне показаны на рис. 9.
Рис. 9. Электронно-графические схемы возможных состояний 2р-подуровня в атоме азота.
Максимальное (по абсолютной величине) значение спина (3/2) соответствует состояниям 1 и 2, следовательно, они являются основными, а остальные – возбужденные.
Пример 3.Определите квантовые числа, которыми определяется состояние последнего электрона в атоме ванадия?
Решение. Атомный номер ванадия Z = 23, следовательно, полная электронная формула элемента: 1s22s22p63s23p64s23d3. Электронно-графическая схема внешних электронов (4s23d3) такова (рис. 10),:
Рис. 10. Электронно-графическая схема валентных электронов атома ванадия
Главное квантовое число последнего электрона n = 3 (третий энергетический уровень), орбитальное l = 2 (подуровень d). Mагнитное квантовое число для каждого из трех d-электронов различно: для первого оно равно –2, для второго –1, для третьего – 0. Спиновое квантовое число у всех трех электронов одинаково: ms = +1/2. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, состояние последнего электрона в атоме ванадия характеризуется квантовыми числами: n = 3; l = 2; m = 0; ms = +1/2.
7. Спаренные и неспаренные электроны
Электроны, заполняющие орбитали попарно, называются спаренными, а одиночные электроны называются неспаренными. Неспаренные электроны обеспечивают химическую связь атома с другими атомами. Наличие неспаренных электронов устанавливается экспериментально изучением магнитных свойств. Вещества с неспаренными электронами парамагнитны(втягиваются в магнитное поле благодаря взаимодействию спинов электронов, как элементарных магнитов, с внешним магнитным полем). Вещества, имеющие только спаренные электроны, диамагнитны(внешнее магнитное поле на них не действует). Неспаренные электроны находятся только на внешнем энергетическом уровне атома и их число можно определить по его электронно-графической схеме.
Пример 4.Определите число неспаренных электронов в атоме серы.
Решение. Атомный номер серы Z = 16, следовательно, полная электронная формула элемента: 1s22s22p63s23p4. Электронно-графическая схема внешних электронов такова (рис. 11).
Рис. 11. Электронно-графическая схема валентных электронов атома серы
Из электронно-графической схемы следует, что в атоме серы имеется два неспаренных электрона.
oplib.ru