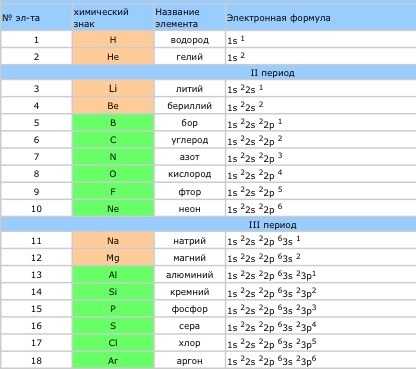
Электронные формулы атомов химических элементов - файл n1.doc. Графические формулы химических элементов таблица
| № эл-та | Химическийзнак | Названиеэлемента | Электронная формула |
| 1 | H | водород | 1s 1 |
| 2 | He | гелий | 1s 2 |
| II период | |||
| 3 | Li | литий | 1s 22s 1 |
| 4 | Be | бериллий | 1s 22s 2 |
| 5 | B | бор | 1s 22s 22p 1 |
| 6 | C | 1s 22s 22p 2 | |
| 7 | N | азот | 1s 22s 22p 3 |
| 8 | O | кислород | 1s 22s 22p 4 |
| 9 | F | фтор | 1s 22s 22p 5 |
| 10 | Ne | неон | 1s 22s 22p 6 |
| III период | |||
| 11 | Na | натрий | 1s 22s 22p 63s 1 |
| 12 | Mg | магний | 1s 22s 22p 63s 2 |
| 13 | Al | алюминий | 1s 22s 22p 63s 23p1 |
| 14 | Si | кремний | 1s 22s 22p 63s 23p2 |
| 15 | P | фосфор | 1s 22s 22p 63s 23p3 |
| 16 | S | сера | 1s 22s 22p 63s 23p4 |
| 17 | Cl | хлор | 1s 22s 22p 63s 23p5 |
| 18 | Ar | аргон | 1s 22s 22p 63s 23p6 |
| IV период | |||
| 19 | K | калий | 1s 22s 22p 63s 23p64s 1 |
| 20 | Ca | кальций | 1s 22s 22p 63s 23p64s 2 |
| 21 | Sc | скандий | 1s 22s 22p 63s 23p64s 23d1 |
| 22 | Ti | титан | 1s 22s 22p 63s 23p64s 23d2 |
| 23 | V | 1s 22s 22p 63s 23p64s 23d3 | |
| 24 | Cr | хром | 1s 22s 22p 63s 23p64s 13d5 |
| 25 | Mn | марганец | 1s 22s 22p 63s 23p64s 23d5 |
| 26 | Fe | железо | 1s 22s 22p 63s 23p64s 23d6 |
| 27 | Co | кобальт | 1s 22s 22p 63s 23p64s 23d7 |
| 28 | Ni | никель | 1s 22s 22p 63s 23p64s 23d8 |
| 29 | Cu | медь | 1s 22s 22p 63s 23p64s 13d10 |
| 30 | Zn | цинк | 1s 22s 22p 63s 23p64s 23d10 |
| 31 | Ga | галлий | 1s 22s 22p 63s 23p64s 23d104p1 |
| 32 | Ge | германий | 1s 22s 22p 63s 23p64s 23d104p2 |
| 33 | As | мышьяк | 1s 22s 22p 63s 23p64s 23d104p3 |
| 34 | Se | селен | 1s 22s 22p 63s 23p64s 23d104p4 |
| 35 | Br | бром | 1s 22s 22p 63s 23p64s 23d104p5 |
| 36 | Kr | криптон | 1s 22s 22p 63s 23p64s 23d104p6 |
| V период | |||
| 37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 |
| 38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 |
| 39 | Y | иттрий | |
| 40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 |
| 41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 |
| 42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 |
| 43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 |
| 44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 |
| 45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 |
| 46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p65s04d10 |
| 47 | Ag | 1s 22s 22p 63s 23p64s 23d104p65s14d10 | |
| 48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 |
| 49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 |
| 50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 |
| 51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s224d105p3 |
| 52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 |
| 53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 |
| 54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 |
| VI период | |||
| 55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 |
| 56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 |
| 57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 |
| 58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 |
| 59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 |
| 60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 |
| 61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 |
| Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 | |
| 63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 |
| 64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 |
| 65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 |
| 66 | Dy | диспрозий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 |
| 67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 |
| 68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 |
| 68 | Tm | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 | |
| 70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 |
| 71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 |
| 72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 |
| 73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 |
| 74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 |
| 75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 |
| 76 | Os | осмий | |
| 77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 |
| 78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 |
| 79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 |
| 80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 |
| 81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 |
| 82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 |
| 83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 |
| 84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 |
| 85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 |
| 86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 |
| VII период | |||
| 87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 |
| 88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 |
| 89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 |
| 90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 |
| 91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 |
| 92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 |
| 93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 |
| 94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 |
| 95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 |
| 96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 |
| 97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 |
| 98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 |
| 99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 |
| 100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 |
| 101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 |
| 102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 |
| 103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 |
| 104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 |
| 105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 |
| 106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 |
| 107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 |
| 108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 |
| 109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 |
| Обозначения элементов: | |||
| s-элементы | p-элементы | d-элементы | f-элементы |
5-ege.ru
Как составлять электронные формулы химических элементов?
Как составлять электронные формулы химических элементов?
Задача составления электронной формулы химического элемента не самая простая.
Научившись раз, дальше вы легко будете справляться с составлением формулы всех химических элементов.
Итак, алгоритм составления электронных формул элементов такой:
- Сначала записываем знак хим. элемента, где внизу слева от знака указываем его порядковый номер.
- Далее по номеру периода (из которого элемент) определяем число энергетических уровней и рисуем рядом со знаком хим-го элемента такое количество дуг.
- Затем по номеру группы число электронов на внешнем уровне, записываем под дугой.
- На 1 - ом уровне максимально возможно 2е, на втором уже 8, на третьем - целых 18. Начинаем ставить числа под соответствующими дугами.
- Число электронов на предпоследнем уровне нужно рассчитывать так: из порядкового номера элемента отнимается число уже проставленных электронов.
- Остается превратить нашу схему в электронную формулу:
Вот электронные формулы некоторых химических элементов:
- Пишем химический элемент и его порядковый номер.Номер показывает кол-во электронов в атоме.
- Составляем формулу. Для этого нужно узнать количество энергетических уровней, основой для определения берется номер периода элемента.
- Разбиваем уровни на под уровни.
Ниже можно увидеть пример, как правильно составлять электронные формулы химических элементов.
Составить электронные формулы химических элементов нужно таким способом: нужно посмотреть номер элемента в таблице Менделеева, таким образом узнать сколько у него электронов. Затем нужно узнать количество уровней, который равен периоду. Затем пишутся подуровни и они заполняются:
-Первым делом вам надо определить число атомов согласно таблицы Менделеева.
-Далее следует определить число энергетических уровней - основополагающим здесь будет являться номер периода, в котором размещн данный элемент.
-Далее за эти вам необходимо приступить к разбитию уровней на подуровни, заполняемые электронами. При этом основываться стоит на принципе наименьшей энергии.
Для составления электронной формулы вам понадобится периодическая система Менделеева. Находите ваш химический элемент там и смотрите период - он будет равен числу энергетических уровней. Номер группы будет соответствовать численно количеству электронов на последнем уровне. Номер элемента будет количественно равен числу его электронов.Так же вам четко надо знать, что на первом уровне есть максимум 2 электрона, на втором - 8, на третьем - 18.
Это основные моменты. Ко всему прочему в интернете (в том числе и нашем сайте) вы можете найти информацию с уже готовой электронной формулой для каждого элемента, так вы сможете проверить себя.
Составление электронных формул химических элементов очень даже сложный процесс, без специальных таблиц тут не обойтись, да и формул нужно применять целую кучу. Вкратце для составления нужно пройти по этим этапам:
Нужно составить орбитальную диаграмму, в которой будет понятие отличия электронов друг от друга. В диаграмме выделяются орбитали и электроны.
Электроны заполняются по уровням, снизу в верх и имеют несколько подуровней.
Итак вначале узнам общее количество электронов заданного атома.
Заполняем формулу по определнной схеме и записываем - это и будет электронной формулой.

Например у Азота эта формула выглядит так, сначала разбираемся с электронами:

И записываем формулу:
Чтобы понять принцип составления электронной формулы химического элемента, для начала нужно определить по номеру в таблице Менделеева общее количество электронов в атоме. После этого нужно определить число энергетических уровней, взяв за основу номер периода, в котором находится элемент.
После этого уровни разбиваются на подуровни, которые заполняют электронами, основываясь на Принципе наименьшей энергии.
Можно проверить правильность своих рассуждений, заглянув, например, сюда.
Составив электронную формулу химического элемента, можно узнать, сколько электронов и электронных слоев в конкретном атоме, а также порядок их распределения по слоям.
Для начала определяем порядковый номер элемента по таблице Менделеева, он соответствует числу электронов. Количество электронных слоев указывает на номер периода, а количество число электронов на последнем слое атома соответствует номеру группы.
- сначала заполняем s-подуровень, а потом р-, d- b f-подуровни;
- по правилу Клечковского электроны заполняют орбитали в порядке возрастания энергии этих орбиталей;
- по правилу Хунда электроны в пределах одного подуровня занимают свободные орбитали по одному, а потом образуют пары;
- по принципу Паули на одной орбитали больше 2 электронов не бывает.
Электронная формула химического элемента показывает сколько электронных слоев и сколько электронов содержится в атоме и как они распределены по слоям.
Чтобы составить электронную формулу химического элемента, нужно заглянуть в таблицу Менделеева и использовать полученные сведения для данного элемента. Порядковый номер элемента в таблице Менделеева соответствует количеству электронов в атоме. Число электронных слоев соответствует номеру периода, число электронов на последнем электронном слое соответствует номеру группы.
Необходимо помнить, что на первом слое находится максимум 2 электрона 1s2, на втором - максимум 8 (два s и шесть р: 2s2 2p6), на третьем - максимум 18 ( два s, шесть p, и десять d: 3s2 3p6 3d10).
Например, электронная формула углерода: С 1s2 2s2 2p2 (порядковый номер 6, номер периода 2, номер группы 4).
Электронная формула натрия: Na 1s2 2s2 2p6 3s1 (порядковый номер 11, номер периода 3, номер группы 1).
Для проверки правильности написания электронной формулы можно заглянуть на сайт www.alhimikov.net.
Составление электронной формулы хим.элементов на первый взгляд может показаться довольно сложным занятием, однако все станет понятно, если придерживаться следующей схемы:
- сперва пишем орбитали
- вставляем перед орбиталями числа, которые указывают номер энергетического уровня. Не забываем формулу для определения максимального количества электронов на энергетическом уровне: N=2n2
А как узнать число энергетических уровней? Просто посмотрите таблицу Менделеева: это число равно номеру периода, в котором данный элемент находится.
- над значком орбитали пишем число, которое обозначает количество электронов, которые находятся на этой орбитали.
Например, электронная формула скандия будет выглядеть таким образом:
info-4all.ru
| 55 | Cs | цезий | Cs - [Xe] 6s 1 | Cs - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 |
| 56 | Ba | барий | Ba - [Xe] 6s 2 | Ba - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 |
| 57 | La | лантан | La - [Xe] 5d 1 6s 2 | La - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 5d 1 6s 2 |
| 58 | Ce | церий | Ce - [Xe] 5d 1 6s 2 | Ce - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 5d 1 6s 2 |
| 59 | Pr | празеодим | Pr - [Xe] 4f 3 6s 2 | Pr - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 3 6s 2 |
| 60 | Nd | неодим | Nd - [Xe] 4f 4 6s 2 | Nd - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 4 6s 2 |
| 61 | Pm | прометий | Pm - [Xe] 4f 5 6s 2 | Pm - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 5 6s 2 |
| 62 | Sm | самарий | Sm - [Xe] 4f 6 6s 2 | Sm - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 6 6s 2 |
| 63 | Eu | европий | Eu - [Xe] 4f 7 6s 2 | Eu - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 7 6s 2 |
| 64 | Gd | гадолиний | Gd - [Xe] 4f 7 5d 1 6s 2 | Gd - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 7 5d 1 6s 2 |
| 65 | Tb | тербий | Tb - [Xe]4f 9 6s 2 | Tb - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 9 6s 2 |
| 66 | Dy | диспрозий | Dy - [Xe] 4f 10 6s 2 | Dy - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 10 6s 2 |
| 67 | Ho | гольмий | Ho - [Xe] 4f 11 6s 2 | Ho - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 11 6s 2 |
| 68 | Er | эрбий | Er - [Xe] 4f 12 6s 2 | Er - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 12 6s 2 |
| 68 | Tm | тулий | Tm - [Xe] 4f 13 6s 2 | Tm - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 13 6s 2 |
| 70 | Yb | иттербий | Yb - [Xe] 4f 14 6s 2 | Yb - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 6s 2 |
| 71 | Lu | лютеций | Lu - [Xe] 4f 14 5d 1 6s 2 | Lu - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 1 6s 2 |
| 72 | Hf | гафний | Hf - [Xe] 4f 14 5d 2 6s 2 | Hf - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 2 6s 2 |
| 73 | Ta | тантал | Ta - [Xe] 4f 14 5d 3 6s 2 | Ta - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 3 6s 2 |
| 74 | W | вольфрам | W - [Xe] 4f 14 5d 4 6s 2 | W - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 4 6s 2 |
| 75 | Re | рений | Re - [Xe] 4f 14 5d 5 6s 2 | Re - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 5 6s 2 |
| 76 | Os | осмий | Os - [Xe] 4f 14 5d 6 6s 2 | Os - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 6 6s 2 |
| 77 | Ir | иридий | Ir - [Xe] 4f 14 5d 7 6s 2 | Ir - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 7 6s 2 |
| 78 | Pt | платина | Pt - [Xe] 4f 14 5d 9 6s 1 | Pt - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 9 6s 1 |
| 79 | Au | золото | Au - [Xe] 4f 14 5d 10 6s 1 | Au - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 10 6s 1 |
| 80 | Hg | ртуть | Hg - [Xe] 4f 14 5d 10 6s 2 | Hg - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 10 6s 2 |
| 81 | Tl | таллий | Tl - [Xe] 4f 14 5d 10 6s 2 6p 1 | Tl - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 64f 14 5d 10 6s 2 6p 1 |
| 82 | Pb | свинец | Pb - [Xe] 4f 14 5d 10 6s 2 6p 2 | Pb - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 10 6s 2 6p 2 |
| 83 | Bi | висмут | Bi - [Xe] 4f 14 5d 10 6s 2 6p 3 | Bi - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 10 6s 2 6p 3 |
| 84 | Po | полоний | Po - [Xe] 4f 14 5d 10 6s 2 6p 4 | Po - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 64f 14 5d 10 6s 2 6p 4 |
| 85 | At | астат | At - [Xe] 4f 14 5d 10 6s 2 6p 5 | At - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 10 6s 2 6p 5 |
| 86 | Rn | радон | Rn - [Xe] 4f 14 5d 10 6s 2 6p 6 | Rn - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 10 6s 2 6p 6 |
tehtab.ru
Электронно-графическая формула элемента. Задачи 11
Электронная формула атома хлора
Задача 11. Напишите электронно-графическую формулу для 17 элемента, определите его валентные электроны и охарактеризуйте их с помощью квантовых чисел.Решение: Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s>2s>2р>3s>3р>4s>3d>4р>5s>4d>5р>6s>(5d1) >4f>5d>6р>7s>(6d1-2)>5f>6d>7р
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для 17 элемента - хлора( Сl –порядковый № 17) электронная формула имеют вид:
1s2 2s2 2p6 3s2 3p5
Валентные электроны хлора 3s2 3p5- находятся на 3s и3p подуровнях На валентных орбиталях атома Сl находится 7 электронов. Поэтому элемент помещают в седьмую группу периодической системы Д.И.Менделеева.
Электронная формула для атома титана
Задача 12. Напишите электронную формулу для атома титана, определите валентные электроны и охарактеризуйте их с помощью квантовых чисел.Решение: Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s>2s>2р>3s>3р>4s>3d>4р>5s>4d>5р>6s>(5d1) >4f>5d>6р>7s>(6d1-2)>5f>6d>7р
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для 22 –го элемента -Тi электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d2
Валентные электроны титана 4s2 3d2 находятся на 4s 3d подуровнях. В электронно-графических формулах атомов каждая атомная орбиталь обозначается квадратом ().
buzani.ru
| Атомный номер | Название химического элемента | Латинское название | Химический знак | Температура плавления, (toС) | Температура кипения, (toС) | Электронная формула (конфигурация, оболочка) |
| 1 | электронная формула водорода | hydrogenium | H | -259,14 | -252,87 | 1s1 |
| 2 | электронная формула гелия | helium | He | -272,2 | -268,93 | 1s2 |
| 2 период электронных формул химических элементов | ||||||
| 3 | электронная формула лития | lithium | Li | 180,54 | 1347 | 1s22s1 |
| 4 | электронная формула бериллия | beryllium | Be | 1278 | 2970 | 1s22s2 |
| 5 | электронная формула бора | borium | B |
2210 |
2600 | 1s22s22p1 |
| 6 | электронная формула углерода | carboneum | C | 3550 | 4827 | 1s22s22p2 |
| 7 | электронная формула азота | nitrogenium | N | -209,86 | -195,8 | 1s22s22p3 |
| 8 | электронная формула кислорода | oxygenium | O | -218,4 | -182,96 | 1s22s22p4 |
| 9 | электронная формула фтора | fluorum | F | -219,62 | -188,11 | 1s22s22p5 |
| 10 | электронная формула неона | neon | Ne | -248,7 | -246,05 | 1s22s22p6 |
| 3 период электронных формул химических элементов | ||||||
| 11 | электронная формула натрия | natrium | Na | 97,86 | 883,14 | 1s22s22p63s1 |
| 12 | электронная формула магния | magnesium | Mg | 648,8 | 1107 | 1s22s22p63s2 |
| 13 | электронная формула алюминия | aluminium | Al | 660,37 | 2467 | 1s22s22p63s23p1 |
| 14 | электронная формула кремния | silicium | Si | 1412 | 2355 | 1s22s22p63s23p2 |
| 15 | электронная формула фосфора | phosphorus | P | 44,14 | 280 | 1s22s22p63s23p3 |
| 16 | электронная формула серы | sulfur | S | 112,8 | 444,674 | 1s22s22p63s23p4 |
| 17 | электронная формула хлора | clorum | Cl | -100,98 | -34,6 | 1s22s22p63s23p5 |
| 18 | электронная формула аргона | argon | Ar | -189,2 | 185,7 | 1s22s22p63s23p6 |
| 4 период электронных формул химических элементов | ||||||
| 19 | электронная формула калия | kalium | K | 63,65 | 774 | 1s22s22p63s23p64s1 |
| 20 | электронная формула кальция | calcium | Ca | 839 | 1487 | 1s22s22p63s23p64s2 |
| 21 | электронная формула скандия | scandium | Sc | 1541 | 2831 | 1s22s22p63s23p64s23d1 |
| 22 | электронная формула титана | titanium | Ti | 1670 | 3287 | 1s22s22p63s23p64s23d2 |
| 23 | электронная формула ванадия | vanadium | V | 1890 | 3380 | 1s22s22p63s23p64s23d3 |
| 24 | электронная формула хрома | chromium | Cr | 1857 | 2672 | 1s22s22p63s23p64s13d5 |
| 25 | электронная формула марганца | manganum | Mn | 1244 | 1962 | 1s22s22p63s23p64s23d5 |
| 26 | электронная формула железа | ferrum | Fe | 1535 | 2750 | 1s22s22p63s23p64s23d6 |
| 27 | электронная формула кобальта | cobaltum | Co | 1495 | 2870 | 1s22s22p63s23p64s23d7 |
| 28 | электронная формула никеля | niccolum | Ni | 1453 | 2732 | 1s22s22p63s23p64s23d8 |
| 29 | электронная формула меди | cuprum | Cu | 1083,4 | 2567 | 1s22s22p63s23p64s13d10 |
| 30 | электронная формула цинка | zincum | Zn | 419,88 | 907 | 1s22s22p63s23p64s23d10 |
| 31 | электронная формула галия | gallium | Ga | 29,78 | 2403 | 1s22s22p63s23p64s13d104p1 |
| 32 | электронная формула германий | germanium | Ge | 937,4 | 2830 | 1s22s22p63s23p64s23d104p2 |
| 33 | электронная формула мышьяка | arsenicum | As | 817 | 616 | 1s22s22p63s23p64s23d104p3 |
| 34 | электронная формула селена | selenium | Se | 217 | 684,9 | 1s22s22p63s23p64s23d104p4 |
| 35 | электронная формула брома | bromum | Br | -7,25 | 58,78 | 1s22s22p63s23p64s23d104p5 |
| 36 | электронная формула криптона | krypton | Kr | -156,6 | 152,3 | 1s22s22p63s23p64s23d104p6 |
| 5 период электронных формул химических элементов | ||||||
| 37 | электронная формула рубидия | rubidium | Rb | 38,89 | 687,2 | 1s22s22p63s23p64s23d104p65s1 |
| 38 | электронная формула стронция | strontium | Sr | 769 | 1384 | 1s22s22p63s23p64s23d104p65s2 |
| 39 | электронная формула иттрия | yttrium | Y | 1522 | 3337 | 1s22s22p63s23p64s23d104p65s24d1 |
| 40 | электронная формула циркония | zirconium | Zr | 1852 | 4377 | 1s22s22p63s23p64s23d104p65s24d2 |
| 41 | электронная формула ниобия | niobium | Nb | 2468 | 4742 | 1s22s22p63s23p64s23d104p65s14d4 |
| 42 | электронная формула молибдена | molybdaenum | Mo | 2617 | 4612 | 1s22s22p63s23p64s23d104p65s14d5 |
| 43 | электронная формула технеция | technetium | Tc | 2172 | 4877 | 1s22s22p63s23p64s23d104p65s24d5 |
| 44 | электронная формула рутения | ruthenium | Ru | 2310 | 3900 | 1s22s22p63s23p64s23d104p65s14d7 |
| 45 | электронная формула родия | rhodium | Rh | 1966 | 3727 | 1s22s22p63s23p64s23d104p65s14d8 |
| 46 | электронная формула палладия | palladium | Pd | 1552 | 3140 | 1s22s22p63s23p64s23d104p65s04d10 |
| 47 | электронная формула серебра | argentum | Ag | 961,93 | 2212 | 1s22s22p63s23p64s23d104p65s14d10 |
| 48 | электронная формула кадмия | cadmium | Cd | 320,9 | 765 | 1s22s22p63s23p64s23d104p65s24d10 |
| 49 | электронная формула индий | indium | In | 156,78 | 2080 | 1s22s22p63s23p64s23d104p65s24d105p1 |
| 50 | электронная формула олова | stannum | Sn | 231,88 | 2270 | 1s22s22p63s23p64s23d104p65s24d105p2 |
| 51 | электронная формула сурьмы | stibium | Sb | 630,5 | 1750 | 1s22s22p63s23p64s23d104p65s24d105p3 |
| 52 | электронная формула теллура | tellurium | Te | 449,5 | 989,8 | 1s22s22p63s23p64s23d104p65s24d105p4 |
| 53 | электронная формула йода | iodum | I | 113,5 | 184,35 | 1s22s22p63s23p64s23d104p65s24d105p5 |
| 54 | электронная формула ксенона | xenon | Xe | -111,9 | -107,1 | 1s22s22p63s23p64s23d104p65s24d105p6 |
| 6 период электронных формул химических элементов | ||||||
| 55 | электронная формула цезия | ceslum | Cs | 28,5 | 678,4 | 1s22s22p63s23p64s23d104p65s24d105p66s1 |
| 56 | электронная формула бария | barlum | Ba | 725 | 1640 | 1s22s22p63s23p64s23d104p65s24d105p66s2 |
| 57 | электронная формула лантана | lanthanum | La | 920 | 3454 | 1s22s22p63s23p64s23d104p65s24d105p66s25d1 |
| 58 | электронная формула церия | cerium | Ce | 798 | 3426 | 1s22s22p63s23p64s23d104p65s24d105p66s24f2 |
| 59 | электронная формула празеодима | praseodymium | Pr | 931 | 3512 | 1s22s22p63s23p64s23d104p65s24d105p66s24f3 |
| 60 | электронная формула неодима | neodymium | Nd | 1021 | 3068 | 1s22s22p63s23p64s23d104p65s24d105p66s24f4 |
| 61 | электронная формула прометия | promethium | Pm | 1168 | 2460 | 1s22s22p63s23p64s23d104p65s24d105p66s24f5 |
| 62 | электронная формула самария | samarium | Sm | 1077 | 1791 | 1s22s22p63s23p64s23d104p65s24d105p66s24f6 |
| 63 | электронная формула европия | europium | Eu | 822 | 1597 | 1s22s22p63s23p64s23d104p65s24d105p66s24f7 |
| 64 | электронная формула гадолиния | gadolinium | Gd | 1312 | 3250 | 1s22s22p63s23p64s23d104p65s24d105p66s24f75d1 |
| 65 | электронная формула тербия | terbium | Tb | 1356 | 3123 | 1s22s22p63s23p64s23d104p65s24d105p66s24f9 |
| 66 | электронная формула диспрозия | dysprosium | Dy | 1409 | 2562 | 1s22s22p63s23p64s23d104p65s24d105p66s24f10 |
| 67 | электронная формула гольмия | holmium | Ho | 1474 | 2695 | 1s22s22p63s23p64s23d104p65s24d105p66s24f11 |
| 68 | электронная формула эрбия | erbium | Er | 1529 | 2863 | 1s22s22p63s23p64s23d104p65s24d105p66s24f12 |
| 69 | электронная формула тулия | thulium | Tm | 1545 | 1947 | 1s22s22p63s23p64s23d104p65s24d105p66s24f13 |
| 70 | электронная формула иттербия | ytterbium | Yb | 819 | 1193 | 1s22s22p63s23p64s23d104p65s24d105p66s24f14 |
| 71 | электронная формула лютеция | lutetium | Lu | 1663 | 3302 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d1 |
| 72 | электронная формула гафния | hafnium | Hf | 2227 | 4602 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d2 |
| 73 | электронная формула тантала | tantalum | Ta | 2996 | 5425 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d3 |
| 74 | электронная формула вольфрама | wolframium | W | 3410 | 5660 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d4 |
| 75 | электронная формула рения | rhenium | Re | 3180 | 5627 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d5 |
| 76 | электронная формула осмия | osmium | Os | 3045 | 5027 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d6 |
| 77 | электронная формула иридия | iridium | Ir | 2410 | 4130 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d7 |
| 78 | электронная формула платины | platinum | Pt | 1773,5 | 3830 | 1s22s22p63s23p64s23d104p65s24d105p66s14f145d9 |
| 79 | электронная формула золота | aurum | Au | 1064,43 | 2807 | 1s22s22p63s23p64s23d104p65s24d105p66s14f145d10 |
| 80 | электронная формула ртути | hydrargyrum | Hg | -38,86 | 356,6 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d10 |
| 81 | электронная формула таллия | thallium | Tl | 303,5 | 1457 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p1 |
| 82 | электронная формула свинца | plumbum | Pb | 327,5 | 1740 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p2 |
| 83 | электронная формула висмута | bismuthum | Bi | 271,3 | 1564 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p3 |
| 84 | электронная формула полония | polonium | Po | 254 | 962 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p4 |
| 85 | электронная формула астата | astatium | At | 302 | 337 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p5 |
| 86 | электронная формула радона | radon | Rn | -71 | -61,8 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p6 |
| 7 период электронных формул химических элементов | ||||||
| 87 | электронная формула франций | francium | Fr | 27 | 677 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s1 |
| 88 | электронная формула радий | radium | Ra | 970 | 1140 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 |
| 89 | электронная формула актиний | actinium | Ac | 1050 | 3250 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s26d1 |
| 90 | электронная формула торий | thorium | Th | 1750 | 3800 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s26d25f0 |
| 91 | электронная формула протактиний | protactinium | Pa | 1572 | 4300 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f26d1 |
| 92 | электронная формула урана | uranium | U | 1132 | 3818 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f36d1 |
| 93 | электронная формула нептуний | neptunium | Np | 639 | 3902 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f46d1 |
| 94 | электронная формула плутоний | plutonium | Pu | 641 | 3340 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f56d1 |
| 95 | электронная формула америций | americium | Am | 996 | 2607 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f7 |
| 96 | электронная формула кюрий | curium | Cm | 1340 | 3110 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f76d1 |
| 97 | электронная формула берклий | berkelium | Bk | 1050 | 2630 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f86d1 |
| 98 | электронная формула калифорний | californium | Cf | 900 | 1227 | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f10 |
| 99 | электронная формула эйнштейний | einsteinium | Es | 860 | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f11 |
| 100 | электронная формула фермий | fermium | Fm | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f12 |
| 101 | электронная формула менделеевий | mendelevium | Md | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f13 |
| 102 | электронная формула нобелий | nobelium | No | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f14 |
| 103 | электронная формула лоуренсий | lawrencium | Lr | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d1 |
| 104 | электронная формула резерфордий | rutherfordium | Rf | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d2 |
| 105 | электронная формула дубний | dubnium | Db | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d3 |
| 106 | электронная формула сиборгий | seaborgium | Sg | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d4 |
| 107 | электронная формула борий | bohrium | Bh | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d5 |
| 108 | электронная формула хассий | hassium | Hs | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d6 |
| 109 | электронная формула мейтнерий | meitnerium | Mt | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d7 |
| 110 | электронная формула Дармштадтий (Унуннилий) | Darmstadtium (Ununnilium) | Uun | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d8 |
| 111 | электронная формула Рентгений (Унунуний) | Roentgenium (Unununium) | Uuu | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d9 |
| 112 | электронная формула Коперниций (Унунбий) | Copernicium (Ununbium) | Uub | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d10 |
| 113 | электронная формула Нихоний (Унунтрий) | Nihonium (Ununtrium) | Unt | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p1 |
| 114 | электронная формула Флеровий (Унунквадий) | Flerovium (Ununquadium) | Uuq | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p2 |
| 115 | электронная формула Московий (Унунпентий) | Moscovium (Ununpentium) | Uup | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p3 |
| 116 | электронная формула Ливерморий (Унунгексий) | Livermorium (Ununhexium) | Uuh | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p4 |
| 117 | электронная формула Теннессин (Унунсептий) | Tennessine (Ununseptium) | Uus | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p5 |
| 118 | электронная формула Оганесон (Унуноктий) | Oganesson (Ununoctium) | Uuo | - | - | 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6 |
| 8 период электронных формул химических элементов | ||||||
| 119 | электронная формула унуненний | ununnenium | Uue | - | - | 8s1 |
| 120 | электронная формула унбинилий | unbinilium | Ubn | - | - | 8s2 |
| 121 | электронная формула унбиуний | unbiunium | Ubu | - | - | 5g18s2 |
| 122 | электронная формула унбибий | unbibium | Ubb | - | - | 5g28s2 |
| 123 | электронная формула унбитрий | unbitrium | Ubt | - | - | 5g38s2 |
| 124 | электронная формула унбиквадий | unbiquadium | Ubq | - | - | 5g48s2 |
| 125 | электронная формула унбипентий | unbipentium | Ubp | - | - | 5g58s2 |
| 126 | электронная формула унбигексий | unbihexium | Ubh | - | - | 5g68s2 |
scibio.ru
2.3 Электронные конфигурации атомов химических элементов - Мои статьи - Каталог файлов по химии
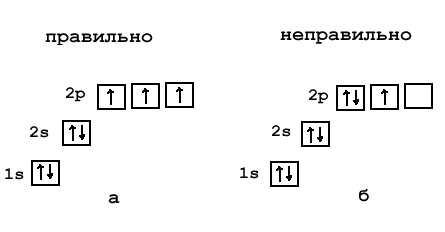
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского «веретено»), то есть обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемой оси: по часовой или против часовой стрелки. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, то есть электроны с противоположными спинами.
На рисунке 5 показана схема подразделения энергетических уровней на подуровни.
s-Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода (s = 1) располагается на этой орбитали и неспарен. Поэтому его электронная формула или электронная конфигурация будет записываться так: 1s1. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой (1 ...), латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа вверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной s-орбитали, эта формула: 1s2.
Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ.
На втором энергетическом уровне (n = 2) имеется четыре орбитали: одна s и три р. Электроны s-орбитали второго уровня (2s-орбитали) обладают более высокой энергией, так как находятся на большем расстоянии от ядра, чем электроны 1s-орбитали (n = 2).
Вообще, для каждого значения n существует одна s-орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения n.
р-Орбиталь имеет форму гантели или объемной восьмерки. Все три р-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с n = 2, имеет три р-орбитали. С увеличением значения n электроны анимают р-орбитали, расположенные на больших расстояниях от ядра и направленные по осям х, у, г.
У элементов второго периода (n = 2) заполняется сначала одна в-орбиталь, а затем три р-орбитали. Электронная формула 1л: 1s22s1. Электрон слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион Li+.
В атоме бериллия Ве0 четвертый электрон также размещается на 2s-орбитали: 1s22s2. Два внешних электрона атома бериллия легко отрываются — Ве0 при этом окисляется в катион Ве2+.
У атома бора пятый электрон занимает 2р-орбиталь: 1s22s22р1. Далее у атомов С, N, О, Е идет заполнение 2р-орбиталей, которое заканчивается у благородного газа неона: 1s22s22р6.
У элементов третьего периода заполняются соответственно Зв- и Зр-орбитали. Пять d-орбиталей третьего уровня при этом остаются свободными:
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, то есть записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно 4я- и 5я-орбитали: 19К 2, 8, 8, 1; 38Sr 2, 8, 18, 8, 2. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие 3d- и 4d- орбитали соответственно (у элементов побочных подгрупп): 23V 2, 8, 11, 2; 26Tr 2, 8, 14, 2; 40Zr 2, 8, 18, 10, 2; 43Тг 2, 8, 18, 13, 2. Как правило, тогда, когда будет заполнен предыдущий d-подуровень, начнет заполняться внешний (соответственно 4р- и 5р ) р-подуровень.
У элементов больших периодов — шестого и незавершенного седьмого — электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступят на внешний в-подуровень: 56Ва 2, 8, 18, 18, 8, 2; 87Гг 2, 8, 18, 32, 18, 8, 1; следующий один электрон (у Nа и Ас) на предыдущий (p-подуровень:57Lа 2, 8, 18, 18, 9, 2 и 89Ас 2, 8, 18, 32, 18, 9, 2.
Затем последующие 14 электронов поступят на третий снаружи энергетический уровень на 4f- и 5f-орбитали соответственно у лантаноидов и актиноидов.
Затем снова начнет застраиваться второй снаружи энергетический уровень (d-подуровень): у элементов побочных подгрупп: 73Та 2, 8,18, 32,11, 2; 104Rf 2, 8,18, 32, 32,10, 2, — и, наконец, только после полного заполнения десятью электронами сйгоду-ровня будет снова заполняться внешний р-подуровень:
86Rn 2, 8, 18, 32, 18, 8.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки (орбитали), располагаются в них сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины при этом по принципу Паули будут уже противоположно направленными.
В заключение еще раз рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И.Менделеева. Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).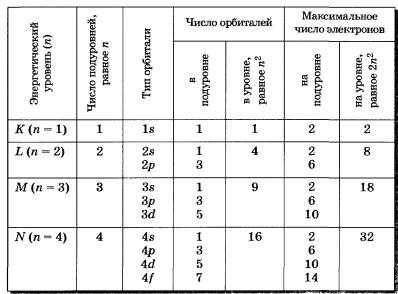
В атоме гелия первый электронный слой завершен — в нем 2 электрона.
Водород и гелий — s-элементы, у этих атомов заполняется электронами s-орбиталь.
Элементы второго периода
У всех элементов второго периода первый электронный слой заполнен и электроны заполняют е- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s-, а затем р ) и правилами Паули и Хунда (табл. 2).
В атоме неона второй электронный слой завершен — в нем 8 электронов.
Таблица 2 Строение электронных оболочек атомов элементов второго периода
Окончание табл. 2
Li, Ве — в-элементы.
В, С, N, О, F, Nе — р-элементы, у этих атомов заполняются электронами р-орбитали.
Элементы третьего периода
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать Зs-, 3р- и Зd-подуровни (табл. 3).
Таблица 3 Строение электронных оболочек атомов элементов третьего периода
У атома магния достраивается Зs-электронная орбиталь. Nа и Mg— s-элементы.
В атоме аргона на внешнем слое (третьем электронном слое) 8 электронов. Как внешний слой, он завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными Зd-орбитали.
Все элементы от Аl до Аг — р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень (табл. 4), так как он имеет меньшую энергию, чем Зй-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода: 1) обозначим условно графическую электронную формулу аргона так:Аr;
2) не будем изображать подуровни, которые у этих атомов не заполняются.
Таблица 4 Строение электронных оболочек атомов элементов четвертого периода


К, Са — s-элементы, входящие в главные подгруппы. У атомов от Sс до Zn заполняется электронами Зй-подуровень. Это Зй-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4я- на Зй-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций Зd5 и Зd10:
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни 3s, Зр и Зd, всего на них 18 электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень: Элементы от Gа до Кr — р-элементы.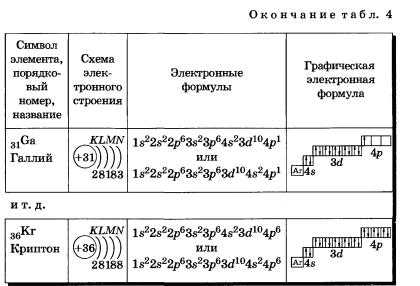
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое, как вы знаете, может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f- подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: 5s-> 4d -> 5р. И также встречаются исключения, связанные с «провалом» электронов, у 41Nb, 42MO и т.д.
В шестом и седьмом периодах появляются элементы, то есть элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-Элементы называют лантаноидами.
5f-Элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55Сs и 56Ва — 6s-элементы;
57Lа... 6s25d1 — 5d-элемент; 58Се — 71Lu — 4f-элементы; 72Hf — 80Нg — 5d-элементы; 81Тl— 86Rn — 6р-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f подуровней, то есть nf7 и nf14.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства или блока (рис. 7).
1) s-Элементы; заполняется электронами в-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
2) р-элементы; заполняется электронами р-подуровень внешнего уровня атома; к р элементам относятся элементы главных подгрупп III—VIII групп;
3) d-элементы; заполняется электронами d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I—VIII групп, то есть элементы вставных декад больших периодов, расположенные между s- и р-элементами. Их также называют переходными элементами;
4) f-элементы, заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
1. Что было бы, если бы принцип Паули не соблюдался?
2. Что было бы, если бы правило Хунда не соблюдалось?
3. Составьте схемы электронного строения, электронные формулы и графические электронные формулы атомов следующих химических элементов: Са, Fе, Zr, Sn, Nb, Hf, Ра.
4. Напишите электронную формулу элемента № 110, используя символ соответствующего благородного газа.
5. Что такое «провал» электрона? Приведите примеры элементов, у которых это явление наблюдается, запишите их электронные формулы.
6. Как определяется принадлежность химического элемента к тому или иному электронному семейству?
7. Сравните электронную и графическую электронную формулы атома серы. Какую дополнительную информацию содержит последняя формула?
www.xn--90aeobaarlnb3f3fe.xn--p1ai
| № эл-та | химическийзнак | Названиеэлемента | Электронная формула |
| 1 | H | водород | 1s 1 |
| 2 | He | гелий | 1s 2 |
| II период | |||
| 3 | Li | литий | 1s 22s 1 |
| 4 | Be | бериллий | 1s 22s 2 |
| 5 | B | бор | 1s 22s 22p 1 |
| 6 | C | углерод | 1s 22s 22p 2 |
| 7 | N | азот | 1s 22s 22p 3 |
| 8 | O | кислород | 1s 22s 22p 4 |
| 9 | F | фтор | 1s 22s 22p 5 |
| 10 | Ne | неон | 1s 22s 22p 6 |
| III период | |||
| 11 | Na | натрий | 1s 22s 22p 63s 1 |
| 12 | Mg | магний | 1s 22s 22p 63s 2 |
| 13 | Al | алюминий | 1s 22s 22p 63s 23p1 |
| 14 | Si | кремний | 1s 22s 22p 63s 23p2 |
| 15 | P | фосфор | 1s 22s 22p 63s 23p3 |
| 16 | S | сера | 1s 22s 22p 63s 23p4 |
| 17 | Cl | хлор | 1s 22s 22p 63s 23p5 |
| 18 | Ar | аргон | 1s 22s 22p 63s 23p6 |
| IV период | |||
| 19 | K | калий | 1s 22s 22p 63s 23p64s 1 |
| 20 | Ca | кальций | 1s 22s 22p 63s 23p64s 2 |
| 21 | Sc | скандий | 1s 22s 22p 63s 23p64s 23d1 |
| 22 | Ti | титан | 1s 22s 22p 63s 23p64s 23d2 |
| 23 | V | ванадий | 1s 22s 22p 63s 23p64s 23d3 |
| 24 | Cr | хром | 1s 22s 22p 63s 23p64s 13d5 |
| 25 | Mn | марганец | 1s 22s 22p 63s 23p64s 23d5 |
| 26 | Fe | железо | 1s 22s 22p 63s 23p64s 23d6 |
| 27 | Co | кобальт | 1s 22s 22p 63s 23p64s 23d7 |
| 28 | Ni | никель | 1s 22s 22p 63s 23p64s 23d8 |
| 29 | Cu | медь | 1s 22s 22p 63s 23p64s 13d10 |
| 30 | Zn | цинк | 1s 22s 22p 63s 23p64s 23d10 |
| 31 | Ga | галлий | 1s 22s 22p 63s 23p64s 23d104p1 |
| 32 | Ge | германий | 1s 22s 22p 63s 23p64s 23d104p2 |
| 33 | As | мышьяк | 1s 22s 22p 63s 23p64s 23d104p3 |
| 34 | Se | селен | 1s 22s 22p 63s 23p64s 23d104p4 |
| 35 | Br | бром | 1s 22s 22p 63s 23p64s 23d104p5 |
| 36 | Kr | криптон | 1s 22s 22p 63s 23p64s 23d104p6 |
| V период | |||
| 37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 |
| 38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 |
| 39 | Y | иттрий | 1s 22s 22p 63s 23p64s 23d104p65s24d1 |
| 40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 |
| 41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 |
| 42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 |
| 43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 |
| 44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 |
| 45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 |
| 46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p65s04d10 |
| 47 | Ag | серебро | 1s 22s 22p 63s 23p64s 23d104p65s14d10 |
| 48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 |
| 49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 |
| 50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 |
| 51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s224d105p3 |
| 52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 |
| 53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 |
| 54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 |
| VI период | |||
| 55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 |
| 56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 |
| 57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 |
| 58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 |
| 59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 |
| 60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 |
| 61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 |
| 62 | Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 |
| 63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 |
| 64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 |
| 65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 |
| 66 | Dy | диспрозий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 |
| 67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 |
| 68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 |
| 68 | Tm | тулий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 |
| 70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 |
| 71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 |
| 72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 |
| 73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 |
| 74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 |
| 75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 |
| 76 | Os | осмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 |
| 77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 |
| 78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 |
| 79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 |
| 80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 |
| 81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 |
| 82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 |
| 83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 |
| 84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 |
| 85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 |
| 86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 |
| VII период | |||
| 87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 |
| 88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 |
| 89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 |
| 90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 |
| 91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 |
| 92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 |
| 93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 |
| 94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 |
| 95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 |
| 96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 |
| 97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 |
| 98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 |
| 99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 |
| 100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 |
| 101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 |
| 102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 |
| 103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 |
| 104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 |
| 105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 |
| 106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 |
| 107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 |
| 108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 |
| 109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 |
nashaucheba.ru