Названия химических элементов. Химический элемент с это
Химические элементы - это... Что такое Химические элементы?
Хими́ческий элеме́нт — совокупность атомов с одинаковым зарядом ядра. Каждый химический элемент представляет собой совокупность атомов с одинаковым зарядом ядра (числом протонов, одинаковым с порядковым, или атомным, номером в таблице Дмитрия Менделеева,).
Известные химические элементы
К 2008 г. известно 117 химических элементов (с порядковыми номерами с 1 по 116 и 118), из них 94 обнаружены в природе (некоторые — лишь в следовых количествах), остальные 23 получены искусственно в результате ядерных реакций. Первые 112 элементов имеют постоянные названия, остальные — временные.
Символы химических элементов
Символы химических элементов используются как сокращения для названия элементов. В качестве символа обычно берут начальную букву названия элемента и в случае необходимости добавляют следующую или одну из следующих. Обычно это начальные буквы латинских названий элементов: Cu — медь (cuprum), Ag — серебро (argentum), Fe — железо (ferrum), Au — золото (aurum), Hg — ртуть (hydrargirum). Система химических символов была предложена в 1811 г. шведским химиком Я.Берцелиусом. Временные символы элементов состоят из трёх букв, представляющих аббревиатуру их атомного номера на латыни. Символика химических элементов выявляет не только качественный состав химических соединений, но и количественный, так как за символом каждого элемента скрывается присущая ему атомная масса.
Карточка химического элемента
Распространённость химических элементов в природе
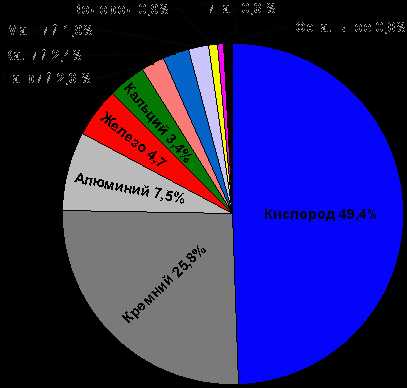
Распространённость химических элементов в земной коре. (Числа отвечают массовому содержанию элементов (в %)
Из всех химических элементов в природе найдено 88; такие элементы, как технеций Tc (порядковый номер 43), прометий Pm (61), астат At (85) и франций Fr (87), а также все элементы, следующие за ураном U (порядковый номер 92), впервые получены искусственно. Некоторые из них в исчезающе малых количествах обнаружены в природе.
Из химических элементов наиболее распространены в земной коре кислород и кремний. Эти элементы вместе с элементами алюминий, железо, кальций, натрий, калий, магний, водород и титан составляют более 99 % массы земной оболочки, так что на остальные элементы приходится менее 1 %. В морской воде, помимо кислорода и водорода — составных частей самой воды, высокое содержание имеют такие элементы, как хлор, натрий, магний, сера, калий, бром и углерод. Содержание элемента в земной коре называется кларковым числом или кларком элемента.
Содержание элементов в коре Земли отличается от содержания элементов в Земле, взятой как целое, поскольку химсостав коры, мантии и ядра Земли неодинаков. Так, ядро состоит в основном из железа и никеля. В свою очередь, содержания элементов в Солнечной системе и в целом во Вселенной также отличаются от земных. Наиболее распространённым элементом во Вселенной является водород, за ним идёт гелий. Исследование относительных распространённостей химических элементов и их изотопов в космосе является важным источником информации о процессах нуклеосинтеза и об эволюции Солнечной системы и небесных тел.
Вещество может состоять как из одного химического элемента (простые вещества), так и из разных (сложные вещества или химические соединения). Способность одного элемента существовать в виде различных простых веществ, отличающихся по свойствам, называется аллотропией. [1]
В обычных условиях соответствущие простые вещества для 11 элементов являются газами (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), для 2 — жидкостями (Br, Hg), для остальных элементов — твёрдыми телами.
Химические элементы образуют около 500 простых веществ. [1]
См. также
Ссылки
Примечания
| Химический портал — мир химии, веществ и превращений на страницах Википедии. |
Wikimedia Foundation. 2010.
dic.academic.ru
Список химических элементов - это... Что такое Список химических элементов?
Список химических элементов упорядочен в порядке возрастания атомных номеров с возможностью сортировки по другим параметрам. В таблице приводятся название химического элемента, используемый для его обозначения символ (признанный Международным союзом теоретической и прикладной химии), группа и период в Периодической системе химических элементов, атомная масса (наиболее стабильного изотопа), плотность, температура плавления, температура кипения, год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
| 1 | Водород | H | Hydrogenium | 1, 1 | 1,00794 (7)[1][2][3] | 0,084 г/л | -259,1 | -252,9 | 1766 | Кавендиш |
| 2 | Гелий | He | Helium | 1, 18 | 4,002602 (2)[1][3] | 0,17 г/л | -272,2 (при 2,5 МПа) | -268,9 | 1895 | Локьер, Жансен (в спектре Солнца), Рамзай (на Земле) |
| 3 | Литий | Li | Lithium | 2, 1 | 6,941 (2)[1][2][3][4] | 0,53 | 180,5 | 1317 | 1817 | Арфведсон |
| 4 | Бериллий | Be | Beryllium | 2, 2 | 9,012182 (3) | 1,85 | 1278 | 2970 | 1797 | Воклен |
| 5 | Бор | B | Borum | 2, 13 | 10,811 (7)[1][2][3] | 2,46 | 2300 | 2550 | 1808 | Дэви и Гей-Люссак |
| 6 | Углерод | C | Carboneum | 2, 14 | 12,0107 (8)[1][3] | 3,51 | 3550 | 4827 | доисторический период | неизвестен |
| 7 | Азот | N | Nitrogenium | 2, 15 | 14,0067 (2)[1][3] | 1,17 г/л | -209,9 | -195,8 | 1772 | Резерфорд |
| 8 | Кислород | O | Oxygenium | 2, 16 | 15,9994 (3)[1][3] | 1,33 г/л | -218,4 | -182,9 | 1774 | Пристли и Шееле |
| 9 | Фтор | F | Ftorum, Fluorum | 2, 17 | 18,9984032 (5) | 1,58 г/л | -219,6 | -188,1 | 1886 | Муассан |
| 10 | Неон | Ne | Neon | 2, 18 | 20,1797 (6)[1][2] | 0,84 г/л | -248,7 | -246,1 | 1898 | Рамзай и Траверс |
| 11 | Натрий | Na | Natrium | 3, 1 | 22,98976928 (2) | 0,97 | 97,8 | 892 | 1807 | Дэви |
| 12 | Магний | Mg | Magnesium | 3, 2 | 24,3050 (6) | 1,74 | 648,8 | 1107 | 1808 | Дэви |
| 13 | Алюминий | Al | Aluminium | 3, 13 | 26,9815386 (8) | 2,70 | 660,5 | 2467 | 1825 | Эрстед |
| 14 | Кремний | Si | Silicium | 3, 14 | 28,0855 (3)[3] | 2,33 | 1410 | 2355 | 1824 | Берцелиус |
| 15 | Фосфор | P | Phosphorum | 3, 15 | 30,973762 (2) | 1,82 | 44 (P4) | 280 (P4) | 1669 | Бранд |
| 16 | Сера | S | Sulfurum | 3, 16 | 32,065 (5)[1][3] | 2,06 | 113 | 444,7 | доисторический период | неизвестен |
| 17 | Хлор | Cl | Chlorum | 3, 17 | 35,453 (2)[1][2][3] | 2,95 г/л | -101 | -34,6 | 1774 | Шееле |
| 18 | Аргон | Ar | Argon | 3, 18 | 39,948 (1)[1][3] | 1,66 г/л | -189,4 | -185,9 | 1894 | Рамзай и Рэлей |
| 19 | Калий | K | Kalium, Calium | 4, 1 | 39,0983 (1) | 0,86 | 63,7 | 774 | 1807 | Дэви |
| 20 | Кальций | Ca | Calcium | 4, 2 | 40,078 (4)[1] | 1,54 | 839 | 1487 | 1808 | Дэви |
| 21 | Скандий | Sc | Scandium | 4, 3 | 44,955912 (6) | 2,99 | 1539 | 2832 | 1879 | Нильсон |
| 22 | Титан | Ti | Titanium | 4, 4 | 47,867 (1) | 4,51 | 1660 | 3260 | 1791 | Грегор и Клапрот |
| 23 | Ванадий | V | Vanadium | 4, 5 | 50,9415 (1) | 6,09 | 1890 | 3380 | 1801 | дель Рио |
| 24 | Хром | Cr | Chromium | 4, 6 | 51,9961 (6) | 7,14 | 1857 | 2482 | 1797 | Воклен |
| 25 | Марганец | Mn | Manganum,Manganesium | 4, 7 | 54,938045 (5) | 7,44 | 1244 | 2097 | 1774 | Ган |
| 26 | Железо | Fe | Ferrum | 4, 8 | 55,845 (2) | 7,87 | 1535 | 2750 | доисторический период | неизвестен |
| 27 | Кобальт | Co | Cobaltum | 4, 9 | 58,933195 (5) | 8,89 | 1495 | 2870 | 1735 | Брандт |
| 28 | Никель | Ni | Niccolum | 4, 10 | 58,6934 (2) | 8,91 | 1453 | 2732 | 1751 | Кронштедт |
| 29 | Медь | Cu | Cuprum | 4, 11 | 63,546 (3)[3] | 8,92 | 1083,5 | 2595 | доисторический период | неизвестен |
| 30 | Цинк | Zn | Zincum | 4, 12 | 65,409 (4) | 7,14 | 419,6 | 907 | доисторический период | неизвестен |
| 31 | Галлий | Ga | Gallium | 4, 13 | 69,723 (1) | 5,91 | 29,8 | 2403 | 1875 | де Буабодран |
| 32 | Германий | Ge | Germanium | 4, 14 | 72,64 (1) | 5,32 | 937,4 | 2830 | 1886 | Винклер |
| 33 | Мышьяк | As | Arsenicum | 4, 15 | 74,92160 (2) | 5,72 | 613 | 613(subl.) | ca. 1250 | Альберт Великий |
| 34 | Селен | Se | Selenium | 4, 16 | 78,96 (3)[3] | 4,82 | 217 | 685 | 1817 | Берцелиус |
| 35 | Бром | Br | Bromum | 4, 17 | 79,904 (1) | 3,14 | -7,3 | 58,8 | 1826 | Балар |
| 36 | Криптон | Kr | Krypton, Crypton | 4, 18 | 83,798 (2)[1][2] | 3,48 г/л | -156,6 | -152,3 | 1898 | Рамзай и Траверс |
| 37 | Рубидий | Rb | Rubidium | 5, 1 | 85,4678 (3)[1] | 1,53 | 688 | 1861 | Бунзен и Кирхгоф | |
| 38 | Стронций | Sr | Strontium | 5, 2 | 87,62 (1)[1][3] | 2,63 | 769 | 1384 | 1790 | Кроуфорд |
| 39 | Иттрий | Y | Yttrium | 5, 3 | 88,90585 (2) | 4,47 | 1523 | 3337 | 1794 | Гадолин |
| 40 | Цирконий | Zr | Zirconium | 5, 4 | 91,224 (2)[1] | 6,51 | 1852 | 4377 | 1789 | Клапрот |
| 41 | Ниобий | Nb | Niobium | 5, 5 | 92,90638 (2) | 8,58 | 2468 | 4927 | 1801 | Хэтчетт |
| 42 | Молибден | Mo | Molybdaenum | 5, 6 | 95,94 (2)[1] | 10,28 | 2617 | 5560 | 1778 | Шееле |
| 43 | Технеций | Tc | Technetium | 5, 7 | [98,9063][5] | 11,49 | 2172 | 5030 | 1937 | Перрье и Сегре |
| 44 | Рутений | Ru | Ruthenium | 5, 8 | 101,07 (2)[1] | 12,45 | 2310 | 3900 | 1844 | Клаус |
| 45 | Родий | Rh | Rhodium | 5, 9 | 102,90550 (2) | 12,41 | 1966 | 3727 | 1803 | Волластон |
| 46 | Палладий | Pd | Palladium | 5, 10 | 106,42 (1)[1] | 12,02 | 1552 | 3140 | 1803 | Волластон |
| 47 | Серебро | Ag | Argentum | 5, 11 | 107,8682 (2)[1] | 10,49 | 961,9 | 2212 | доисторический период | неизвестен |
| 48 | Кадмий | Cd | Cadmium | 5, 12 | 112,411 (8)[1] | 8,64 | 321 | 765 | 1817 | Штромейер |
| 49 | Индий | In | Indium | 5, 13 | 114,818 (3) | 7,31 | 156,2 | 2080 | 1863 | Райх и Рихтер |
| 50 | Олово | Sn | Stannum | 5, 14 | 118,710 (7)[1] | 7,29 | 232 | 2270 | доисторический период | неизвестен |
| 51 | Сурьма | Sb | Stibium | 5, 15 | 121,760 (1)[1] | 6,69 | 630,7 | 1750 | доисторический период | неизвестен |
| 52 | Теллур | Te | Tellurium | 5, 16 | 127,60 (3)[1] | 6,25 | 449,6 | 990 | 1782 | фон Райхенштайн |
| 53 | Иод | I | Iodium, Jodium | 5, 17 | 126,90447 (3) | 4,94 | 113,5 | 184,4 | 1811 | Куртуа |
| 54 | Ксенон | Xe | Xenon | 5, 18 | 131,293 (6)[1][2] | 4,49 г/л | -111,9 | -107 | 1898 | Рамзай и Траверс |
| 55 | Цезий | Cs | Caesium | 6, 1 | 132,9054519 (2) | 1,90 | 28,4 | 690 | 1860 | Бунзен и Кирхгоф |
| 56 | Барий | Ba | Barium | 6, 2 | 137,327 (7) | 3,65 | 725 | 1640 | 1808 | Дэви |
| 57 | Лантан | La | Lantanum | 6 | 138,90547 (7)[1] | 6,16 | 920 | 3454 | 1839 | Мосандер |
| 58 | Церий | Ce | Cerium | 6 | 140,116 (1)[1] | 6,77 | 798 | 3257 | 1803 | фон Хисингер и Берцелиус |
| 59 | Празеодим | Pr | Prasaeodymum | 6 | 140,90765 (2) | 6,48 | 931 | 3212 | 1895 | Ауэр фон Вельсбах |
| 60 | Неодим | Nd | Neodymum | 6 | 144,242 (3)[1] | 7,00 | 1010 | 3127 | 1895 | Ауэр фон Вельсбах |
| 61 | Прометий | Pm | Prometium | 6 | [146,9151][5] | 7,22 | 1080 | 2730 | 1945 | Маринский и Гленденин |
| 62 | Самарий | Sm | Samarium | 6 | 150,36 (2)[1] | 7,54 | 1072 | 1778 | 1879 | де Буабодран |
| 63 | Европий | Eu | Europium | 6 | 151,964 (1)[1] | 5,25 | 822 | 1597 | 1901 | Демарсе |
| 64 | Гадолиний | Gd | Gadolinium | 6 | 157,25 (3)[1] | 7,89 | 1311 | 3233 | 1880 | де Мариньяк |
| 65 | Тербий | Tb | Terbium | 6 | 158,92535 (2) | 8,25 | 1360 | 3041 | 1843 | Мосандер |
| 66 | Диспрозий | Dy | Dysprosium | 6 | 162,500 (1)[1] | 8,56 | 1409 | 2335 | 1886 | де Буабодран |
| 67 | Гольмий | Ho | Holmium | 6 | 164,93032 (2) | 8,78 | 1470 | 2720 | 1878 | Соре |
| 68 | Эрбий | Er | Erbium | 6 | 167,259 (3)[1] | 9,05 | 1522 | 2510 | 1842 | Мосандер |
| 69 | Тулий | Tm | Thulium | 6 | 168,93421 (2) | 9,32 | 1545 | 1727 | 1879 | Клеве |
| 70 | Иттербий | Yb | Ytterbium | 6 | 173,04 (3)[1] | 6,97 | 824 | 1193 | 1878 | де Мариньяк |
| 71 | Лютеций | Lu | Lutetium | 6, 3 | 174,967 (1)[1] | 9,84 | 1656 | 3315 | 1907 | Урбэн |
| 72 | Гафний | Hf | Hafnium | 6, 4 | 178,49 (2) | 13,31 | 2150 | 5400 | 1923 | Костер и де Хевеши |
| 73 | Тантал | Ta | Tantalum | 6, 5 | 180,9479 (1) | 16,68 | 2996 | 5425 | 1802 | Экеберг |
| 74 | Вольфрам | W | Wolfrahmium | 6, 6 | 183,84 (1) | 19,26 | 3407 | 5927 | 1783 | Элюяр |
| 75 | Рений | Re | Rhenium | 6, 7 | 186,207 (1) | 21,03 | 3180 | 5873 | 1925 | Ноддак, Такке и Берг |
| 76 | Осмий | Os | Osmium | 6, 8 | 190,23 (3)[1] | 22,61 | 3045 | 5027 | 1803 | Теннант |
| 77 | Иридий | Ir | Iridium | 6, 9 | 192,217 (3) | 22,65 | 2410 | 4130 | 1803 | Теннант |
| 78 | Платина | Pt | Platinum | 6, 10 | 195,084 (9) | 21,45 | 1772 | 3827 | 1557 | Скалигер |
| 79 | Золото | Au | Aurum | 6, 11 | 196,966569 (4) | 19,32 | 1064,4 | 2940 | доисторический период | неизвестен |
| 80 | Ртуть | Hg | Hydrargyrum | 6, 12 | 200,59 (2) | 13,55 | -38,9 | 356,6 | доисторический период | неизвестен |
| 81 | Таллий | Tl | Thallium | 6, 13 | 204,3833 (2) | 11,85 | 303,6 | 1457 | 1861 | Крукс |
| 82 | Свинец | Pb | Plumbum | 6, 14 | 207,2 (1)[1][3] | 11,34 | 327,5 | 1740 | доисторический период | неизвестен |
| 83 | Висмут | Bi | Bismuthum, Wismatum | 6, 15 | 208,98040 (1) | 9,80 | 271,4 | 1560 | 1753 | Жоффруа |
| 84 | Полоний | Po | Polonium | 6, 16 | [208,9824][5] | 9,20 | 254 | 962 | 1898 | Мария и Пьер Кюри |
| 85 | Астат | At | Asthatum | 6, 17 | [209,9871][5] | 302 | 337 | 1940 | Д. Р. Корсон, К. Р. Маккензи и Э. Сегре | |
| 86 | Радон | Rn | Radon | 6, 18 | [222,0176][5] | 9,23 г/л | -71 | -61,8 | 1900 | Дорн |
| 87 | Франций | Fr | Francium | 7, 1 | [223,0197][5] | 1,87 | 27 | 677 | 1939 | Перей |
| 88 | Радий | Ra | Radium | 7, 2 | [226,0254][5] | 5,50 | 700 | 1140 | 1898 | Мария и Пьер Кюри |
| 89 | Актиний | Ac | Actinium | 7 | [227,0278][5] | 10,07 | 1047 | 3197 | 1899 | Дебьерн |
| 90 | Торий | Th | Thorium | 7 | 232,03806 (2)[5][1] | 11,72 | 1750 | 4787 | 1829 | Берцелиус |
| 91 | Протактиний | Pa | Protactinium | 7 | 231,03588 (2)[5] | 15,37 | 1554 | 4030 | 1917 | Содди, Кранстон и Ган |
| 92 | Уран | U | Uranium | 7 | 238,02891 (3)[5][1][2] | 18,97 | 1132,4 | 3818 | 1789 | Клапрот |
| 93 | Нептуний | Np | Neptunium | 7 | [237,0482][5] | 20,48 | 640 | 3902 | 1940 | Макмиллан и Абелсон |
| 94 | Плутоний | Pu | Plutonium | 7 | [244,0642][5] | 19,74 | 641 | 3327 | 1940 | Сиборг |
| 95 | Америций | Am | Americium | 7 | [243,0614][5] | 13,67 | 994 | 2607 | 1944 | Сиборг |
| 96 | Кюрий | Cm | Curium | 7 | [247,0703][5] | 13,51 | 1340 | 1944 | Сиборг | |
| 97 | Берклий | Bk | Berklium | 7 | [247,0703][5] | 13,25 | 986 | 1949 | Сиборг | |
| 98 | Калифорний | Cf | Californium | 7 | [251,0796][5] | 15,1 | 900 | 1950 | Сиборг | |
| 99 | Эйнштейний | Es | Einsteinium | 7 | [252,0829][5] | 860 | 1952 | Сиборг | ||
| 100 | Фермий | Fm | Fermium | 7 | [257,0951][5] | 1952 | Сиборг | |||
| 101 | Менделевий | Md | Mendelevium,Mendeleevium,Mendeleievium | 7 | [258,0986][5] | 1955 | Сиборг | |||
| 102 | Нобелий | No | Nobelium | 7 | [259,1009][5] | 1958 | Сиборг | |||
| 103 | Лоуренсий | Lr | Lawrencium,Laurentium | 7, 3 | [260,1053][5] | 1961 | Гиорсо | |||
| 104 | Резерфордий | Rf | Rutherfordium | 7, 4 | [261,1087][5] | 1964/69 | Флёров | |||
| 105 | Дубний | Db | Dubnium | 7, 5 | [262,1138][5] | 1967/70 | Флёров | |||
| 106 | Сиборгий | Sg | Seaborgium | 7, 6 | [263,1182][5] | 1974 | Флёров | |||
| 107 | Борий | Bh | Bohrium | 7, 7 | [262,1229][5] | 1976 | Оганесян | |||
| 108 | Хассий | Hs | Hassium | 7, 8 | [265][5] | 1984 | GSI (*) | |||
| 109 | Мейтнерий | Mt | Meitnerium | 7, 9 | [266][5] | 1982 | GSI | |||
| 110 | Дармштадтий | Ds | Darmstadtium | 7, 10 | [269][5] | 1994 | GSI | |||
| 111 | Рентгений | Rg | Roentgenium | 7, 11 | [272][5] | 1994 | GSI | |||
| 112 | Коперниций | Cn | Copernicium | 7, 12 | [285][5] | 1996 | GSI | |||
| 113 | Унунтрий | Uut | 7, 13 | [284][5] | 2004 | ОИЯИ (*), LLNL (*) | ||||
| 114 | Флеровий | Fl | Flerovium,Fliorovium | 7, 14 | [289][5] | 1999 | ОИЯИ | |||
| 115 | Унунпентий | Uup | 7, 15 | [288][5] | 2004 | ОИЯИ, LLNL | ||||
| 116 | Ливерморий | Lv | Livermorium | 7, 16 | [292][5] | 2000 | ОИЯИ, LLNL | |||
| 117 | Унунсептий | Uus | 7, 17 | [295][5] | 2010 | ОИЯИ | ||||
| 118 | Унуноктий | Uuo | 7, 18 | [294][5] | 2004 | ОИЯИ |
Аббревиатуры
- GSI — Gesellschaft für Schwerionenforschung (Институт тяжёлых ионов), Виксхаузен, Дармштадт, Германия
- ОИЯИ — Объединённый институт ядерных исследований, Дубна, Московская область, Россия (JINR, Joint Institute for Nuclear Research)
- LLNL — Lawrence Livermore National Laboratory (Ливерморская национальная лаборатория им. Э. Лоуренса), Ливермор, Калифорния, США
- LBNL — Lawrence Berkeley National Laboratory (Национальная лаборатория имени Лоуренса в Беркли), Беркли, Калифорния, США
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 Изотопный состав этого элемента различается в различных геологических образцах, и отклонения могут превышать указанную в таблице погрешность.
- ↑ 1 2 3 4 5 6 7 8 Изотопный состав элемента может различаться в различных продажных материалах, что может приводить к существенным отклонениям от приведённых значений.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Изотопный состав различается в земных материалах настолько, что более точный атомный вес не может быть приведён.
- ↑ Атомный вес продажного лития может варьироваться между 6,939 и 6,996, для получения более точного значения необходим анализ конкретного материала.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 Данный элемент не имеет стабильных изотопов, и значение в скобках, например, [209], обозначает массовое число наиболее долгоживущего изотопа элемента или характерный изотопный состав.
Ссылки
dic.academic.ru
Химический элемент — Циклопедия
Химические элементы // Мрия Урок Химия — просто. Урок 1 «ПСЭ»Химический элемент — совокупность атомов с одинаковым зарядом ядра. Носителем положительного заряда ядра являются протоны. Их число определяет величину заряда ядра, и следовательно, атомный (порядковый) номер химического элемента.
Близкое к современному определение химического элемента было дано Д. И. Менделеевым: «Под именем элементов должно подразумевать те материальные составные части простых и сложных тел, которые придают им известную совокупность физических и химических свойств. Если простому телу соответствует понятие о частице, то элементу отвечает понятие об атоме».
[править] Физические основы
Важной характеристикой ядра является массовое число А, которое равно общему числу нуклонов — протонов Z и нейтронов N входящих в ядро:
А = Z + N.
Масса ядра всегда меньше арифметической суммы масс протонов и нейтронов, входящих в его состав. Разность между этими величинами называют дефектом массы.
Согласно соотношению Эйнштейна дефект массы и энергия связи нуклонов в ядре эквивалентны:
[math]\! \Delta E = \Delta m c^2 = {c^2}{\Delta}m[/math]где [math]\Delta m[/math] — дефект массы и с — скорость света в вакууме.
Энергия связи нуклонов в ядре в миллионы раз превышает энергию химической связи. Поэтому при химических превращениях веществ атомные ядра не изменяются, и элементы остаются неизменными.
Для понимания физических основ устройства атомов элементов важно также знать законы квантовой механики.
Химическая природа элемента обусловливается способностью его атома терять и приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
[править] Распространенность химических элементов
Распространенность элементов в космосе в целом уменьшается по убыванию атомного номера. Исторически все элементы возникли из водорода в результате ядерных реакций, и до сих пор Вселенная практически полностью состоит из водорода. Космическое вещество Солнечной системы состоит примерно на три четверти из водорода и гелия. Элементы с завершенными ядерными слоями («магические числа» 2, 8, 20, 28, 50, 82, 126: гелий-кислород-кальций-железо-сурьма-свинец) как правило играют большую роль в природе и чаще встречаются, чем окружающие их элементы. Распространенность элементов зависит от многих факторов, но в конечном счете определяется вероятностью ядерных реакций их образования и относительной устойчивостью отдельных изотопов.
Об образовании и превращении элементов см. также Ядерная реакция.
[править] Периодическая система элементов
[править] Элементы малых периодов
Об устройстве электронного облака см. также атомная орбиталь.
Первый период периодической системы состоит из двух элементов — водород и гелий. Электронная формула невозбужденного атома водорода 1s1. В соответствии с принципом Паули в одной орбитали могут находиться два электрона с противоположными спинами. Следовательно, электронная формула следующего после водорода элемента — гелия 1s2.
Второй и третий периоды содержат по 8 элементов. Во втором периоде заполняется второй квантовый слой, в третьем периоде — третий. У двух первых элементов (натрий и магний), заполняются s-орбитали, у шести последних (алюминий — аргон) заполняются p-орбитали. У последних элементов этих периодов — аргона и неона, завершается заполнение орбиталей.
[править] Элементы больших периодов
Четвертый и пятый периоды содержат по 18 элементов. У атомов элементов 4-го периода начинает заполняться 4s-орбиталь слоя N (n = 4). Появление электрона в 4s-состоянии при наличии свободных 3d-орбиталей обусловливается экранированием ядра плотным и симметричным электронным слоем 3s23p6. В связи с отталкиванием от этого слоя для 19-го электрона атома калия и 20-го электрона атома кальция оказывается энергетически выгодным 4s-состояние.
При дальнейшем возрастании заряда ядра у следующего после кальция элемента — скандия состояние 3d становится энергетически более выгодным, чем 4р.
Элементы, в атомах которых заполняются d-орбитали, называются d-элементами. У d-элементов 4-го периода, следовательно, достраивается слой М до 18 электронов.
После заполнения 3d-орбиталей у последующих шести элементов (Ga — Kr) заполняются р-орбитали внешнего слоя.
В пятом периоде заполнение электронных слоев и подслоев происходит, как и в четвертом периоде.
Шестой период содержит 32 элемента и тоже начинается двумя s-элементами (Cs и Ва). Далее, у лантана начинает заполняться d-орбиталь предвнешнего слоя (5d-подслой).
У следующих за лантаном 14 элементов (Се — Lu) энергетически более выгодно 4f-состояние по сравнению с 5d-состоянием. Поэтому у этих элементов происходит заполнение 4f-орбиталей, чем и объясняется существование лантаноидов.
Аналогичная ситуация в седьмом периоде: имеются два s-элемента (Fr, Ra), за ними следуют d-элемент Ас и четырнадцать f-элементов (Th — Lr)(актиноиды), далее снова d-элементы.
cyclowiki.org
Названия химических элементов
Названия химических элементов
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113* | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115* | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117* | Ts | Tennessine | Тенессин |
| 118* | Og | Oganesson | Оганессон |
Символы и названия элементов даны по материалам 2009 г. IUPAC (International Union of Pure and Applied Chemistry) (см. Pure Appl. Chem., 2011, 83, 359-396). ATOMIC WEIGHTS OF THE ELEMENTS 2009 Имена flerovium (Fl) для 114-го элемента и livermorium (Lv) для 116-го элемента были одобрены (см. Pure Appl. Chem., 2012, 84, 1669-1672)
* После утверждения открытия этих элементов, первооткрывателям было предложено дать им имена. Отдел неорганической химии IUPAC рассмотрел эти предложения и рекомендует их для принятия. До официального утверждения имен советом IUPAC, проходит пятимесячного публичное обсуждение, которое закончится 8 ноября 2016 года.(см. http://iupac.org/elements.html)
nuclphys.sinp.msu.ru
Химический элемент Википедия
Хими́ческий элеме́нт — это совокупность атомов с одинаковым зарядом атомных ядер. Атомное ядро состоит из протонов, число которых равно атомному номеру элемента, и нейтронов, число которых может быть различным[1]. Каждый химический элемент имеет своё латинское название и химический символ, состоящий из одной или пары латинских букв, регламентированные ИЮПАК и приводятся, в частности, в таблице Периодической системы элементов Менделеева[2].
Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные)[3]. Необходимо различать химические элементы (абстрактные объекты, описываемые через свои характеристики) и соответствующие им материальные объекты — простые вещества (обладающие определёнными физико-химическими свойствами)[4].
По состоянию на 2016 год известно 118[5] химических элементов. 94 из них встречаются в природе (некоторые лишь в микроколичествах), а остальные 24 искусственно синтезированы.
История становления понятия[ | ]
Слово «элемент» (лат. elementum) использовалось ещё в античности (Цицероном, Овидием, Горацием) как часть чего-то (элемент речи, элемент образования и т. п.). В древности было распространено изречение «Как слова состоят из букв, так и тела — из элементов». Отсюда — вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» — «em» — «en» — «tum»).[6]
Близкое к современному пониманию понятие химического элемента отражала новая система химической философии, изложенная Робертом Бойлем в книге «Химик-скептик» (1661). Бойль указал, что ни четыре стихии Аристотеля, ни три принципа алхимиков не могут быть признаны в качестве элементов. Элементы, согласно Бойлю — практически неразложимые тела (вещества), состоящие из сходных однородных (состоящих из первоматерии) корпускул, из которых составлены все сложные тела и на которые они могут быть разложены. Корпускулы могут различаться формой, размером, массой. Корпускулы, из которых образованы тела, остаются неизменными при превращениях последних[7].
В 1789 г. Антуан Лоран Лавуазье в «Элементарном курсе химии», приводит первый в истории новой химии список химических элементов (таблицу простых тел), разделённых на несколько типов. Он впервые отождествляет с химическими элементами ряд простых веществ (в их числе, кислород, азот, водород, сера, фосфор, уголь и все известные к тому времени металлы). В число элементов были включены свет, теплород и «солеобразующие землистые вещества» (трудноразлагаемые оксиды кальция, магния и др.). Данную концепцию элементов принято называть эмпирико-аналитической, поскольку Лавуазье избрал критерием определения элемента опыт и только опыт, категорически отвергая любые неэмпирические рассуждения об атомах и молекулах, само существование которых невозможно подтвердить экспериментально[8].
Благодаря Джону Дальтону в начале XIX в. в химии возобладала атомно-молекулярная гипотеза, рассматривающая химический элемент как отдельный вид атомов и указывающая на природу простых и сложных веществ, как состоящих, соответственно, из атомов одного или различного видов. Дальтон же впервые указывает
ru-wiki.ru
Химический элемент — Википедия
Материал из Википедии — свободной энциклопедии
Хими́ческий элеме́нт — это совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке. Атомное ядро состоит из протонов, число которых равно атомному номеру элемента, и нейтронов, число которых может быть различным[1]. Каждый химический элемент имеет своё латинское название и химический символ, состоящий из одной или пары латинских букв, регламентированные ИЮПАК и приводятся, в частности, в таблице Периодической системы элементов Менделеева[2].
Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные)[3]. Необходимо различать химические элементы (абстрактные объекты, описываемые через свои характеристики) и соответствующие им материальные объекты — простые вещества (обладающие определёнными физико-химическими свойствами)[4].
По состоянию на май 2016 года известно 126[5][нет в источнике] химических элементов .
Слово «элемент» (лат. elementum) использовалось ещё в античности (Цицероном, Овидием, Горацием) как часть чего-то (элемент речи, элемент образования и т. п.). В древности было распространено изречение «Как слова состоят из букв, так и тела — из элементов». Отсюда — вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» — «em» — «en» — «tum»).[6]
Близкое к современному пониманию понятие химического элемента отражала новая система химической философии, изложенная Робертом Бойлем в книге «Химик-скептик» (1661). Бойль указал, что ни четыре стихии Аристотеля, ни три принципа алхимиков не могут быть признаны в качестве элементов. Элементы, согласно Бойлю — практически неразложимые тела (вещества), состоящие из сходных однородных (состоящих из первоматерии) корпускул, из которых составлены все сложные тела и на которые они могут быть разложены. Корпускулы могут различаться формой, размером, массой. Корпускулы, из которых образованы тела, остаются неизменными при превращениях последних[7].
В 1789 г. Антуан Лоран Лавуазье в «Элементарном курсе химии», приводит первый в истории новой химии список химических элементов (таблицу простых тел), разделённых на несколько типов. Он впервые отождествляет с химическими элементами ряд простых веществ (в их числе, кислород, азот, водород, сера, фосфор, уголь и все известные к тому времени металлы). В число элементов были включены свет, теплород и «солеобразующие землистые вещества» (трудноразлагаемые оксиды кальция, магния и др.). Данную концепцию элементов принято называть эмпирико-аналитической, поскольку Лавуазье избрал критерием определения элемента опыт и только опыт, категорически отвергая любые неэмпирические рассуждения об атомах и молекулах, само существование которых невозможно подтвердить экспериментально[8].
Благодаря Джону Дальтону в начале XIX в. в химии возобладала атомно-молекулярна
arquivo.pt
Значение словосочетания ХИМИЧЕСКИЙ ЭЛЕМЕНТ. Что такое ХИМИЧЕСКИЙ ЭЛЕМЕНТ?
- Хими́ческий элеме́нт — это совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке. Атомное ядро состоит из протонов, число которых равно атомному номеру элемента, и нейтронов, число которых может быть различным. Каждый химический элемент имеет своё латинское название и химический символ, состоящий из одной или пары латинских букв, регламентированные ИЮПАК и приводятся, в частности, в таблице Периодической системы элементов Менделеева.
Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные). Необходимо различать химические элементы (абстрактные объекты, описываемые через свои характеристики) и соответствующие им материальные объекты — простые вещества (обладающие определёнными физико-химическими свойствами).
По состоянию на 2016 год известно 118 химических элементов.
Источник: Википедия
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать Карту слов. Я отлично умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Я уже понял, что опыт — это нечто положительное. Помоги мне понять, что позволяет оценить опыт как положительное — эмоции (чувства, переживания) или практичность (выгода, полезность, правильность)?
Больше эмоции,чем практичность
Скорее практичность,чем эмоции
Абсолютнаяпрактичность
Это изначальнонейтральное
kartaslov.ru