Сколько элементов в таблице Менделеева. Радиус элементов в таблице менделеева
Ионные радиусы таблицы - Справочник химика 21
Используя данные по энергии ионизации, сродства к электрону, ионные радиусы и энергию гидратации, Клопман рассчитал для ряда катионов и анионов энергии внешних орбиталей распределение этих ионов по мере убывания энергии поразительно хорошо совпадает с ходом изменения степени жесткости (мягкости) ионов в водной среде (табл. В. 10). Приведенные в таблице данные следует сравнивать отдельно в ряду катионов и анионов. Для катионов жесткие кислоты имеют положительное значение энергии мягкие кислоты — отрицательное. Это распределение в основном согласуется с активностью соответствующих соединений в реакциях. Единственным исключением является протон, который представляет собой более жесткую кислоту, чем это следует из данных табл. В.Ю. В то же время теория верно, предсказывает, что Т1 + — более мягкий ион, чем Т1+. Причиной этого является П52-конфигурация электронов Т1+ (наличие инертной пары электронов). В последовательности анионов энергия Е имеет только отрицательное значение (около —10 эВ). Область энергии около 10 эВ является границей между жесткими и мягкими соединениями. [c.401]
| Таблица 7,10. Ионные радиусы, А |
F" (1,33 A) с помощью оптических методов. Зная эту величину, можно найти TNa+ = 2,31—1,33 = 0,98 А гс - = 2,81—0,98 = 1,83 А и т. д. Таблицы ионных радиусов имеются в справочниках. [c.130]
В табл. 21.8 указан ряд важнейших свойств атомов элементов группы 6А. Энергия простой связи X—X получена путем оценки данных для соответствующих элементов, кроме кислорода. В последнем случае, поскольку связь О—О в молекуле Oj не является простой (см. разд. 8.6 и 8.7, ч. 1), оценку проводили по значению энергии связи О—О в пероксиде водорода. Восстановите льный потенциал, указанный в последней строке таблицы, относится к восстановлению элемента в его стандарлном состоянии с образованием Н,Х(водн.) в кислом растворе. Для большинства указанных в табл. 21.8 свойств снова наблюдается закономерная зависимость от атомного номера элемента. Атомные и ионные радиусы увеличиваются, соответственно энергия ионизации уменьшается, как и следует ожидать на основе изложенного в разд. 6.5, ч. 1. [c.300]
В периодической системе (см. табл. на форзаце). Потенциал ионизации выражается в электрон-вольтах, ионные радиусы — в ангстремах. Сопоставление этих величин, например, для щелочных металлов, галогенов, водорода показывает, что действительно водород не относится ни к первой группе, ни к седьмой, а занимает особое положение в периодической системе. В таблице 6 приведены значения lg(/p r ) для различных аналитических групп. Каждая группа характеризуется определенным значением этой величины. Например, для катионов щелочных металлов lg t, = l,35—1,40, для анионов галогенов lg/e = l,38—1,41. Таким образом, как потеря, так и приобретение одного электрона соответствует одному и тому же значению кх. Для ионов Р , С1 , Вг , 1 вместо потенциала ионизации взято электронное сродство. У иона же Н 12Й,=0 или близок к нему. (Ионный радиус Н 1,36 А взят по Бокию и Белову.) [c.24]
Сравнение данных этой и предыдущей таблиц показывает, что радиусы ПОПОВ в растворе близки к кристаллическим ионным радиусам, как это и следует нз современной теории растворов. [c.242]
В табл. 4.2, а также в таблицах по атомным характеристикам различных элементов (второй раздел) указаны значения соответствующих радиусов для всех элементов. При этом ионные радиусы г приведены по шкале, в которой в качестве базовых используются Гр- = = 0,133 нм и го -= 0,140 нм. [c.51]
Основополагающие результаты получены Л. Полингом в цикле исследований структуры молекул. Ученый впервые рассчитал величины ионных радиусов, составил их таблицы, сформулировал некоторые общие правила образования ионных кристаллических структур, дал квантовомеханическое описание гомеополярной связи и решение проблемы направленности валентностей. Выдающимся вкладом в мировую науку являются работы Л. Полинга по теории химической связи н структуре сложных молекул. В последнее время интересы Л. Полинга сконцентрированы на проблемах молекулярной биологии. [c.5]
Ионные радиусы кристаллов для ряда катионов и анионов приведены в табл. 19.1. Данные таблицы показывают, что в каждой группе периодической системы ионные радиусы возрастают с увеличением числа орбитальных электронов. [c.580]
В последнее время достаточно широкое распространение получило представление об орбитальном радиусе, под которым понимается теоретически рассчитанное расстояние от ядра до главного максимума электронной плотности внешней орбитали Радиус внешней орбитали атома или иона определяет атомный или ионный орбитальный радиус В отличие от эффективного, орбитальный радиус является характеристикой свободного атома или иона, т е не зависит от природы химической связи, что создает определенные трудности при использовании таких величин для реальных химических соединений В табл 4 2, а также в таблицах по атомным характеристикам различных элементов (второй раздел) указаны значения соответствующих радиусов для всех элементов При этом ионные радиусы г приведены по шкале, в которой в качестве базовых используются гр- = = 0,133 нм и го - = 0,140 нм [c.47]
В настоящее время в литературе имеется несколько таблиц ионных радиусов. Объясняется это обстоятельство главным образом тем, что в основу таблицы авторами кладутся разные величины исходных ионных радиусов. Как было сказано выше, Гольдшмидт положил в основу таблицы величины ионных радиусов фтора (1,33) и кислорода (1,32). Расчетный же радиус иона кислорода, по Полингу, равен 1,40. Отсюда резкое расхождение в эначениях ионных радиусов двухвалентных и трехвалентных металлов, определяемых главным образом из структур их окислов, в таблицах Гольдшмидта и Полинга. Нет сомнения в том, что В. М, Гольдшмидт преуменьшил значение радиуса иона кислорода, но и величина 1,40, несомненно, слишком велика. [c.137]
Из таблицы ионных радиусов (табл. 11) видно, что этому условию хорошо удовлетворяют анионы. Катионы же, напротив, характеризуются меньшими размерами и часто большими зарядами. В силу этого они поляризуются значительно слабее, но способность поляризовать соседние ионы тем сильнее, чем они меньше и чем больше их заряд. Катионы с конфигурацией наружной электронной оболочки, отвечающей благородному газу, например Na" ", a и т. п., поляризуют соседние ионы и сами поляризуются слабее, чем катионы с 18-электронной внешней оболочкой, например Си , Ag+ и др. [c.144]
Растворимость галоидных солей щелочных металлов при 0° С показана в табл. 33. Если данных для 0° С в литературе нет, то в скобках указана другая температура. Из данных таблицы видно, что прямой зависимости растворимости от величины ионных радиусов нет. Это очевидно, так как растворимость зависит не только от величин энергии решетки, но и от величин теплоты гидратации. Последняя ше зависит от размеров ионов иначе, чем энергия решетки. Приблизительные данные для теплот гидратации Н можно получить путем измерения теплот растворения Ь [c.251]
Примерные радиусы действия ионов представлены в периодической таблице элементов Д. И. Менделеева, они определены для комнатной температуры и стандартных структур. По таблице Д. И. Менделеева в каждой группе радиус сверху вниз увеличивается, а в периоде слева направо — уменьшается. Такому правилу не подчиняются лантаноиды. В этой аномальной группе от Ьа (№ 57) до Ьи (№ 71) ионный радиус постепенно уменьшается от 0,122 до 0,099 нм. Это явление и было названо лантаноидным сжатием. Благодаря ему ионный радиус Н + уменьшается примерно на 0,02 нм (как это проявляется во всех периодах) не от 0,122, а от 0,099 нм и таким образом этот элемент приобретает радиус сферы действия 0,077 нм, что равно или почти равно сфере действия 2г +. По этой же причине оказываются равными радиусы действия и Та +, Мо + и °+, Аи и А . [c.18]
И двух пикратов [28], приведены в табл. 38. В неполярных растворителях, подобных бензолу, в которых, как предполагается, отсутствует сольватация, размеры ионов галоидных солей в растворе изменяются в зависимости от атомного номера в той же последовательности, что и ионные радиусы, вычисленные на основании рентгенографического изучения соответствую-ш их твердых веш еств (табл. 6). Из табл. 38 видно, что К (Л ) уменьшается при переходе от иодидов к фторидам, и это может служить доказательством того, что К уменьшается в том же направлении, поскольку Л должно несколько увеличиваться при переходе от большого иона иода к малому (а следовательно, и более подвижному) иону фтора. Так как при вычислении приведенных в таблице значений gK сделано предположение, что А =100 для всех солей, наблюдаемые изменения К при переходе от одного электролита к другому несомненно слишком малы. [c.199]
ИЛИ иона. В периодической системе, составленной Кэмбеллом (табл. 4-2), проиллюстрированы изменения атомных и ионных радиусов. Таблица Кэмбелла построена по типу длинной периодической системы, и атомы, и ионы изображены в форме кружков разных размеров. Радиусы кружков соответствуют относительной величине атомов и ионов, определенных рентгеноскопически. Величины радиусов в ангстремах приведены под кружками. [c.104]
Периодическая таблица элементов по Кембеллу с атомными и ионными радиусами [c.109]
Вычисленные по радиусам Гольдшмвдта межъядерные расстояния в кристаллах хорошо согласую тся с опытом. Это позволяет проводить расчеты для тех кристаллов, у которых эти расстояния еще не измерены. Величина ионного радиуса изменяется с изменением координационного числа. Обычно в таблицах приводятся радиусы для КЧ = 6, [c.168]
В табл. 55 в верхних строчках приведены значения нормальных ионных радиусов (г ) элементов групповой валентности, во вторых — нормальные ионные рефракции. Для катионов, собственные значения рефракций которых невелики, в таблице приведены величины пониых рефракций без указания длины волны, так как влияние дисперсии лежит в пределах точности определений Для анионов даны два значения рефракций — для желтого света (Яо) и бесконечной длины волны ( оо). [c.113]
Эффективныйрадиусиона — это радиус сферы действия пона в данном кристалле. Он не является для данного иона (как и радиус атома) строго определенной величиной, так как зависит от типа связи и от координационного числа. Эффективные радиусы определяют из расстояний d между центрами соседних ионов. Эти расстояния определяются с большой точностью современными методами рентгеноструктурпого анализа (Вульф, Брэгги, Дебай и др.). Их приравнивают сумме радиусов ионов. Например, у Na l длина ребра элементарной ячейки найдена равной 0,562 нм, отк -да d= = 0,281 нм, у фторида натрия Л=0,231 нм и т. д. Однако, чтобы определить ионные радиусы, нельзя d просто делить пополам, как это делается при вычислении радиусов атомов в атомных решетках простых веществ. Надо знать, по крайней мере, радиус одного иона, найденный тем или другим способом. Наиболее надежное исходное значение было получено для иона F (0,133 нм) с помощью оптических методов, зная которое можно определить радиусы = 0,231—0,133 = 0,098 нм Гс,- = = 0,281—0,098=0,183 нм и т. д. Таблицы ионных радиусов приведены в справочной литературе. [c.160]
Для расчета энергии решетки по этой формуле необходимо знать состав вещества, т. е. число ионов в молекуле 2т и их валентности Zl и 2, а также иметь таблицу ионных радиусов для координапионного числа шесть. Таким образом, эта фор- [c.174]
Верхняя строка —степень поляризации в единицах 10 м3 относительно Р с до-ляри.9уемостью 1,0 10 м . Нижняя строка—поляризующая способность, рассчитанная по формуле (г—ионный радиус). Отсутствующие в таблице даииые для часта [c.184]
Все указанные ионы являются активными, однако скорость замещения лигандов в их координационной сфере изменяется в щироком диапазоне. Общая закономерность состоит в том, что для ионов с большим зарядом характерна сравнительно низкая скорость обмена, а при одинаковых зарядах меньшая скорость обмена наблюдается для ионов с меньшими ионными радиусами. Чтобы включить в этот обзор и данные о комплексах, содержащих полидентатные и другие лиганды, а также данные по неводным растворам, классификации Таубе, делящей все ионы на два класса, недостаточно. Более рациональным является деление ионов на 3 класса (табл. 4.36). Из этой таблицы исключены многочисленные примеры медленных реакций замещения в комплексах невернеровского типа. [c.246]
chem21.info
9 класс. Химия. Описание элемента по положению в Периодической системе элементов Д.И. Менделеева - Описание элемента по положению в Периодической системе элементов Д.И. Менделеева
Комментарии преподавателя
1. Какие характеристики атома меняются в Периодической системе периодически
В 1869 году Д.И.Менделеев на основе данных накопленных о химических элементах сформулировал свой периодический закон. Тогда он звучал так: « Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных масс элементов». Очень долго физический смысл закона Д.И.Менделеева был непонятен. Всё встало на свои места после открытия в XX веке строения атома.
Современная формулировка периодического закона: « Свойства простых веществ, также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома».
Заряд ядра атома равен числу протонов в ядре. Число протонов уравновешивается числом электронов в атоме. Таким образом, атом электронейтрален.
Заряд ядра атома в Периодической таблице – это порядковый номер элемента.
Номер периода показывает число энергетических уровней, на которых вращаются электроны.
Номер группы показывает число валентных электронов. Для элементов главных подгрупп число валентных электронов равно числу электронов на внешнем энергетическом уровне. Именно валентные электроны отвечают за образование химических связей элемента.
Химические элементы 8 группы – инертные газы имеют на внешней электронной оболочке 8 электронов. Такая электронная оболочка энергетически выгодна. Все атомы стремятся заполнить свою внешнюю электронную оболочку до 8 электронов.
Какие же характеристики атома меняются в Периодической системе периодически?
- Повторяется строение внешнего электронного уровня.
- Периодически меняется радиус атома. В группе радиус увеличивается с увеличением номера периода, так как увеличивается число энергетических уровней. В периоде слева направо будет происходить рост атомного ядра, но притяжение к ядру будет больше и поэтому радиус атома уменьшается.
- Каждый атом стремится завершить последний энергетический уровень У элементов 1 группы на последнем слое 1 электрон. Поэтому им легче его отдать. А элементам 7 группы легче притянуть 1 недостающий до октета электрон. В группе способность отдавать электроны будет увеличиваться сверху вниз, так ка увеличивается радиус атома и притяжение к ядру меньше. В периоде слева направо способность отдавать электроны уменьшается, потому что уменьшается радиус атома.
- Чем легче элемент отдает электроны с внешнего уровня, тем большими металлическими свойствами он обладает, а его оксиды и гидроксиды обладают большими основными свойствами. Значит, металлические свойства в группах увеличиваются сверху вниз, а в периодах справа налево. С неметаллическими свойствами все наоборот.
2. Описание элемента магния, астата, хлора
Рис. 1. Положение магния в таблице
В группе магний соседствует с бериллием и кальцием. Рис.1. Магний стоит ниже, чем бериллий, но выше кальция в группе. У магния больше металлические свойства, чем у бериллия, но меньше чем у кальция. Основные свойства его оксидов и гидроксидов изменяются также. В периоде натрий стоит левее, а алюминий правее магния. Натрий будет проявлять больше металлические свойства, чем магний, а магний больше, чес алюминий. Таким образом, можно сравнить любой элемент с соседями его по группе и периоду.
Кислотные и неметаллические свойства изменяются противоположно основным и металлическим свойствам.
3. Описание элемента хлора
Характеристика хлора по его положению в периодической системе Д.И.Менделеева.
Рис. 4. Положение хлора в таблице
. Значение порядкового номера 17 показывает число протонов17 и электронов17 в атоме. Рис.4. Атомная масса 35 поможет вычислить число нейтронов (35-17 = 18). Хлор находится в третьем периоде, значит число энергетических уровней в атоме равно 3. Стоит в 7 –А группе, относится к р- элементам. Это неметалл. Сравниваем хлор с его соседями по группе и по периоду. Неметаллические свойства хлора больше чем у серы, но меньше, чем у аргона. Хлор обладает меньшими металлическими свойствами, чем фтор и большими чем бром. Распределим электроны по энергетическим уровням и напишем электронную формулу. Общее распределение электронов будет иметь такой вид. См.Рис. 5
|
|
Рис. 5. Распределение электронов атома хлора по энергетическим уровням
Определяем высшую и низшую степень окисления хлора. Высшая степень окисления равна +7, так как он может отдать с последнего электронного слоя 7 электронов. Низшая степень окисления равна -1, потому что хлору до завершения необходим 1 электрон. Формула высшего оксида Cl2O7 (кислотный оксид), водородного соединения HCl.
4. Степень окисления
В процессе отдачи или присоединения электронов атом приобретает условный заряд. Этот условный заряд называется степенью окисления.
- Простые вещества обладают степенью окисления равной нулю.
- Элементы могут проявлять максимальную степень окисления и минимальную. Максимальную степень окисления элемент проявляет тогда, когда отдает все свои валентные электроны с внешнего электронного уровня. Если число валентных электронов равно номеру группы, то и максимальная степень окисления равна номеру группы.
Рис. 2. Положение мышьяка в таблице
Минимальную степень окисления элемент будет проявлять тогда, когда он примет все возможные электроны для завершения электронного слоя.
Рассмотрим на примере элемента №33 значения степеней окисления.
Это мышьяк As.Он находится в пятой главной подгруппе.Рис.2. На последнем электронном уровне у него пять электронов. Значит, отдавая их, он будет иметь степень окисления +5. До завершения электронного слоя атому As не хватает 3 электрона. Притягивая их, он будет иметь степень окисления -3.
Положение элементов металлов и неметаллов в Периодической системе Д.И. Менделеева.
Рис. 3. Положение металлов и неметаллов в таблице
В побочных подгруппах находятся все металлы. Если мысленно провести диагональ от бора к астату, то выше этой диагонали в главных подгруппах будут все неметаллы, а ниже этой диагонали - все металлы. Рис.3.
Используя Периодическую систему можно очень много сказать об элементе. Можно сравнить его с другими элементами, определить строение его атома, электронной оболочки атома.
5. План характеристики химического элемента
1. Символ элемента
2. Порядковый номер элемента
3. Значение относительной атомной массы элемента.
4. Число протонов, электронов, нейтронов.
5. Номер периода.
6. Номер и тип группы (тип элемента s -, p -,d -,f - элемент)
7. Металл или неметалл
8. Сравнение свойств элемента (металлических и неметаллических) с соседними элементами по периоду и группе.
9. Написать распределение электронов по атомным орбиталям – квантовую диаграмму.
10. Написать электронную формулу.
11. Зарисовать распределение электронов по энергетическим уровням
12. Определить высшую степень окисления атома и формулу его высшего оксида. Определить характер оксида (основной, кислотный, амфотерный).
13. Определить низшую степень окисления элемента и формулу его водородного соединения (если такое есть).
Подведение итога урока
На этом уроке вы узнали о Периодическом законе Менделеева, который описывает изменение свойств простых тел, а также формы и свойства соединений элементов в зависимости от величины их атомных масс. Рассмотрели, как по положению в Периодической системе можно описать химический элемент.
Источники
http://www.youtube.com/watch?t=2&v=utSggOMiS3g
http://www.youtube.com/watch?v=1EKDbO-ih2Q
http://www.youtube.com/watch?t=6&v=K8zkzyDZOQs
источник презентации - http://ppt4web.ru/khimija/periodicheskaja-sistema-khimicheskikh-ehlementov-di-mendeleeva0.html
Конспект http://interneturok.ru/ru/school/chemistry/9-klass
www.kursoteka.ru
| ||||||||||||||||||||||
|
||||||||||||||||||||||
R2O |
RO |
R2O3 |
RO2 |
R2O5 |
RO3 |
R2O7 |
RO4 |
|||||||||||||||
Rh5 |
Rh4 |
h3R |
HR |
|||||||||||||||||||
Лантаноиды |
||||||||||||||||||||||
Актиноиды |
||||||||||||||||||||||
| ||||||||||||||||||||||
himik.pro
Группа и период в Таблице Менделеева.
1.Гру́ппа периодической системы химических элементов — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением.Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома.
В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы. Подгруппы также имеют названия по элементу с наименьшим зарядом ядра (как правило, по элементу второго периода для главных подгрупп и элементу четвёртого периода для побочных подгрупп). Элементы одной подгруппы обладают сходными химическими свойствами.
С возрастанием заряда ядра у элементов одной группы из-за увеличения числа электронных оболочек увеличиваются атомные радиусы, вследствие чего происходит снижение электроотрицательности, усиление металлических и ослабление неметаллических свойств элементов, усиление восстановительных и ослабление окислительных свойств образуемых ими веществ.2.Период — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки.
Периодическая система имеет семь периодов. Первый период, содержащий 2 элемента, а также второй и третий, насчитывающие по 8 элементов, называются малыми. Остальные периоды, имеющие 18 и более элементов — большими. Седьмой период не завершён. Номер периода, к которому относится химический элемент, определяется числом его электронных оболочек (энергетических уровней).
Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл.
В первом периоде, кроме гелия, имеется только один элемент — водород, сочетающий свойства, типичные как для металлов, так и (в большей степени) для неметаллов. У этих элементов заполняется электронами 1s-подоболочка.
Для элементов малых периодов характерно достаточно быстрое увеличение электроотрицательности с увеличением зарядов ядер, ослабление металлических свойств и усиление неметаллических.
otvet.mail.ru
Периодический закон и периодическая система химических элементов Д.И. Менделеева.
ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА.
К середине XIX в. – периода завершения второго химико-аналитического этапа развития химии – было открыто уже более 60 элементов, у большинства которых были изучены физические и химические свойства (некоторые из элементов к этому времени не были выделены еще в чистом виде).
Открытие новых элементов и изучение свойств элементов и их соединений, с одной стороны, позволили накопить большой фактический материал, а с другой – выявили необходимость его систематизации. Первыми попытками систематизации элементов следует, по-видимому, считать установление их общих групповых свойств. Так, наиболее резко выраженный основный характер был обнаружен у соединений элементов, названных щелочными металлами, а способность к проявлению кислотных свойств – у соединений галогенов. Кроме того, для многих элементов были получены количественные характеристики, определяющие их свойства. Среди них наибольший интерес представляли относительная атомная масса элементов и их валентность, т.е. способность к образованию различных форм соединений.
Ни одна из попыток классифицировать химические элементы не выявила основной закономерности в их расположении и, следовательно, не могла привести к созданию естественной системы, охватывающей все химические элементы и отражающей природу их сходства и различия. Решение этой задачи оказалось доступно лишь нашему соотечественнику Д.И. Менделееву.
Д.И. Менделеев исходил из убеждения, что в основу классификации должна быть положена фундаментальная количественная характеристика элементов – атомная масса, от которой «должны находиться в зависимости все остальные свойства». Но найти эту зависимость было крайне трудно по двум причинам:
1) далеко не все химические элементы были известны к началу работы Д.И. Менделеева;
2) атомные массы некоторых элементов были установлены неточно, и их формальное сопоставление приводило к недоразумениям.
В отличие от всех своих предшественников русский учёный сопоставил между собой несходные элементы, расположив все известные элементы в порядке возрастания атомных масс. Ниже приведены первые 14 элементов этой последовательности:
происходит закономерное ослабление металлических свойств и усиление неметаллических с одновременным увеличением валентности. Переход от фтора к следующему по значению атомной массы элементу сопровождается скачкообразным изменением свойств и валентности, причем натрий во многом повторяет свойства лития, будучи типичным одновалентным металлом, хотя и более активным. Следующий за натрием магний Mg во многом сходен с бериллием (оба двухвалентны, проявляют металлические свойства, но химическая активность обоих выражена слабее, чем у пары ). Алюминий , следующий за магнием, напоминает бор B (валентность равна 3). Как близкие родственники похожи кремний Si и углерод C, фосфор P и азот N, сера S и кислород O, хлор Cl и фтор F . При переходе к следующему за хлором в последовательности увеличения атомной массы элементу калию K опять происходит скачок в изменении валентности и химических свойств. Калий, подобно литию и натрию, открывает ряд элементов (третий по счёту), представители которого показывают глубокую аналогию с элементами первых двух рядов.
Таким образом, в естественном ряду элементов (т.е. элементов, расположенных в порядке возрастания атомной массы) их химические свойства изменяются не монотонно, а периодически. Закономерное изменение свойств элементов в пределах одного отрезка естественного ряда повторяются и у других . Иначе говоря, сходные в химическом отношении элементы встречаются в естественном ряду через правильные интервалы и, следовательно, повторяются периодически. Эта замечательная закономерность, обнаруженная Д.И. Менделеевым и названная им законом периодичности, была сформулирована следующим образом:
Свойства простых тел, а также форма и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Открытый закон периодичности Д.И. Менделеев использовал для создания периодической системы элементов. «Днем рождения» системы Д.И. Менделеева обычно считают 18 февраля 1869 г., когда был составлен первый вариант таблицы. В этой таблице 63 известных Д.И. Менделееву элемента были расположены в порядке возрастания атомных масс. Это расположение отражало также периодичность изменения свойств элементов. В таблице были оставлены пустые места для четырех еще не открытых элементов с атомными массами 45, 68, 70 и 180. Существование их было предсказано Д.И. Менделеевым.
Закон периодичности и периодическая система элементов сыграли важную конструктивную роль при проверке и уточнении свойств многих элементов. Однако настоящий триумф периодической системы Д.И. Менделеева был связан с открытием предсказанных им элементов. В 1875 г. французский химик П. Лекок де Буабодран, исследуя цинковые руды методами спектрального анализа, обнаружил следы неизвестного элемента. Открытие этого элемента, названного галлием, быть может, прошло бы незаметным, если бы некоторое время спустя автор не получил письмо от русского ученого, в котором утверждалось, что плотность нового элемента должна быть равна не , как сообщал П. Лекок де Буабодран, а . Повторные измерения плотности очищенного от примеси галлия дали значение .
Предсказывая свойства неизвестных элементов, Д.И. Менделеев использовал вытекавшее из периодического закона правило звездности, в соответствии с которым свойства любого химического элемента находятся в закономерной связи со свойствами соседних элементов, расположенных по горизонтали , вертикали и диагонали .
Спустя несколько лет шведский ученый Л. Нильсон открыл предсказанный Д.И. Менделеевым экабор, назвав его скандием. Наконец, в 1886 г. немецкий химик К. Винклер открыл новы элемент – германий, свойства которого полностью совпали со свойствами, указанными Д.И. Менделеевым для экасицилия. После этого периодический закон получил всемирное признание, а периодическая система стала неотъемлимой частью любого учебника по химии.
В настоящее время существует несколько вариантов графического построения периодической системы. Рассмотрим один из них – короткопериодный.
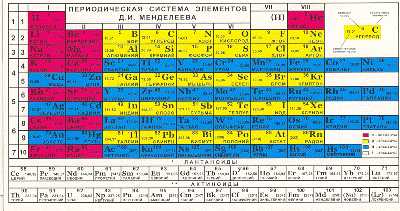
Эта таблица состоит из 10 горизонтальных рядов и 8 вертикальных столбцов, называемых группами. В первом горизонтальном ряду только два элемента – водород H и гелий He. Второй и третий ряды образуют периоды по 8 элементов, причем каждый из периодов начинается щелочным металлом и кончается инертным элементом. Четвертый ряд также начинается щелочным металлом (калий), но в отличие от предыдущих рядов он не заканчивается инертным элементом. В пятом ряду продолжается последовательное изменение свойств, начавшееся в четвертом ряду, так что эти два ряда образуют один так называемый большой период из 18 элементов. Как и предыдущие два, этот период начинается щелочным металлом К и кончается инертным элементом криптоном Kr. Один большой период составляют и последующие два ряда – шестой и седьмой (от до ).
В восьмом ряду дополнительное осложнение связано с тем, что после идут 14 элементов чрезвычайно сходные с ним по свойствам, названные лантаноидами. В приведенной таблице они размещены в виде отдельного ряда. Таким образом, восьмой и девятый ряды образуют большой период, содержащий 32 элемента (от до ). Наконец, десятый ряд элементов составляет незавершенный VII период. Он содержит лишь 21 элемент, из которых 14, очень сходные по свойствам с , выделены в самостоятельный ряд актиноидов. Как мы теперь знаем, такая структура таблицы является отражением фундаментальных свойств химических элементов, связанных с особенностями строения их атомов.
В вертикальных столбцах таблицы – группах располагаются элементы, обладающие одинаковой валентностью в высших солеобразующих оксидах (она указана римской цифрой). Каждая группа разделена на две подгруппы, одна из которых (главная) включает элементы малых периодов и четных рядов больших периодов, а другая (побочная) образована элементами нечетных рядов больших периодов.
Различия между главными и побочными подгруппами ярко проявляются в крайних группах таблицы (исключая VIII). Так, главная подгруппа I группы включает очень активные щелочные металлы, энергично разлагающие воду, тогда как побочная подгруппа состоит из , и , малоактивных в химическом отношении. В VII группе главную подгруппу составляют активные неметаллы: , , , и , тогда как у элементов побочной подгруппы - , и – преобладают металлические свойства. VIII группа элементов, занимающая особое положение, состоит из девяти элементов, разделенных на три триады очень сходных друг с другом элементов, и подгруппы инертных элементов.
У элементов главных подгрупп при увеличении атомной массы наблюдается усиление металлических свойств и ослабление неметаллических.
Согласно формулировке закона Д.И. Менделеева периодичность изменения свойств касается не только химических элементов, но и образуемых ими простых и сложных веществ. Периодичность изменения обнаружена для молярных объёмов, температур плавления и кипения, для магнитных и электрических свойств, для теплот образования, теплоемкости и многих других физико-химических свойств, характеризующих простые и сложные вещества.
Открытие периодического закона и создание системы химических элементов имело огромное значение не только для химии, но и для всего естествознания в целом. Открытие Д.И. Менделеева обогатило человеческое знание одной из фундаментальных закономерностей природы.
Периодический закон послужил толчком к исследованиям строения атома, которые изменили наши представления о законах микромира и привели к практическому воплощению идеи использования ядерной энергии.
Однако к моменту открытия периодического закона только лишь стали утверждаться представления о молекулах и атомах. Причем атом считался не только наименьшей, но и элементарной (т.е. неделимой) частицей. Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью. В 1896 г. французский физик А. Беккерель обнаружил, что материалы, содержащие уран, засвечивают в темноте фотопластинку, ионизируют газы, вызывают свечение флюоресцирующих веществ. В дальнейшем выяснилось, что этой способностью обладает не только уран. Титанические усилия, связанные с переработкой огромных масс урановой смоляной руды, позволили П. Кюри и М. Склодовской открыть два новых радиоактивных элемента: полоний и радий.
Последовавшее за этим установление природы лучей, образующихся при радиоактивном распаде (Э. Резерфорд, 1899 – 1903 гг.), обнаружение ядер атомов диаметром , занимающих незначительную долю объема атома (Э. Резерфорд, 1909 – 1911 гг.), определение заряда электрона (Р. Милликен, 1909 – 1914 гг.) и доказательство дискретности его энергии в атоме (Дж. Франк, Г. Герц, 1912 г.), установление заряда ядра, равному номеру элемента (Г. Мозли, 1913 г.), и, наконец, открытие протона (Э. Резерфорд, 1920 г.) и нейтрона (Дж. Чедвик, 1932 г.) позволили предложить следующую модель строения атома:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома (радиус атома водорода 0,046 нм, радиус протона – ядра атома водорода ).
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1836 а.е.м.).
3. Ядра атомов состоят из протонов и нейтронов (общее название – нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
4. Вокруг ядра по замкнутым орбитам вращаются электроны. Их число равно положительному заряду ядра.
В таблице приведены свойства элементарных частиц, образующих атомы.
Различные виды атомов имеют общее название – нуклиды. Нуклиды достаточно характеризовать любыми двумя числами из трех фундаментальных параметров: , , равный числу протонов, и в ядре, тогда как третье определяется соотношениями:
Нуклиды с одинаковым Z , но различными A и N называются изотопами, нуклиды с одинаковым A и различными Z и N – изобарами, а нуклиды с одинаковыми N и различными Z и A – изотонами.
Примеры изотопов, изобаров и изотонов среди природных нуклидов (таблица).
Существование изотопов позволяет уточнить смысл важного понятия – моль. Очевидно, что моль – количество вещества, содержащее определенное число структурных единиц, - представляет собой величину, постоянную только для веществ, характеризующихся фиксированным изотопным составом (чаще всего в химии рассматривают вещества, состоящие из природной смеси изотопов).
Атомные массы элементов в периодической таблице, например, являются средним значением из массовых чисел природных смесей изотопов. Поэтому они не могут, как предполагал Д.И. Менделеев, служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой является заряд ядра. Он определяет число электронов в нейтральном атоме, которые распределяются вполне определенным образом вокруг ядра. Характер же распределения электронов определяет химические свойства атомов. Указанные соображения позволили дать новое определение химического элемента и уточнить формулировку периодического закона:
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Свойства элементов, а также свойства и формы их соединений находятся в периодической зависимости от заряда ядра атома элемента.
Ввиду отсутствия представлений о точном характере сил, действующих в атомном ядре, для предсказания его свойств используют две модели ядра – капельную и оболочечную.
Капельная модель ядра, описывающая взаимодействие нуклонов в ядре по аналогии со взаимодействием молекул в капле жидкости, наилучшим образом предсказывает поведение возбужденных ядер.
Оболочечная модель ядра рассматривает поведение ядер, находящихся в основном (невозбужденном) состоянии. В оболочечной модели предполагается, что существуют две системы нуклонных энергетических уровней: одна для нейтронов, другая для протонов, каждая из которых заполняется нуклонами независимо друг от друга. Ядра, имеющие только полностью заполненные нуклонные оболочки, должны обладать повышенной устойчивостью (так же как и атомы, имеющие только полностью заполненные электронные оболочки).
Такими наиболее устойчивыми по сравнению с соседними ядрами являются ядра со значениями N и Z, равными 2, 8, 20, 28, 50, 82, 126 и 152. Эти числа называются магическими. Распространенность таких ядер в природе наиболее велика. Другим примером повышенной стабильности ядер, характеризующихся магическими числами, являются значительно большие периоды полураспада радиоактивных ядер с по сравнению с .
Дважды магическими называются ядра, у которых значения N и Z одновременно принадлежат к магическим. Дважды магические ядра обладают особой устойчивостью; они являются наиболее распространенными в природе изотопами этих элементов.
Оболочечная модель также предсказывает существование повышенной устойчивости у ядер, состоящих из четного числа протонов и четного числа нейтронов. Меньшей стабильности следует ожидать у ядер с одним четным значением (Z или N) и, наконец, минимальной устойчивости у ядер, характеризующихся нечетными значениями N и Z.
273 стабильных изотопа, встречающиеся в природе, распределяются в соответствии с правилом четности и нечетности числа протонов и нейтронов следующим образом:
Z N Число изотопов
четное четное 166
четное нечетное 47
нечетное четное 55
нечетное нечетное 5
Открытое А. Беккерелем явление радиоактивности было первым примером ядерных реакций – превращений ядер одного элемента в ядра другого элемента. Сейчас известно очень много ядерных реакций; все они относятся к физическим явлениям и поэтому рассматриваются в курсе физики.
Рассмотрим закономерности поведения электронов в атоме. Согласно современным представлениям, периодичность изменения свойств элементов, расположенных в порядке возрастания заряда ядра (порядкового номера элемента), обусловлена периодичностью изменения в строении электронной оболочки атомов. Поэтому изучение строения этих оболочек – одна из важнейших задач химии. В модели, предложенной Э. Резерфордом, электроны рассматривались как частицы, движущиеся по плоским орбитам вокруг ядра. В дальнейшем было доказано, что такая картина не отвечает действительности. Оказалось, что движение электронов, как и других элементарных частиц, не может быть отражено законами классической механики.
Самой характерной особенностью электронов является двойственность их поведения, заключающаяся в способности проявлять одновременно как свойства частиц, так и свойства волн: подобно частице, электроны обладают определенной массой и зарядом; движущийся поток электронов проявляет волновые свойства, например характеризуется способностью к дифракции. В отличие от обычных тел для электрона нельзя одновременно определить его координаты в атоме и скорость. Электрон может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова.
Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называется орбиталью.
В современной модели атома состояние в нем электрона определяется четырьмя параметрами – квантовыми числами.
Главное квантовое число определяет энергию электрона и степень его удаления от ядра; оно принимает любые целочисленные значения, начиная с 1 . Исторически энергетическим уровням атомов были приписаны обозначения . Эти обозначения используются и в настоящее время параллельно с указанием значений главного квантового числа . Так, называют энергетический уровень, для которого , – энергетический уровень с и т.д.
Побочное (орбитальное или азимутальное) квантовое число определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до . Каждому значению соответствует орбиталь особой формы. При атомная орбиталь независимо от значения главного квантового числа имеет сферическую форму (s – орбиталь). Значению соответствует атомная орбиталь, имеющая форму гантели (p – орбиталь). Ещё более сложную имеют орбитали, отвечающие высоким значениям l , равным 2, 3 и 4 (d-, f-, g – орбитали).
Магнитное квантовое число определяет положение атомной орбитали в пространстве относительно внешнего магнитного или электрического поля. Магнитное квантовое число изменяется не произвольным образом, а скачком и связано с орбитальным квантовым числом, изменяясь от , включая 0. Следовательно, каждому значению соответствует значений магнитного квантового числа.
Спиновое квантовое число s может принимать лишь два возможных значения: . Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона.
Схема распределения электронов по квантовым уровням представлена в таблице.
ТАБЛИЦА РАСПРЕДЕЛЕНИЯ ЭЛЕКТРОНОВ ПО КВАНТОВЫМ УРОВНЯМ.
|
Энергетический уровень n |
Энергетический подуровень |
Орбиталь m |
Суммарное число орбиталей n2 |
Предельное число электронов на энергетических подуровнях |
Предельное число электронов на энергетических уровнях 2n2 |
|
| 1 | 0 | 1 | 2 | 2 | ||
| 2 |
0 +1, 0, -1 |
8 | ||||
| 3 |
0 +1, 0, -1 +2, +1, 0, -1, -2 |
18 | ||||
| 4 |
|
0 +1, 0, -1 +2, +1, 0, -1, -2 +3,+2,+1,0,-1,-2,-3 |
32 |
Подобно любой системе, атомы стремятся к минимуму энергии. Это достигается при определенном состоянии электронов, т.е. при определенном распределении электронов по орбиталям, которое можно оценить на основе следующих закономерностей:
1. Принцип Паули: в атоме не может быть электронов с одинаковым значением всех четырех квантовых чисел.
2. Правило Хунда: электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарный спин был максимален.
3. Правило Клечковского: порядок заполнения энергетических состояний определяется стремлением атома к минимальному значению суммы главного и побочного квантовых чисел, причем в пределах фиксированного значения в первую очередь заполняются состояния, отвечающие минимальным значениям .
Пример. Рассмотрим применение правила Клечковского для определения распределения электронов по орбиталям для калия и скандия .
1) Предшествующий калию элемент аргон имеет следующее распределение электронов по орбиталям: .
При распределении электронов по орбиталям в атоме в соответствии с правилом Клечковского предпочтение отдается орбитали 4s (сумма квантовых чисел равна 3+2=5), как орбитали, имеющей минимальное значение .
Следовательно, для атома
1) Предшествующий скандию элемент кальций имеет следующее распределение электронов по орбиталям:
Из орбиталей и при распределении электронов в атоме по орбиталям предпочтение следует отдать орбитали , как орбитали, имеющей минимальное значение при одинаковых суммах квантовых чисел , равных 5.
Скандий характеризуется следующим распределением электронов по орбиталям:
В таблице представлены электронные конфигурации атомов первых двадцати элементов периодической системы Д.И. Менделеева.
Данные о строении ядра и о распределении электронов в атомах (см. таблицу), позволяют рассмотреть периодическую систему Менделеева с фундаментальных физических позиций.
Из данных о строении ядра следует, что однозначным признаком химического элемента является заряд ядра Z , определяемый числом протонов в ядре и равный порядковому номеру элемента в периодической таблице элементов Д.И. Менделеева. Относительные атомные массы элементов, приводимые в периодической таблице, представляют собой усредненные значения из относительных атомных масс изотопов, составляющих естественную, природную смесь.
Общее число электронов в электронейтральных атомах равно числу протонов в ядре, т.е. порядковому номеру элемента Z . Число энергетических уровней, на которых располагаются электроны в атоме, определяется номером периода. Чем больше номер периода, тем больше энергетических уровней, на которых располагаются электроны, и тем больше внешние энергетические уровни удалены от ядра.
Число элементов в периоде определяется формулами:
для нечетных периодов
для четных периодов
где – число элементов в периоде, – номер периода.
Приведенные формулы позволяют легко определить, что в первом периоде должно содержаться 2 элемента, во втором и третьем – по 8, в четвертом и пятом – по 18, в шестом -32, в незавершенном седьмом периоде также должно быть 32 элемента. Итак, число элементов в периодах совпадает с максимальным числом электронов на энергетических уровнях 2 – 8 – 18 – 32 (см. таблицу распределения электронов по квантовым уровням).
Число главных подгрупп также определяется максимальным числом электронов на энергетическом уровне – 8. Число переходных элементов в четвертом , пятом и шестом периодах равно 10 и определяется разностью между максимальными числами электронов на энергетических уровнях: 18 – 8 = 10, т.е. равно максимальному числу электронов на .
Поскольку в периодической системе Д.И. Менделеева одна из побочных подгрупп содержит сразу три переходных элемента (для каждого из больших периодов), близких по химическим свойствам:
то число побочных подгрупп, так же как и главных, равно 8.
По аналогии с переходными элементами число лантаноидов и актиноидов, вынесенных внизу периодической системы в виде самостоятельных рядов, должно быть равно разности между максимальными числами электронов на N и M энергетических уровнях: 32 – 18 = 14, т.е. равно максимальному числу электронов на (см. таблицу распределения электронов по квантовым уровням).
Таким образом, строгая периодичность расположения элементов в периодической системе Д.И. Менделеева полностью объясняется последовательным характером заполнения энергетических уровней. Закономерности изменения электронной структуры элементов, впервые предсказанные Н. Бором, еще более укрепили позиции периодического закона. Поводом для этого послужило предсказание свойств 72 – го элемента на основании его электронной структуры. В то время этот элемент не был открыт и химики искали его среди минералов, содержащих редкоземельные элементы, исходя из неправильной предпосылки, что к лантаноидам следует отнести пятнадцать элементов. Однако закономерности изменения электронной структуры элементов свидетельствовали о том, что лантаноидов может быть только четырнадцать, а элемент с является аналогом циркония. Этот элемент – гафний – к торжеству теории Бора и периодического закона был обнаружен в циркониевых рудах.
Следующим важнейшим выводом, который следует из анализа данных, приведенных в таблице электронных конфигураций атомов первых двадцати элементов периодической системы Менделеева, является вывод о периодическом изменении характера заполнения электронами внешних энергетических уровней, что и вызывает периодические изменения химических свойств элементов и их соединений.
Так, второй период состоит из следующих восьми элементов:
При переходе от лития к неону заряд ядра постепенно увеличивается , что вызывает увеличение сил притяжения электронов к ядру. В результате радиусы атомов уменьшаются:
| Элемент | Li | Be | B | C | N | O | F |
|
радиус атома, нм |
0,156 | 0,111 | 0,083 | 0,065 | 0,055 | 0,047 | 0,042 |
Поэтому способность атомов отдавать электроны (типично металлические свойства), ярко выраженная у атомов лития, постепенно ослабевает при переходе от лития к фтору. Последний является уже типичным неметаллом, т.е. элементом, способным присоединять электроны.
Начиная со следующего элемента – натрия – электронные структуры элементов повторяются. Поэтому внешние электронные орбитали могут быть представлены в общем виде:
для лития и натрия - (n – номер периода)
для бериллия и магния -
для бора и алюминия -
для углерода и кремния - и т.д.
В четвертом периоде появляются переходные элементы, которые принадлежат побочным подгруппам.
Элементы, принадлежащие одной и той же подгруппе, имеют идентичный характер расположения электронов на внешних электронных уровнях, а принадлежащие разным подгруппам одной и той же группы – сходный.
Например, галогены (главная подгруппа VII группы) имеют идентичную электронную конфигурацию , а элементы побочной подгруппы -
Сходство указанных элементов заключается в наличии у атомов как главной, так и побочной подгруппы семи валентных электронов, но их расположение по подуровням существенно различается.
Таким образом, наиболее важным выводом, следующим из сопоставления данных, приведенных в таблице электронной конфигурации атомов, с периодической системой Д.И. Менделеева, является вывод о строгой периодичности изменения электронных конфигураций атомов элементов в их естественном ряду, что отвечает периодичности изменения их свойств.
| Следующая > |
www.1variant.ru
Сколько элементов в таблице Менделеева
Периодический закон, являющийся основой современной химии и объясняющий закономерности изменения свойств химических элементов, был открыт Д.И. Менделеевым в 1869 году. Физический смысл этого закона вскрывается при изучении сложного строения атома. В XIX веке считалось, что атомная масса является главной характеристикой элемента, поэтому для классификации веществ использовали именно ее. Сейчас атомы определяют и идентифицируют по величине заряда их ядра (числу протонов и порядковому номеру в таблице Менделеева). Впрочем, атомная масса элементов за некоторыми исключениями (например, атомная масса калия меньше атомной массы аргона) увеличивается соразмерно их заряду ядра.При увеличении атомной массы наблюдается периодическое изменение свойств элементов и их соединений. Это металличность и неметалличность атомов, атомный радиус и объем, потенциал ионизации, сродство к электрону, электроотрицательность, степени окисления, физические свойства соединений (температуры кипения, плавления, плотность), их основность, амфотерность или кислотность.Сколько элементов в современной таблице Менделеева
Таблица Менделеева графически выражает открытый им периодический закон. В современной периодической системе содержится 112 химических элементов (последние – Мейтнерий, Дармштадтий, Рентгений и Коперниций). По последним данным, открыты и следующие 8 элементов (до 120 включительно), но не все из них получили свои названия, и эти элементы пока еще мало в каких печатных изданиях присутствуют.Каждый элемент занимает определенную клетку в периодической системе и имеет свой порядковый номер, соответствующий заряду ядра его атома.Как построена периодическая система
Структура периодической системы представлена семью периодами, десятью рядами и восемью группами. Каждый период начинается щелочным металлом и заканчивается благородным газом. Исключения составляют первый период, начинающийся водородом, и седьмой незавершенный период.Периоды делятся на малые и большие. Малые периоды (первый, второй, третий) состоят из одного горизонтального ряда, большие (четвертый, пятый, шестой) – из двух горизонтальных рядов. Верхние ряды в больших периодах называются четными, нижние – нечетными.В шестом периоде таблицы после лантана (порядковый номер 57) находятся 14 элементов, похожих по свойствам на лантан, – лантаноидов. Они вынесены в нижнюю часть таблицы отдельной строкой. То же самое относится и к актиноидам, расположенным после актиния (с номером 89) и во многом повторяющим его свойства.Четные ряды больших периодов (4, 6, 8, 10) заполнены только металлами.Элементы в группах проявляют одинаковую высшую валентность в оксидах и других соединениях, и эта валентность соответствует номеру группы. Главные подгруппы вмещают в себя элементы малых и больших периодов, побочные – только больших. Сверху вниз металлические свойства усиливаются, неметаллические – ослабевают. Все атомы побочных подгрупп – металлы.completerepair.ru