Химический элемент - это... Периодическая система химических элементов. Сообщение об одном химическом элементе
Интересные факты об открытии химических элементов
Интересные факты об открытии химических элементов Вы узнаете в этой статье.
Интересные факты об открытии химических элементов
Большинство известных в природе химических элементов, было открыто учёными Швеции, Англии, Франции и Германии
Рекордсменом среди «охотников» за химическими элементами можно считать шведского химика К. Шееле — он обнаружил и доказал существование 6-ти химических элементов: фтора, хлора, марганца, молибдена, бария, вольфрама.
К достижениям в находках химических элементов этого учёного можно добавить ещё и седьмой элемент — кислород, но честь открытия которого он официально делит с английским учёным Дж. Пристли.
Второе место в открытии новых элементов принадлежит В.Рамзаю — английскому или, точнее, шотландскому учёному: им открыты аргон, гелий, криптон, неон, ксенон.
В 1985 году группа американских и английских исследователей открыли молекулярные соединения из углерода, которые сильно напоминают своей формой футбольный мяч. В честь него и хотели назвать открытие, однако ученые не договорились, какой термин использовать — football или soccer (срок футбола в США). В итоге соединение назвали фуллеренами в честь архитектора Фуллера, который придумал геодезический купол, составленный из тетраэдров.
Французский химик, аптекарь и врач Никола Лемери (1645-1715) в свое время наблюдал нечто похожее на вулкан, когда, смешав в железной чашке 2 г железных опилок и 2 г порошкообразной серы, прикоснувшись к ней раскаленной стеклянной палочкой. Через некоторое время из приготовленной смеси начали вылетать частицы черного цвета, и сама она, сильно увеличившись в объеме, так разогрелась, что начала светиться. Выделение газообразного фтора с фторсодежмих веществ оказалось одним из самых трудных экспериментальных задач. Фтор имеет исключительную реакционную способность; причем часто его взаимодействие с другими веществами происходит с воспламенением и взрывом.
Йод открыл в 1811 французский химик Б. Куртуа. Существует такая версия открытия йода. В соответствии с ней, виновником открытия Куртуа был любимый кот: он лежал на плече химика, когда тот работал в лаборатории. Желая развлечься, кот прыгнул на стол и столкнул на пол сосуды, которые стояли рядом. В одном из них находился спиртовой раствор золы морских водорослей, а в другом — серная кислота. После смешения жидкостей появилось облако сине-фиолетового пара, было не чем иным как йодом.
В 1898 году Мария и Пьер Кюри объявили об открытии двух новых радиоактивных элементов — радия и полония. Но им не удалось выделить ни один из этих элементов для предоставления решающих доказательств. Супруги начали нелегкий труд: нужно было экстрагировать новые элементы из урановой руды. На это у них ушло 4 года. Тогда еще не было известно губительное влияние радиации на организм, а перерабатывать пришлось тонны радиоактивной руды. В 1902 году им удалось выделить десятую грамма хлорида радия из нескольких тонн руды, а в 1903 году Мария представила в Сорбонне докторскую диссертацию на тему «Исследование радиоактивных веществ». В декабре 1903 года Беккерель и чета Кюри получили Нобелевскую премию.
Открытие брома
Французский химик Антуан Жером Балар совершил открытие брома, будучи лаборантом. Рассол соляного болота содержал бромид натрия. Во время опыта Балар подействовал на рассол хлором. В результате реакции взаимодействия раствор окрасился в желтый цвет. Балар выделил через некоторое время темно-бурую жидкость и назвал ее муридом. Позже Гей-Люссак назвал новое вещество бромом. А Балар в 1844 г.стал членом Парижской Академии Наук. До открытия брома Балар был почти не известен в научных кругах. После открытия брома Балар стал заведовать кафедрой химии во Французском колледже. Как сказал французский химик Шарль Жерар: «Это не Балар открыт бром, а бром открыл Балара!»
Открытие хлора
Интересно, что хлор открыл человек, который в тот момент был всего лишь аптекарем. Этого человека звали Карл Вильгельм Шееле. Он обладал поразительной интуицией. Известный французский химик-органик говорил, что Шееле совершает открытие каждый раз, когда прикасается к чему-то. Опыт Шееле был очень прост. Он смешал в специальном аппарате реторте чёрную магнезию и раствор муриевой кислоты. К горлышку реторты присоединил пузырь без воздуха и подогрел. Вскоре в пузыре появился газ жёлто-зеленого цвета с резким запахом. Так был открыт хлор.MnO2 + 4HCl = Cl2 + MnCl2 + 2h3OЗа открытие хлора Шееле присвоили звание члена Стокгольмской академии наук, хотя до этого он не был учёным. Было Шееле тогда всего 32 года. Но свое название хлор получил только в 1812 г. Автором этого названия был французский химик Гей-Люссак.
kratkoe.com
Что такое химические элементы? Система и характеристика химических элементов
Очень много различных вещей и предметов, живых и неживых тел природы нас окружает. И все они имеют свой состав, строение, свойства. В живых существах протекают сложнейшие биохимические реакции, сопровождающие процессы жизнедеятельности. Неживые тела выполняют различные функции в природе и жизни биомассы и имеют сложный молекулярный и атомарный состав.
Но все вместе объекты планеты имеют общую особенность: они состоят из множества мельчайших структурных частиц, называемых атомами химических элементов. Настолько мелких, что невооруженным взглядом их не рассмотреть. Что такое химические элементы? Какими характеристиками они обладают и откуда стало известно об их существовании? Попробуем разобраться.

Понятие о химических элементах
В общепринятом понимании химические элементы - это лишь графическое отображение атомов. Частиц, из которых складывается все существующее во Вселенной. То есть на вопрос "что такое химические элементы" можно дать такой ответ. Это сложные маленькие структуры, совокупности всех изотопов атомов, объединенные общим названием, имеющие свое графическое обозначение (символ).
На сегодняшний день известно о 118 элементах, которые открыты как в естественных условиях, так и синтетически, путем осуществления ядерных реакций и радиоактивных распадов ядер других атомов. Каждый из них имеет набор характеристик, свое местоположение в общей системе, историю открытия и название, а также выполняет определенную роль в природе и жизни живых существ. Изучением этих особенностей занимается наука химия. Химические элементы - это основа для построения молекул, простых и сложных соединений, а следовательно, химических взаимодействий.
История открытия
Само понимание того, что такое химические элементы, пришло только в XVII веке благодаря работам Бойля. Именно он впервые заговорил об этом понятии и дал ему следующее определение. Это неделимые маленькие простые вещества, из которых складывается все вокруг, в том числе и все сложные.
До этой работы господствовали взгляды алхимиков, признававшим теорию четырех стихий - Эмпидокла и Аристотеля, а также открывших "горючие начала" (сера) и "металлические начала" (ртуть).
Практически весь XVIII век была распространена совершенно ошибочная теория флогистона. Однако уже в конце этого периода Антуан Лоран Лавуазье доказывает, что она несостоятельна. Он повторяет формулировку Бойля, но при этом дополняет ее первой попыткой систематизации всех известных на тот момент элементов, распределив их на четыре группы: металлы, радикалы, земли, неметаллы.
Следующий большой шаг в понимании того, что такое химические элементы, делает Дальтон. Ему принадлежит заслуга открытия атомной массы. На основе этого он распределяет часть известных химических элементов в порядке возрастания их атомной массы.
Стабильно интенсивное развитие науки и техники позволяет делать ряд открытий новых элементов в составе природных тел. Поэтому к 1869 году - времени великого творения Д. И. Менделеева - науке стало известно о существовании 63 элементов. Работа русского ученого стала первой полной и навсегда закрепившейся классификацией этих частиц.
Строение химических элементов на тот момент установлено не было. Считалось, что атом неделим, что это мельчайшая единица. С открытием явления радиоактивности было доказано, что он делится на структурные части. Практически каждый при этом существует в форме нескольких природных изотопов (аналогичных частиц, но с иным количеством структур нейтронов, от чего меняется атомная масса). Таким образом, к середине прошлого столетия удалось добиться порядка в определении понятия химического элемента.
Система химических элементов Менделеева
В основу ученый положил различие в атомной массе и сумел гениальным образом расположить все известные химические элементы в порядке ее возрастания. Однако вся глубина и гениальность его научного мышления и предвидения заключалась в том, что Менделеев оставил пустые места в своей системе, открытые ячейки для еще неизвестных элементов, которые, по мнению ученого, в будущем будут открыты.
И все получилось именно так, как он сказал. Химические элементы Менделеева с течением времени заполнили все пустые ячейки. Была открыта каждая предсказанная ученым структура. И теперь мы можем смело говорить о том, что система химических элементов представлена 118 единицами. Правда, три последних открытия пока еще официально не подтверждены.
Сама по себе система химических элементов отображается графически таблицей, в которой элементы располагаются согласно иерархичности их свойств, зарядам ядер и особенностям строения электронных оболочек их атомов. Так, имеются периоды (7 штук) - горизонтальные ряды, группы (8 штук) - вертикальные, подгруппы (главная и побочная в пределах каждой группы). Чаще всего отдельно в нижние слои таблицы выносятся два ряда семейств - лантаноиды и актиноиды.

Периодическая система Менделеева содержит всю необходимую информацию о химических элементах (порядковый номер, массовое число, название, иногда последние слои электронного строения).
Названия элементов
Право дать название предоставляется тому человеку, который совершил открытие данного химического элемента. Многие названы в честь планет (уран, плутоний, нептуний). Другим дали наименование в честь великих ученых (менделевий, резерфордий, коперниций и другие).
Часто элементы называют в честь городов и стран (рутений, германий, дубний, франций, европий и прочие). Посылом даже служат мифические герои (прометий). Также распространено явление, когда то или иное наименование дается по свойствам, проявляемым простыми и сложными веществами данного элемента (водород, кислород, углерод).

Названия записываются на латыни, но в нашей стране существует и русский их перевод с закрепившимися произношениями. Символом каждого элемента считается первая буква латинского слова либо первая и какая-либо из последующих. Пример: кальций (Са) - Calcium, бор (В) - Boron.
Характеристика атомов химических элементов
Каждый представитель периодической системы имеет свои особенности как в строении, так и в проявляемых свойствах. Характеристика химического элемента складывается из разбора состава его ядра и электронных слоев, а также из определения простого вещества, им образуемого, и сложных соединений.
Состав ядра атомов химических элементов включает несколько частиц - нуклонов:
- протоны, определяющие его положительный заряд (р+1), а также часть атомной массы;
- нейтроны, влияющие на массовое число элемента и не имеющие заряда (n0).
Еще один вид частиц - электроны. Они движутся вокруг ядра и имеют отрицательный заряд (е-1). Ориентация их не хаотичная, а строго упорядоченная. Они располагаются на орбиталях (s, p, d и f), которые формируют подуровни и уровни (электронные слои).
Атомная масса элемента складывается из протонов и нейтронов, совокупность которым имеет название "массовое число". Количество протонов определяется очень просто - оно равно порядковому номеру элемента в системе. А так как атом в целом - система электронейтральная, то есть не имеющая вообще никакого заряда, то количество отрицательных электронов всегда равно количеству положительных частиц протонов.
Таким образом, характеристика химического элемента может быть дана по его положению в периодической системе. Ведь в ячейке описано практически все: порядковый номер, а значит, электроны и протоны, атомная масса (усредненное значение всех существующих изотопов данного элемента). Видно, в каком периоде находится структура (значит, на стольких слоях будут располагаться электроны). Также можно предсказать количество отрицательных частиц на последнем энергетическом уровне для элементов главных подгрупп - оно равно номеру группы, в которой располагается элемент.

Количество нейтронов можно рассчитать, если вычесть из массового числа протоны, то есть порядковый номер. Таким образом, можно получить и составить целую электронно-графическую формулу для каждого химического элемента, которая будет в точности отражать его строение и показывать возможные степени окисления и проявляемые свойства.
Распространение элементов в природе
Изучением этого вопроса занимается целая наука - космохимия. Данные показывают, что распределение элементов по нашей планете повторяет такие же закономерности во Вселенной. Главным источником ядер легких, тяжелых и средних атомов являются ядерные реакции, происходящие в недрах звезд - нуклеосинтез. Благодаря этим процессам Вселенная и космическое пространство снабдили нашу планету всеми имеющимися химическими элементами.
Всего из известных 118 представителей в естественных природных источниках людьми были обнаружены 89. Это основополагающие, самые распространенные атомы. Химические элементы также были синтезированы искусственно, путем бомбардировки ядер нейтронами (нуклеосинтез в лабораторных условиях).

Самыми многочисленными считаются простые вещества таких элементов, как азот, кислород, водород. Углерод входит в состав всех органических веществ, а значит, также занимает лидирующие позиции.
Классификация по электронному строению атомов
Одна из самых распространенных классификаций всех химических элементов системы - это распределение их на основе электронного строения. По тому, сколько энергетических уровней входит в состав оболочки атома и который из них содержит последние валентные электроны, можно выделить четыре группы элементов.
S-элементы
Это такие, у которых последней заполняется s-орбиталь. К этому семейству относятся элементы первой группы главной подгруппы (или щелочные металлы). Всего один электрон на внешнем уровне определяет схожие свойства этих представителей как сильных восстановителей.
Р-элементы
Всего 30 штук. Валентные электроны располагаются на р-подуровне. Это элементы, формирующие главные подгруппы с третьей по восьмую группу, относящиеся к 3,4,5,6 периодам. Среди них по свойствам встречаются как металлы, так и типичные неметаллические элементы.
d-элементы и f-элементы
Это переходные металлы с 4 по 7 большой период. Всего 32 элемента. Простые вещества могут проявлять как кислотные, так и основные свойства (окислительные и восстановительные). Также амфотерные, то есть двойственные.
К f-семейству относятся лантаноиды и актиноиды, у которых последние электроны располагаются на f-орбиталях.
Вещества, образуемые элементами: простые
Также все классы химических элементов способны существовать в виде простых или сложных соединений. Так, простыми принято считать такие, которые образованы из одной и той же структуры в разном количестве. Например, О2 - кислород или дикислород, а О3 - озон. Такое явление носит название аллотропии.

Простые химические элементы, формирующие одноименные соединения, характерны для каждого представителя периодической системы. Но не все они одинаковы по проявляемым свойствам. Так, существуют простые вещества металлы и неметаллы. Первые образуют главные подгруппы с 1-3 группу и все побочные подгруппы в таблице. Неметаллы же формируют главные подгруппы 4-7 групп. В восьмую основную входят особые элементы - благородные или инертные газы.
Среди всех открытых на сегодня простых элементов известны при обычных условиях 11 газов, 2 жидких вещества (бром и ртуть), все остальные - твердые.
Сложные соединения
К таковым принято относить все, которые состоят из двух и более химических элементов. Примеров масса, ведь химических соединений известно более 2 миллионов! Это соли, оксиды, основания и кислоты, сложные комплексные соединения, все органические вещества.
fb.ru
Интересные химические элементы
Химический элемент Кадмий, убийца Годзиллы
Впервые обнаруженный в 1817 году и использовавшийся в качестве примеси цинка, кадмий был ничем не примечателен, до начала 1900-х, когда началась добыча цинка в шахте Камиока в центральной Японии. Во время процесса очистки цинка, кадмий сбрасывался в реку Jinzu. К 1930 году, отходы затронули кости местных жителей и сделали их невероятно хрупкими; один врач сломал запястье девушки, пытаясь прощупать ее пульс. Только в 1961 году, было определено, что причиной этой болезни является кадмий. Исследования показали, что местные культуры были переполнены кадмием, который попадал на рисовые поля из речной воды.
Атомная структура кадмия позволяет ему связать металлотионеин, белок в клетках организма, который, связывает, более биологически важные металлы. Когда местные жители ели рис, кадмий сворачивал цинк, кальций и другие минеральные вещества, необходимые для укрепления костей. В 1972 году добывающая компания выплатила компенсацию 178 выжившим жителям, которые жили или работали вдоль реки. Двенадцать лет спустя, когда кинематографистам нужно было убить Годзиллу в последнем сиквеле, они использовали ракеты с кадмиевым наконечником.
Химический элемент Галлий, исчезающая ложка
Элемент для розыгрышей лабораторных шутников, галлий был обнаружен в 1875 году, его открыл французский химик Пол Эмиль Франсуа Лекок де Буабодран. Несмотря на твердое состояние при комнатной температуре, металл плавится уже при 84 ° F. Это означает, что вы гипотетически можете вылепить ложку из галлия, передать ее другу, чтобы помешать его утренний кофе, и увидеть его реакцию, когда ложка исчезнет в горячем напитке. (Несмотря на низкую токсичность галлия, твоему приятелю не следует пить этот кофе). Помимо его использования в розыгрышах, способность галлия выдерживать широкий диапазон температур в жидком виде делает его удобным для замены ртути для высокотемпературных термометров.
Химический элемент Фосфор, элемент дьявола
Один из ключевых компонентов в современных взрывчатых веществах фосфор впервые был обнаружен в малоприятном месте: в моче. В 1669 году немецкий алхимик Хенниг Бранд пытался создать «философский камень», легендарный артефакт, который мог бы превращать металл в золото. Алхимики уделяли большое значение цвету веществ, и, так как моча была (более или менее) похожа цветом на золото, Бранд, вероятно предположил, что он мог бы использовать ее, чтобы получить золото.
Бранд понятия не имел, что он сделал первое открытие элемента с древнейших времен
После кипячения и разложения большое количество жидких отходов, предположительно, взятых из местных пивных, алхимик получил черную пасту. Он смешал результат с песком, затем нагревал и дистиллировал его, получив при этом белое воскообразное вещество, которое слабо светилось в темноте, иногда даже выбрасывало пламя при контакте с воздухом! (Отсюда и прозвище: «Элемент Дьявола»). Бранд понятия не имел, что он сделал первое открытие элемента с древнейших времен; он только знал, что его неаппетитный проект не дал золото, которое он искал.
Химический элемент Кислород, секрет жизни
Будучи еще мальчиком, Джозеф Пристли заметил, что пауки запечатанные в банках , в конечном счете умирают . Он знал, что его пленники исчерпали воздух, но что осталось в банке с мертвым пауком? Годы спустя, во время работы проповедником, Пристли все еще занимает этот вопрос. Тогда его осенила идея: а что если там были различные типы воздуха? Любопытство Пристли только усилилось, когда он понял, что, в отличие от животных, растения могут выжить в герметичных банках.
Чтобы проверить свою теорию, он поместил мышей в банку с веточками мяты. Когда его подопытные продержались дольше в банке с зеленью, он пришел к выводу, что растения производят что-то жизненно важное. Пристли позднее назвал свое открытие «дефлогистированным воздухом» неуклюжим термином, который, французский химик Антуан Лавуазье заменил на слово «кислород», после проведения серии подобных экспериментов.
В начале 1770-х годов, Пристли поделился своими наблюдениями со своим другом Бенджамином Франклином, который позже написал, «Я надеюсь, что это даст повод пересмотреть яростное уничтожение деревьев, которое происходит из-за мнения, что деревья могут быть заражены. Я уверен, после длительного наблюдения, что нет ничего нездорового в воздухе лесов».
Химический элемент Сиборгий
После оказания помощи в открытии 10 элементов в Беркли, в том числе плутония, америция и кюрия, химик Гленн Сиборг был бы не против присвоить свое имя одному из них. Но в 1974 году, команда из России в городе Дубне объявила, что обнаружила элемент 106, за несколько месяцев до команды из Беркли. Развернулась холодная война за то, кто именно, впервые обнаружил этот новый элемент и какое он должен носить название, американцы записали его как Сиборгий.
Международный союз теоретической и прикладной химии вмешался, и отменил это имя в начале 90-х. Опираясь на мощные химические журналы, американцы настаивали на сохранении имени, и оно было официально восстановлено в 1997 году. Команда города Дубна тоже получила свой приз: элемент 105, дубний. Чтобы отпраздновать свою победу, Сиборг был сфотографирован рядом с большой периодической таблицей, и своим элементом в ней, единственным, когда-либо публично названым, в честь живого человека.
Также в категории:
post-post.ru
Химический элемент - это... Что такое Химический элемент?
Химический элемент — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева[1]. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе элементов Дмитрия Ивановича Менделеева.[2]
Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные)[3]
История становления понятия
Слово «элемент» (лат. elementum) использовалось еще в античности (Цицероном, Овидием, Горацием) как часть чего-то (элемент речи, элемент образования и т. п.). В древности было распространено изречение «Как слова состоят из букв, так и тела — из элементов». Отсюда — вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» — «em» — «en» — «tum»).[4]
Близкое к современному пониманию понятие химического элемента отражала новая система химической философии, изложенная Робертом Бойлем в книге «Химик-скептик» (1661). Бойль указал, что ни четыре стихии Аристотеля, ни три принципа алхимиков не могут быть признаны в качестве элементов. Элементы, согласно Бойлю — практически неразложимые тела (вещества), состоящие из сходных однородных (состоящих из первоматерии) корпускул, из которых составлены все сложные тела и на которые они могут быть разложены. Корпускулы могут различаться формой, размером, массой. Корпускулы, из которых образованы тела, остаются неизменными при превращениях последних[5].
В 1789 г. Антуан Лоран Лавуазье в «Элементарном курсе химии», приводит первый в истории новой химии список химических элементов (таблицу простых тел), разделённых на несколько типов. Он впервые отождествляет с химическими элементами ряд простых веществ (в их числе, кислород, азот, водород, сера, фосфор, уголь и все известые к тому времени металлы). В число элементов были включены свет, теплород и «солеобразующие землистые вещества» (трудноразлагаемые оксиды кальция, магния и др.). Данную концепцию элементов принято называть эмпирико-аналитической, поскольку Лавуазье избрал критерием определения элемента опыт и только опыт, категорически отвергая любые неэмпирические рассуждения об атомах и молекулах, само существование которых невозможно подтвердить экспериментально[6].
Благодаря Джону Дальтону в начале XIX в. в химии возобладала атомно-молекулярная гипотеза, рассматривающая химический элемент как отдельный вид атомов и указывающая на природу простых и сложных веществ, как состоящих, соответственно, из атомов одного или различного видов. Дальтон же впервые указывает на атомный вес как важнейшее свойство элементов, определяющее его химическую природу. Благодаря усилиям Йенса Берцелиуса и его последователей были весьма точно определены атомные веса (атомные массы) известных элементов. Середина XIX в. ознаменовалась целым рядом открытий новых элементов. На международном съезде химиков в г. Карлсруэ в 1860 г. были приняты определения понятий молекулы и атома.
Ko времени открытия Периодического закона Д. И. Менделеевым (1869) было известно 63 элемента. Именно атомный вес был выделен им как свойство атомов, определяющее периодический характер изменения свойств химических элементов, а также образуемых ими простых и сложных веществ. Менделеев определял химические элементы как «материальные части простых или сложных тел, к-рые придают им известную совокупность физических и химических свойств». Oткрытие Mенделеева позволило предвидеть существование, a также свойства ряда неизвестных в то время элементов и послужило научной основой для их классификации.
Однако с открытием изотопов стало ясно, что различные совокупности атомов одного и того же элемента могут иметь различающиеся атомные массы; так, радиогенный гелий, выделенный из урановых минералов, в связи с преобладанием изотопа 4He имеет атомную массу больше, чем гелий космических лучей.
Современное понимание химического элемента как совокупности атомов, характеризующихся одинаковым положительным зарядом ядра, равным номеру элемента в Периодической таблице, появилось благодаря фундаментальным работам Генри Мозли (1915) и Джеймса Чедвика (1920)[7].
Известные химические элементы
На середину 2012 года известно 118 химических элементов (с порядковыми номерами с 1 по 118), из них 94 обнаружены в природе (некоторые — лишь в следовых количествах), остальные 24 получены искусственно в результате ядерных реакций. Предпринимались попытки синтеза следующих сверхтяжёлых трансурановых элементов, в т.ч. были заявления о синтезе элемента унбиквадий (124) и косвенных свидетельствах о элементах унбинилий (120) и унбигексий (126), которые пока не подтверждены. Также было объявлено об обнаружении элемента экатория-унбибия (122) в образцах природного тория[8], однако это заявление в настоящее время оспаривается на основании последних попыток воспроизведения данных с использованием более точных методов. Кроме того, есть сообщения об открытии в метеоритном веществе следов столкновений с частицами с атомными числами от 105 до 130, что может являться косвенным доказательством существования стабильных сверхтяжёлых ядер[9]. Поиски сверхтяжёлых трансурановых элементов в природе, возможных согласно теории острова стабильности, пока не увенчались достоверным успехом, а синтезирование новых трансурановых элементов продолжается в российском, американских, немецком и японском центрах ядерных исследований силами международных коллективов учёных. Информация об ещё не открытых химических элементах доступна в статье Расширенная периодическая таблица элементов.
Право предложить название новому химическому элементу предоставляется первооткрывателям. Сообщение о новом открытии проверяется в течение нескольких лет независимыми лабораториями, и, в случае подтверждения, Международный союз теоретической и прикладной химии (ИЮПАК, IUPAC, en:International Union for Pure and Applied Chemistry) официально утверждает название нового элемента.
Не все из известных на сегодня 118 элементов имеют утвержденные ИЮПАК постоянные названия. Самым тяжёлым из официально признанных элементов, имеющих официальные постоянные названия, является 116-й, получивший в мае 2012 года имя ливерморий вместе со 114-м элементом флеровием.
Названия сверхтяжёлых элементов с номерами 113, 115, 117, 118, полученные в 2002—2010 годах в России и США, официально пока не утверждены. Они имеют временные систематические названия.
Символы химических элементов
Символы химических элементов используются как сокращения для названия элементов. В качестве символа обычно берут начальную букву названия элемента и в случае необходимости добавляют следующую или одну из следующих. Обычно это начальные буквы латинских названий элементов: Cu — медь (cuprum), Ag — серебро (argentum), Fe — железо (ferrum), Au — золото (aurum), Hg — ртуть (hydrargirum). Такая система химических символов была предложена в 1811 г. шведским химиком Я. Берцелиусом.
Цифрами меньшего размера возле символа элемента обозначаются: слева вверху — атомная масса, слева внизу — порядковый номер, справа вверху — заряд иона, справа внизу — число атомов в молекуле[7]:
| атомная масса | заряд иона | |
| Символ элемента | ||
| порядковый номер | число атомов в молекуле |
Примеры:
Временные символы элементов состоят из трёх букв, представляющих аббревиатуру их атомного номера на латыни.
В Периодической таблице карточка химического элемента обычно включает следующие характеристики:
Распространённость химических элементов в природе
 Распространённость химических элементов в земной коре (% масс.) – кларковые числа
Распространённость химических элементов в земной коре (% масс.) – кларковые числа Из всех химических элементов в природе найдено 88; такие элементы, как технеций Tc (порядковый номер 43), прометий Pm (61), астат At (85) и франций Fr (87), а также все элементы, следующие за ураном U (порядковый номер 92), впервые получены искусственно. Некоторые из них в исчезающе малых количествах обнаружены в природе.
Из химических элементов наиболее распространены в земной коре кислород и кремний. Эти элементы вместе с элементами алюминий, железо, кальций, натрий, калий, магний, водород и титан составляют более 99 % массы земной оболочки, так что на остальные элементы приходится менее 1 %. В морской воде, помимо кислорода и водорода — составных частей самой воды, высокое содержание имеют такие элементы, как хлор, натрий, магний, сера, калий, бром и углерод. Массовое содержание элемента в земной коре называется кларковым числом или кларком элемента.
Содержание элементов в коре Земли отличается от содержания элементов в Земле, взятой как целое, поскольку химсоставы коры, мантии и ядра Земли различны. Так, ядро состоит в основном из железа и никеля. В свою очередь, содержания элементов в Солнечной системе и в целом во Вселенной также отличаются от земных. Наиболее распространённым элементом во Вселенной является водород, за ним идёт гелий. Исследование относительных распространённостей химических элементов и их изотопов в космосе является важным источником информации о процессах нуклеосинтеза и об эволюции Солнечной системы и небесных тел.
Классификация химических элементов
Химические элементы как составная часть химических веществ
Химические вещества могут состоять как из одного химического элемента (простое вещество), так и из разных (сложное вещество или химическое соединение).
Химические элементы образуют около 500 простых веществ[10]. Способность одного элемента существовать в виде различных простых веществ, отличающихся по свойствам, называется аллотропией.[10]
В обычных условиях 11 элементов существуют в виде газообразных простых веществ (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), 2 — жидкости (Br и Hg), остальные элементы образуют твёрдые тела.
См. также
Ссылки
Примечания
dic.academic.ru
Химические элементы их год открытия и ученые их открывшие (Таблица)
В справочной таблице, кроме порядкового номера элементов, их символа, названия и атомного веса, даны еще краткие исторические справки: кто и когда открыл тот или другой элемент. Указанные в таблице даты отвечают преимущественно тем годам, когда элементы были получены в чистом виде, т. е. в металлическом или свободном состоянии, а не в виде химических соединений; приводится также имя ученого, который впервые этого достиг. Дополнительные указания по этим вопросам для некоторых элементов даны в примечаниях к таблице. Введенное в таблице сокращение «Изв. с др.» означает «известны с древнего времени», остальные сокращения понятны.
| Атомный номер Z | Символ | Название | Атомный вес A | Кто открыл | Год открытия элемента |
| 1 | H | Водород | 1,0080 | Кавендиш | 1766 |
| 2 | He | Гелии 1) | 4,003 | Рамзай и Клив | 1895 |
| 3 | Li | Литий | 6,94 0 | Арфведсон | 1817 |
| 4 | Be | Бериллий | 9,013 | Велер и Бюсси | 1828 |
| 5 | В | Бор | 10,82 | Гей-Люссак и Тенар | 1808 |
| 6 | C | Углерод | 12,011 | Изв. с др. | - |
| 7 | N | Азот | 14,008 | Д. Резерфорд | 1772 |
| 8 | O | Кислород | 16,0000 | Пристли и Шееле | 1774 |
| 9 | F | Фтор 2) | 19,00 | Муассан | 1886 |
| 10 | Ne | Неон | 20,183 | Рамзай и Траверс | 1898 |
| 11 | Na | Натрий | 22,991 | Деви | 1807 |
| 12 | Mg | Магний 3) | 24,32 | Либих и Бюсси | 1831 |
| 13 | Al | Алюминий | 26,98 | Вёлер | 1827 |
| 14 | Si | Кремний | 28,09 | Берцелиус | 1823 |
| 15 | P | Фосфор | 30,975 | Бранд | 1669 |
| 16 | S | Сера | 32,066 | Изв. с др. | - |
| 17 | Cl | Хлор | 35,457 | Шееле | 1774 |
| 18 | Ar | Аргон | 39,944 | Рэлей и Рамзай | 1894 |
| 19 | К | Калий | 39,100 | Деви | 1807 |
| 20 | Ca | Кальций | 40,08 | Деви (Берцелиус) | 1808 |
| 21 | Sc | Скандий | 44,96 | Нильсон | 1879 |
| 22 | Ti | Титан 4) | 47,90 | Грегор | 1791 |
| 23 | V | Ванадий | 50,95 | Зефштрем | 1830 |
| 24 | Cr | Хром | 52,01 | Воклен | 1797 |
| 25 | Mn | Марганец | 54,94 | Ган | 1774 |
| 26 | Fe | Железо | 55,85 | Изв. с др. | - |
| 27 | Co | Кобальт | 58,94 | Брандт | 1735 |
| 28 | Ni | Никель | 58,69 | Кронстедт | 1751 |
| 29 | Cu | Медь | 63,54 | Изв. с др. | - |
| 30 | Zn | Цинк | 65,38 | Маркграф | 1746 |
| 31 | Ga | Галлий | 69,72 | Лекок де Буабодрант | 1875 |
| 32 | Ge | Германий | 72,60 | Винклер | 1886 |
| 33 | As | Мышьяк 5) | 74,91 | Альберт Великий | XIII в. |
| 34 | Se | Селен | 78,96 | Берцелиус | 1817 |
| 35 | Br | Бром | 79,916 | Балард | 1826 |
| 36 | Kr | Криптон | 83,80 | Рамзай и Траверс | 1898 |
| 37 | Rb | Рубидий | 85,48 | Бунзен и Кирхгоф | 1861 |
| 33 | Sr | Стронций | 87,63 | Деви | 1808 |
| 39 | Y | Иттрий | 88,92 | Вёлер | 1828 |
| 40 | Zr | Цирконий | 91.22 | Берцелиус | 1824 |
| 41 | Nb | Ниобий 6) | 92,91 | Розе | 1844 |
| 42 | Mo | Молибден | 95,95 | Гьельм | 1782 |
| 43 | Tc | Технеций | 99 | Перрье и Сегре | 1937 |
| 44 | Ru | Рутений | 101,1 | Клаус | 1844 |
| 45 | Rh | Родий | 102,91 | Волластон | 1803 |
| 46 | Pd | Палладий | 106,7 | Волластон | 1803 |
| 47 | Ag | Серебро | 107,880 | Изв. с др. | - |
| 48 | Cd | Кадмий | 112,41 | Герман и Штромберг | 1817 |
| 49 | In | Индий | 114,76 | Рейх и Рихтер | 1863 |
| 60 | Sn | Олово | 118,70 | Изв. с др. | - |
| 51 | Sb | Сурьма |
| В. Валентин | XV в. |
| 52 | Те | Теллур | 127,61 | Рихенштейн | 1782 |
| 53 | J | Иод |
| Куртуа | 1811 |
| 54 | Xe | Ксенон | 131,3 | Рамзай и Траверс | 1898 |
| 55 | Cs | Цезий |
| Бунзен и Кирхгофф | 1860 |
| 56 | Ba | Барий |
| Деви | 1808 |
| 57 | La | Лантан | 138,92 | Мозандер | 1839 |
| 58 | Ce | Церий 7) | 140,13 | Гяльдербранд и Нортон | 1875 |
| 59 | Pr | Празеодим | 140,92 | Вейсбах | 1885 |
| 60 | Nd | Неодим 8) | 144,27 | Вейсбах | 1885 |
| 61 | Pm | Прометий | 145 | Марянский и Гленденев | 1947 |
| 62 | Sm | Самарий | 150,43 | Лекок де Буабодран | 1879 |
| 63 | Eu | Европий | 152,0 | Демарсей | 1896 |
| 64 | Gd | Гадолиний | 156,9 | Мариньяк и Лекок де Буабодран | 1880 |
| 65 | Tb | Тербий | 158,93 | Мозандер | 1843 |
| 66 | Dy | Диспрозий | 162,46 | Лекок де Буабодран | 1886 |
| 67 | Ho | Гольмий | 164,94 | Клеве | 1880 |
| 68 | Er | Эрбий | 167,2 | Мозандер | 1843 |
| 69 | Tu | Туллий | 168,94 | Клеве | 1879 |
| 70 | Yb | Иттербий | 173,04 | Мариньяк | 1878 |
| 71 | Lu | Лютеций | 174,99 | У роен | 1908 |
| 72 | Hf | Гафний | 178,6 | Костер и Хевеши | 1923 |
| 73 | Та | Тантал | 180,95 | Экеберг | 1802 |
| 74 | W | Вольфрам | 183,92 | Бр. д’Эльюар | 1783 |
| 75 | Re | Рений | 186,31 | Ноддак и Таске | 1925 |
| 76 | Os | Осмий | 190,2 | Теннант | 1803 |
| 77 | Ir | Иридий | 192,2 | Теннант | 1804 |
| 78 | Pt | Платина 9) | 195,23 | Упом. в XVI в. | 1861 |
| 79 | Au | Золото | 197,0 | Изв. с др. | |
| 80 | Hg | Ртуть | 200,61 | Упом. за III в. до н. в. | |
| 81 | Tl | Таллий | 204,39 | Крукс | |
| 82 | Pb | Ивинец | 207,21 | Упом. Плинием | |
| 83 | Bi | Висмут | 209,00 | Упом. В. Валентин в XV в. | |
| 84 | Ро | Полоний | 210 | Кюри М. | 1898 |
| 85 | At | Астатин | 210 | Корзон и Мэккензи | 1940 |
| 86 | Rn | Радон | 222 | Дорн | 1900 |
| 87 | Fr | Франций | 223 | М. Перей | 1939 |
| 88 | Ra | Радий | 226,05 | Кюри М. | 1898 |
| 89 | Ac | Актиний | 227 | Дебьерн | 1902 |
| 90 | Th | Торий | 232,05 | Берцелиус | 1828 |
| 91 | Pa | Протактиний | 231 | Мейтнер и Ган | 1918 |
| 92 | U | Уран 10) | 238,07 | Клапрот | 1789 |
| 93 | Np | Нептуний | 237 | Мэкмиллан и Абельсон | 1940 |
| 04 | Pu | Плутоний | 242 | Сиборг и Мэкмиллан | 1940 |
| 95 | Am | Америций | 243 | Сиборг и Джемс | 1945 |
| 96 | Cm | Кюрий | 245 | Сиборг и Джемс | 1944 |
| 97 | Bk | Беркелий | 245 | Сиборг и Томпсон | I960 |
| 98 | Cf | Калифорний | 248 | Сиборг и Томпсон | 1950 |
| 99 | En | Эйнштейний | 253 |
| 1953 |
| 100 | Fm | Фермий | 255 |
| 1953 |
| 101 | Mv | Менделевий | 256 |
| 1953 |
Примечания к таблице:
1) Жансен и независимо от него Локьер в 1868 г. обнаружили в спектре солнца неизвестные до того времени линии; этот новый элемент был назван гелием, так как предполагалось, что он находится только на солнце. Через 27 лет Рамзаи и Клив обнаружили те же линии в спектре нового газа, полученного ими при анализе минерала клевеита; название гелий для этого элемента было сохранено.
2) Еще в конце XVIII в. было известно, что при действии серной кислоты на плавиковый шпат выделяется особая кислота, которая разъедает стекло. В 1810 г. Ампер показал, что эта кислота подобна соляной и является соединением с водородом некоторого неизвестного элемента, который он назвал фтором. В чистом виде фтор удалось получить Муассану только в 1886 г.
3) Окись магния была известна давно, ее исследовал Блэк еще в 1775 г. Деви в 1808 г. пытался получить металлический магний, но в чистом виде металл получить ему не удалось.
4) Двуокись титана была получена лабораторным путем еще в конце XVIII в., Берцелиус получал титан, но не вполне чистый. Более чистый металлический титан был получен Грегор, затем Муассаном.
5) Сернистые соединения мышьяка былп известны в древнее время.
6) В начале XIX в. была получена смесь ниобия и тантала, которая рассматривалась как новый элемент; ему было присвоено название колумбий. В Америке и Англии ниобий до сих пор носит название колумбий.
7) В виде окиси церий был получен в 1803 г.
8) Долгое время смесь празеодима и неодима считалась отдельным элементом, который назывался дидием (Di).
9) Как особый металл платина была описана в 1750 г.; до 1810 г. единственным местом добычи платины была Колумбия. Затем платина была найдена в других местах, в том числе на Урале, который до настоящего времени является наиболее богатым источником ее получения.
10) Двуокись урана, полученная впервые еще в 1789 г., была принята вначале за новый элемент. Металлический уран был получен впервые в 1842 г., его радиоактивные свойства были открыты только в 1896 г.
_______________
Источник информации: КРАТКИЙ ФИЗИКО-ТЕХНИЧЕСКИЙ СПРАВОЧНИК/ Том 1, - М.: 1960.
infotables.ru
Химический элемент - это... Периодическая система химических элементов :: SYL.ru
Химический элемент - это собирательный термин, описывающий совокупность атомов простого вещества, т. е. такого, которое не может быть разделено на какие-либо более простые (по структуре их молекул) составляющие. Представьте себе, что вы получаете кусок чистого железа с просьбой разделить его на гипотетические составляющие с помощью любого устройства или метода, когда-либо изобретенного химиками. Однако вы ничего не сможете сделать, никогда железо не разделится на что-нибудь попроще. Простому веществу - железу - соответствует химический элемент Fe.
Теоретическое определение
Отмеченный выше экспериментальный факт может быть объяснен с помощью такого определения: химический элемент - это абстрактная совокупность атомов (не молекул!) соответствующего простого вещества, т. е. атомов одного и того же вида. Если бы существовал способ смотреть на каждый из отдельных атомов в куске чистого железа, упомянутого выше, то все они были бы однаковыми – атомами железа. В противоположность этому, химическое соединение, например, оксид железа, всегда содержит по меньшей мере два различных вида атомов: атомы железа и атомы кислорода.
Термины, которые следует знать
Атомная масса: масса протонов, нейтронов и электронов, которые составляют атом химического элемента.
Атомный номер: число протонов в ядре атома элемента.
Химический символ: буква или пара латинских букв, представляющих обозначение данного элемента.
Соединение химическое: вещество, которое состоит из двух или более химических элементов, соединенных друг с другом в определенной пропорции.
Металл: элемент, который теряет электроны в химических реакциях с другими элементами.
Металлоид: элемент, который реагирует иногда как металл, а иногда и как неметалл.
Неметалл: элемент, который стремится получить электроны в химических реакциях с другими элементами.
Периодическая система химических элементов: система классификации химических элементов в соответствии с их атомными номерами.
Синтетический элемент: тот, который получен искусственно в лаборатории, и, как правило, не встречается в природе.
Природные и синтетические элементы
Девяносто два химических элемента встречаются в природе на Земле. Остальные были получены искусственно в лабораториях. Синтетический химический элемент – это, как правило, продукт ядерных реакций в ускорителях частиц (устройствах, используемых для увеличения скорости субатомных частиц, таких как электроны и протоны) или ядерных реакторах (устройствах, используемых для управления энергией, выделяющейся при ядерных реакциях). Первым полученным синтетическим элементом с атомным номером 43 стал технеций, обнаруженный в 1937 году итальянскими физиками К. Перрье и Э. Сегре. Кроме технеция и прометия, все синтетические элементы имеют ядра большие, чем у урана. Последний получивший свое название синтетический химический элемент - это ливерморий (116), а перед ним был флеровий (114).
Два десятка распространенных и важных элементов
| Название | Символ | Процент всех атомов * | Свойства химических элементов (при обычных комнатных условиях) | |||
| Во вселенной | В земной коре | В морской воде | В человеческом организме | |||
| Алюминий | Al | - | 6,3 | - | - | Легкий, серебристый металл |
| Кальций | Ca | - | 2,1 | - | 0,02 | Входит в состав природных минералов, ракушек, костей |
| Углерод | С | - | - | - | 10,7 | Базис всех живых организмов |
| Хлор | Cl | - | - | 0,3 | - | Ядовитый газ |
| Медь | Cu | - | - | - | - | Только красный металл |
| Золото | Au | - | - | - | - | Только желтый металл |
| Гелий | He | 7,1 | - | - | - | Очень легкий газ |
| Водород | Н | 92,8 | 2,9 | 66,2 | 60,6 | Самый легкий из всех элементов; газ |
| Йод | I | - | - | - | - | Неметалл; используется в качестве антисептического средства |
| Железо | Fe | - | 2,1 | - | - | Магнитный металл; используется для производства чугуна и стали |
| Свинец | Pb | - | - | - | - | Мягкий, тяжелый металл |
| Магний | Mg | - | 2,0 | - | - | Очень легкий металл |
| Ртуть | Hg | - | - | - | - | Жидкий металл; один из двух жидких элементов |
| Никель | Ni | - | - | - | - | Устойчивый против коррозии металл; используют в монетах |
| Азот | N | - | - | - | 2,4 | Газ, основной компонент воздуха |
| Кислород | О | - | 60,1 | 33,1 | 25,7 | Газ, второй важный компонент воздуха |
| Фосфор | Р | - | - | - | 0,1 | Неметалл; важен для растений |
| Калий | К | - | 1.1 | - | - | Металл; важен для растений; обычно называют "поташ" |
* Если величина не указана, то элемент составляет менее 0,1 процента.
Большой взрыв как первопричина образования материи
Какой химический элемент был самым первым во Вселенной? Ученые считают, что ответ на этот вопрос лежит в звездах и в процессах, с помощью которых формируются звезды. Вселенная, как полагают, возникла в какой-то момент времени от 12 до 15 миллиардов лет назад. До этого момента ничего сущего, кроме энергии, не мыслится. Но что-то произошло, что превратило эту энергию в огромный взрыв (так называемый Большой взрыв). В следующие секунды после Большого взрыва начала формироваться материя.
Первыми появившимися простейшими формами материи были протоны и электроны. Некоторые из них объединяются в атомы водорода. Последний состоит из одного протона и одного электрона; это самый простой атом, который может существовать.  Медленно, в течение длительных периодов времени атомы водорода стали собираться вместе в определенных областях пространства, образуя плотные облака. Водород в этих облаках стягивался в компактные образования гравитационными силами. В конце концов эти облака водорода стали достаточно плотными, чтобы сформировать звезды..
Медленно, в течение длительных периодов времени атомы водорода стали собираться вместе в определенных областях пространства, образуя плотные облака. Водород в этих облаках стягивался в компактные образования гравитационными силами. В конце концов эти облака водорода стали достаточно плотными, чтобы сформировать звезды..
Звезды как химические реакторы новых элементов
Звезда – просто масса вещества, которая генерирует энергию ядерных реакций. Наиболее распространенная из этих реакций представляет комбинацию четырех атомов водорода, образующих один атом гелия. Как только звезды начали формироваться, то гелий стал вторым элементом, появившимся во Вселенной.
Когда звезды становятся старше, они переходят от водородно-гелиевых ядерных реакций на другие их типы. В них атомы гелия образуют атомы углерода. Позже атомы углерода образуют кислород, неон, натрий и магний. Еще позже неон и кислород соединяются друг с другом с образованием магния. Поскольку эти реакции продолжаются, то все более и более химических элементов образуются.
Первые системы химических элементов
Более 200 лет назад химики начали искать способы их классификации. В середине девятнадцатого века были известны около 50 химических элементов. Один из вопросов, который стремились разрешить химики. сводился к следующему: химический элемент – это полностью отличное от любого другого элемента вещество? Или некоторые элементы, связанные с другими в некотором роде? Есть ли общий закон, их объединяющий?
Химики предлагали различные системы химических элементов. Так, например, английский химик Уильям Праут в 1815 г. предположил, что атомные массы всех элементов кратны массе атома водорода, если принять ее равной единице, т. е. они должны быть целыми числами. В то время атомные массы многих элементов уже были вычислены Дж. Дальтоном по отношению к массе водорода. Однако если для углерода, азота, кислорода это примерно так, то хлор с массой 35,5 в эту схему никак не вписывался.
Немецкий химик Иоганн Вольфганг Доберайнер (1780 — 1849) показал в 1829 году, что три элемента из так называемой группы галогенов (хлор, бром и йод) могут классифицироваться по их относительным атомным массам. Атомный вес брома (79,9) оказался почти точно средним из атомных весов хлора (35,5) и йода (127), а именно 35,5 + 127 ÷ 2 = 81,25 (близко к 79,9). Это был первый подход к построению одной из групп химических элементов. Доберайнер обнаружил еще две таких триады элементов, но сформулировать общий периодический закон ему не удалось.
Как появилась периодическая система химических элементов
Большинство ранних классификационных схем было не очень успешными. Затем, около 1869 года, двумя химиками было сделано почти одно открытие и почти в одно время. Русский химик Дмитрий Менделеев (1834-1907) и немецкий химик Юлиус Лотар Мейер (1830-1895) предложили организовать элементы, которые имеют аналогичные физические и химические свойства, в упорядоченную систему групп, рядов и периодов. При этом Менделеев и Мейер указывали, что свойства химических элементов периодически повторяются в зависимости от их атомных весов.
Сегодня Менделеев, как правило, считается первооткрывателем периодического закона, потому что он сделал один шаг, который Мейер не сделал. Когда все элементы были расположены в периодической таблице, в ней появились некоторые пробелы. Менделеев предсказал, что это места для элементов, которые еще не были обнаружены.
Однако он пошел еще дальше. Менделеев предсказал свойства этих еще не открытых элементов. Он знал, где они расположены в периодической таблице, так что мог прогнозировать их свойства. Примечательно, что каждый предсказанный химический элемент Менделеева, будущие галлий, скандий и германий, были обнаружены менее чем через десять лет после опубликования им периодического закона.
Короткая форма периодической таблицы
Были попытки подсчитать, сколько вариантов графического изображения периодической системы предлагалось разными учеными. Оказалось, больше 500. Причем 80% общего числа вариантов – это таблицы, а остальное – геометрические фигуры, математические кривые и т. д. В итоге практическое применение нашли четыре вида таблиц: короткая, полудлинная, длинная и лестничная (пирамидальная). Последняя была предложена великим физиком Н. Бором.
На рисунке ниже показана короткая форма. 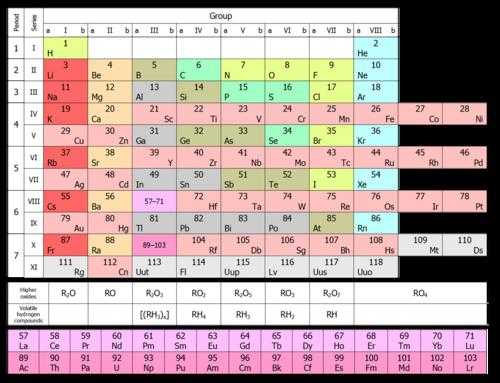 В ней химические элементы расположены по возрастанию их атомных номеров слева направо и сверху вниз. Так, первый химический элемент периодической таблицы водород имеет атомный номер 1 потому, что ядра атомов водорода содержит один и только один протон. Аналогично и кислород имеет атомный номер 8, так как ядра всех атомов кислорода содержат 8 протонов (см. рисунок ниже).
В ней химические элементы расположены по возрастанию их атомных номеров слева направо и сверху вниз. Так, первый химический элемент периодической таблицы водород имеет атомный номер 1 потому, что ядра атомов водорода содержит один и только один протон. Аналогично и кислород имеет атомный номер 8, так как ядра всех атомов кислорода содержат 8 протонов (см. рисунок ниже). 
Главные структурные фрагменты периодической системы – периоды и группы элементов. В шести периодах все клетки заполнены, седьмой еще не завершен (элементы 113, 115, 117 и 118 хотя и синтезированы в лабораториях, однако еще официально не зарегистрированы и не имеют названий).
Группы подразделяются на главные (A) и побочные (B) подгруппы. Элементы первых трех периодов, содержащих по одному ряду-строке, входят исключительно в A-подгруппы. Остальные четыре периода включают по два ряда-строки.
Химические элементы в одной группе, как правило, имеют схожие химические свойства. Так, первую группу составляют щелочные металлы, вторую – щелочноземельные. Находящиеся в одном периоде элементы имеют свойства, медленно изменяющиеся от щелочного металла до благородного газа. Рисунок ниже показывает, как одно из свойств – атомный радиус – изменяется для отдельных элементов в таблице.
Длиннопериодная форма периодической таблицы
Она показана на рисунке ниже и делится в двух направлениях, по строкам и по столбцам. Есть семь строк-периодов, как и в короткой форме, и 18 столбцов, называемых группами или семьями. По сути, увеличение числа групп с 8 в короткой форме до 18 в длинной получено путем размещения всех элементов в периодах, начиная с 4-го, не в две, а в одну строку.
Две разных системы нумерации используются для групп, как показано в верхней части таблицы. Система на основе римских цифр (IA, IIA, IIB, IVB и т. д.) традиционно была популярна в США. Другая система (1, 2, 3, 4 и т. д.) традиционно используется в Европе, а несколько лет назад была рекомендована для использования в США.

Вид периодических таблиц на рисунках выше немного вводит в заблуждение, как и в любой такой опубликованной таблице. Причиной этого является то, что две группы элементов, показанных в нижней части таблиц, на самом деле должны быть расположены внутри них. Лантаноиды, например, принадлежат к периоду 6 между барием (56) и гафнием (72). Кроме того, актиноиды принадлежат периоду 7 между радием (88) и резерфордием (104). Если бы они были вставлены в таблицу, то она стала бы слишком широкой, чтобы поместиться на листе бумаги или настенной диаграмме. Поэтому принято эти элементы размещать в нижней части таблицы.
www.syl.ru
Химические элементы Википедия
Хими́ческий элеме́нт — это совокупность атомов с одинаковым зарядом атомных ядер. Атомное ядро состоит из протонов, число которых равно атомному номеру элемента, и нейтронов, число которых может быть различным[1]. Каждый химический элемент имеет своё латинское название и химический символ, состоящий из одной или пары латинских букв, регламентированные ИЮПАК и приводятся, в частности, в таблице Периодической системы элементов Менделеева[2].
Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные)[3]. Необходимо различать химические элементы (абстрактные объекты, описываемые через свои характеристики) и соответствующие им материальные объекты — простые вещества (обладающие определёнными физико-химическими свойствами)[4].
По состоянию на 2016 год известно 118[5] химических элементов. 94 из них встречаются в природе (некоторые лишь в микроколичествах), а остальные 24 искусственно синтезированы.
История становления понятия[ | код]
Слово «элемент» (лат. elementum) использовалось ещё в античности (Цицероном, Овидием, Горацием) как часть чего-то (элемент речи, элемент образования и т. п.). В древности было распространено изречение «Как слова состоят из букв, так и тела — из элементов». Отсюда — вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» — «em» — «en» — «tum»).[6]
Близкое к современному пониманию понятие химического элемента отражала новая система химической философии, изложенная Робертом Бойлем в книге «Химик-скептик» (1661). Бойль указал, что ни четыре стихии Аристотеля, ни три принципа алхимиков не могут быть признаны в качестве элементов. Элементы, согласно Бойлю — практически неразложимые тела (вещества), состоящие из сходных однородных (состоящих из первоматерии) корпускул, из которых составлены все сложные тела и на которые они могут быть разложены. Корпускулы могут различаться формой, размером, массой. Корпускулы, из которых образованы тела, остаются неизменными при превращениях последних[7].
В 1789 г. Антуан Лоран Лавуазье в «Элементарном курсе химии», приводит первый в истории новой химии список химических элементов (таблицу простых тел), разделённых на несколько типов. Он впервые отождествляет с химическими элементами ряд простых веществ (в их числе, кислород, азот, водород, сера, фосфор, уголь и все известные к тому времени металлы). В число элементов были включены свет, теплород и «солеобразующие землистые вещества» (трудноразлагаемые оксиды кальция, магния и др.). Данную концепцию элементов принято называть эмпирико-аналитической, поскольку Лавуазье избрал критерием определения элемента опыт и только опыт, категорически отвергая любые неэмпирические рассуждения об атомах и молекулах, само существование которых невозможно подтвердить экспериментально[8].
Благодаря Джону Дальтону в начале XIX в. в химии возобладала атомно-молекулярная гипотеза, рассматривающая химический элемент как отдельный вид атомов и указывающая на природу простых и сложных веществ, как состоящих, соответственно, из атомов одного или различного видов. Дальтон же впервые указывает на атомный вес как важнейшее свойство элементов, определяющее его химическую природу. Благодаря усилиям Йёнса Берцелиуса и его последователей были весьма точно определены атомные веса (атомные массы) известных элементов. Середина XIX в. ознаменовалась целым рядом открытий новых элементов. На международном съезде химиков в г. Карлсруэ в 1860 г.
ru-wiki.ru