Агрегатные состояния вещества. Свойства агрегатных состояний
Свойства веществ в разных агрегатных состояниях
| Состояние | Свойства |
| Газообразное | 1. Способность принимать объем и форму сосуда. 2. Сжимаемость. 3. Быстрая диффузия (хаотичное движение молекул). 4. Екинетич. > Епотенц. |
| Жидкое | 1. Способность принимать форму той части сосуда, которую занимает вещество. 2. Неспособность расширяться до заполнения сосуда. 3. Незначительная сжимаемость. 4. Медленная диффузия. 5. Текучесть. 6. Екинетич. = Епотенц. |
| Твердое | 1. Способность сохранять свойственную форму и объем. 2. Незначительная сжимаемость (под давлением). 3. Очень медленная диффузия за счет колебательных движений частиц. 4. Отсутствие текучести. 5. Екинетич. < Епотенц. |
Агрегатное состояние вещества определяется силами, действующими между молекулами, расстоянием между частицами и характером их движения.
В твердом состоянии частицы занимают определенное положение относительно друг друга. Оно обладает низкой сжимаемостью, механической прочностью, поскольку молекулы не обладают свободой движения, а только колебания. Молекулы, атомы или ионы, образующие твердое вещество, называют структурными единицами. Твердые вещества делятся на аморфные и кристаллические (табл. 27).
Таблица 33
Сравнительная характеристика аморфных и кристаллических веществ
| Вещество | Характеристика |
| | 1. Ближний порядок расположения частиц. 2. Изотропность физических свойств. 3. Отсутствие конкретной точки плавления. 4. Термодинамическая нестабильность (большой запас внутренней энергии). 5. Текучесть. Примеры: янтарь, стекло, органические полимеры и др. |
| Кристаллическое | 1. Дальний порядок расположения частиц. 2. Анизотропность физических свойств. 3. Конкретная температура плавления. 4. Термодинамическая устойчивость (малый запас внутренней энергии). 5. Есть элементы симметрии. Примеры: металлы, сплавы, твердые соли, углерод (алмаз, графит) и др. |
Кристаллические вещества плавятся при строго определенной температуре (Тпл), аморфные – не имеют резко выраженной температуры плавления; при нагревании они размягчаются (характеризуются интервалом размягчения) и переходят в жидкое или вязкотекучие состояние. Внутреннее строение аморфных веществ характеризуется беспорядочным расположением молекул. Кристаллическое состояние вещества предполагает правильное расположение в пространстве частиц, составляющих кристалл, и образованием кристаллической (пространственной) решетки. Основной особенностью кристаллических тел является их анизотропия - неодинаковость свойств (тепло-, электропроводность, механическая прочность, скорость растворения и т.д.) по разным направлениям, в то время как аморфные тела изотропны.
Твердые кристаллы - трехмерные образования, характеризующиеся строгой повторяемостью одного и того же элемента структуры (элементарной ячейки) во всех направлениях. Элементарная ячейка - представляет собой наименьший объем кристалла в виде параллелепипеда, повторяющегося в кристалле бесконечное число раз.
Основные параметры кристаллической решетки:
Энергия кристаллической решетки (Екр., кДж/моль) – это энергия, которая выделяется при образовании 1 моль кристалла из микрочастиц (атомов, молекул, ионов), находящихся в газообразном состоянии и удаленных друг от друга на расстояние, исключающее их взаимодействие.
Константа кристаллической решетки (d, [A0]) – наименьшее расстояние между центром двух частиц в кристалле, соединенных химической связью.
Координационное число (к.ч.) – число частиц, окружающих в пространстве центральную частицу, связанных с ней химической связью.
Точки, в которых размещены частицы кристалла, называются узлами кристаллической решетки
Несмотря на многообразие форм кристаллов, их можно классифицировать. Систематизация форм кристаллов была введена А. В. Гадолиным (1867 г.), она основана на особенностях их симметрии. В соответствии с геометрической формой кристаллов возможны следующие их системы (сингонии): кубическая, тетрагональная, орторомбическая, моноклинная, триклинная, гексагональная и ромбоэдрическая (рис. 18).
Одно и то же вещество может иметь различные кристаллические формы, которые отличаются по внутреннему строению, а значит, и по физико-химическим свойствам. Такое явление называется полиморфизмом. Изоморфизм – два разных по природе вещества образуют кристаллы одинаковой структуры. Такие вещества могут замещать друг друга в кристаллической решетке, образуя смешанные кристаллы.
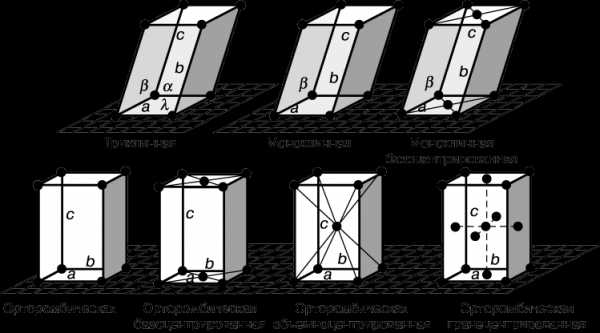
Рис. 18. Основные системы кристаллов.
В зависимости от вида частиц, находящихся в узлах кристаллической решетки и типа связей между ними кристаллы бывают четырех типов: ионные, атомные, молекулярные и металлические (рис.19).

Рис. 19. Виды кристаллов
Характеристика кристаллических решеток представлена в табл. 34.
Таблица 34
studfiles.net
Агрегатные состояния вещества.
Коллоидная химия
Агрегатные состояния вещества.
В этом разделе мы рассмотрим агрегатные состояния, в которых пребывает окружающая нас материя и силы взаимодействия между частицами вещества, свойственные каждому из агрегатных состояний.
Принято считать, что вещество может находиться в одном из трёх агрегатных состояниях:
1. Состояние твёрдого тела,
2. Жидкое состояние и
Часто выделяют четвёртое агрегатное состояние – плазму.
Иногда, состояние плазмы считают одним из видов газообразного состояния.
Плазма — частично или полностью ионизированный газ, чаще всего существующий при высоких температурах.
Плазма является самым распространённым состоянием вещества во вселенной, поскоьку материя звёд пребывает именно в этом состоянии.
Для каждого агрегатного состояния характерны особенности в характере взаимодействия между частицами вещества, что влияет на его физические и химические свойства.
Каждое вещество может пребывать в разных агрегатных состояниях. При достаточно низких температурах все вещества находятся в твёрдом состоянии. Но по мере нагрева они становятся жидкостями, затем газами. При дальнейшем нагревании они ионизируются (атомы теряют часть своих электронов) и переходят в состояние плазмы.
Газ
Газообразное состояние (от нидерл. gas, восходит к др.-греч. Χάος) характеризующееся очень слабыми связями между составляющими его частицами.
Образующие газ молекулы или атомы хаотически движутся и при этом преобладающую часть времени находятся на больших (в сравнении с их размерами) растояниях друг от друга. Вследствие этого силы взаимодействия между частицами газа пренебрежимо малы.
Основной особенностью газа является то, что он заполняет все доступное пространство, не образуя поверхности. Газы всегда смешиваются. Газ — изотропное вещество, то есть его свойства не зависят от направления.
При отсутствии сил тяготения давление во всех точках газа одинаково. В поле сил тяготения плотность и давление не одинаковы в каждой точке, уменьшаясь с высотой. Соответственно, в поле сил тяжести смесь газов становится неоднородной. Тяжелые газы имеют тенденцию оседать ниже, а более легкие — подниматься вверх.
Газ имеет высокую сжимаемость — при увеличении давления возрастает его плотность. При повышении температуры расширяются.
При сжатии газ может перейти в жидкость, но конденсация происходит не при любой температуре, а при температуре, ниже критической температуры. Критическая температура является характеристикой конкретного газа и зависит от сил взаимодействия между его молекулами. Так, например, газ гелий можно ожижить только при температуре, ниже от 4,2 К.
Существуют газы, которые при охлаждении переходят в твердое тело, минуя жидкую фазу. Превращения жидкости в газ называется испарением, а непосредственное превращение твердого тела в газ — сублимацией.
Твёрдое тело
Состояние твёрдого тела в сравнении с другими агрегатными состояниями характеризуется стабильностью формы.
Различают кристаллические и аморфные твёрдые тела.
Кристаллическое состояние вещества
Стабильность формы твёрдых тел связана с тем, что большинство, находящихся в твёрдом состоянии имеет кристалическое строение.
В этом случае расстояния между частицами вещества малы, а силы взаимодействия между ними велики, что и определяет стабильность формы.
В кристаллическом строении многих твёрдых тел легко убедиться, расколов кусок вещества и рассмотрев полученный излом. Обычно на изломе (например, у сахара, серы, металлов и пр.) хорошо заметны расположенные под разными углами мелкие грани кристаллов, поблескивающие вследствии различного отражения ими света.
В тех случаях, когда кристаллы очень малы, кристаллическое строение вещества можно установить при помощи микроскопа.
Формы кристаллов
Каждое вещество образует кристаллы совершенно определённой формы.
Разнообразие кристаллических форм может быть сведено к семи группам:
1. Триклинная (параллелепипед),
2. Моноклинная (призма с параллелограммом в основании),
3. Ромбическая (прямоугольный параллелепипед),
4. Тетрагональная (прямоугольный параллелепипед с квадратом в основании),
5. Тригональная,
6. Гексагональная (призма с основанием правильного центрированного шестиугольника),
7. Кубическая (куб).
Многие вещества, в частности железо, медь, алмаз, хлорид натрия кристализуются в кубической системе. Простейшими формами этой системы являются куб, октаэдр, тетраэдр.
Магний, цинк, лёд, кварц кристализуются в гексагональной системе. Основные формы этой системы – шестигранные призмы и бипирамида.
Природные кристаллы, а также кристаллы, получаемые искусственным путём, редко в точности соответствуют теоретическим формам. Обычно при затвердевании расплавленного вещества кристаллы срастаются вместе и потому форма каждого из них оказывается не вполне правильной.
Однако как бы неравномерно не происходило развитие кристалла, как бы ни была искажена его форма, углы, под которыми сходятся грани кристалла у одного и того же вещества остаются постоянными.
Анизотропия
Особенности кристаллических тел не ограничиваются только формой кристаллов. Хотя вещество в кристалле совершенно однородно, многие из его физических свойств – прочность, теплопроводность, отношение к свету и др. – не всегда одинаковы по различным направлениям внутри кристалла. Эта важная особенность кристаллических веществ называется анизотропией.
Внутреннее строение кристаллов. Кристаллические решётки.
Внешняя форма кристалла отражает его внутреннее строение и обусловлена правильным расположением частиц, составляющих кристалл, - молекул, атомов или ионов.
Это расположение можно представить в виде кристаллической решётки – пространственного каркаса, образованного пересекающимися прямыми линиями. В точках пересечения линий – узлах решётки – лежат центры частиц.
В зависимости от природы частиц, находящихся в узлах кристаллической решётки, и от того, какие силы взаимодействия между ними преобладают в данном кристалле, различают следующие виды кристаллических решёток:
1. молекулярные,
2. атомные,
3. ионные и
4. металлические.
В узлах атомных решёток находятся атомы. Они связаны друг с другом ковалентной связью.
Веществ, обладающих атомными решётками, сравнительно мало. К ним принадлежат алмаз, кремний и некоторые неорганические соединения.
Эти вещества характеризуются высокой твёрдостью, они тугоплавки и нерастворимы практически ни в каких растворителях. Такие их свойства объясняются прочностью ковалентной связи.
В узлах молекулярных решёток находятся молекулы. Они связаны друг с другом межмолекулярными силами.
Веществ с молекулярной решёткой очень много. К ним принадлежат неметаллы, за исключением углерода и кремния, все органические соединения с неионной связью и многие неорганические соединения.
Силы межмолекулярного взаимодействия значительно слабее сил ковалентной связи, поэтому молекулярные кристаллы имеют небольшую твёрдость, легкоплавки и летучи.
В узлах ионных решёток располагаются, чередуясь положительно и отрицательно заряженные ионы. Они связаны друг с другом силами электростатического притяжения.
К соединениям с ионной связью, образующим ионные решётки, относится большинство солей и небольшое число оксидов.
По прочности ионные решётки уступают атомным, но превышают молекулярные.
Ионные соединения имеют сравнительно высокие температуры плавления. Летучесть их в большинстве случаев не велика.
В узлах металлических решёток находятся атомы металла, между которыми свободно движутся общие для этих атомов электроны.
Наличием свободных электронов в кристаллических решётках металлов можно объяснить их многие свойства: пластичность, ковкость, металлический блеск, высокую электро- и теплопроводность
Существуют вещества, в кристаллах которых значительную роль играют два рода взаимодействия между частицами. Так, в графите атомы углерода связаны друг с другом в одних направлениях ковалентной связью, а в других – металлической. Поэтому решётку графита можно рассматривать и как атомную, и как металлическую.
Во многих неорганических соединениях, например, в BeO, ZnS, CuCl, связь между частицами, находящимися в узлах решётки, является частично ионной, а частично ковалентной. Поэтому решётки подобных соединений можно рассматривать как промежуточные между ионными и атомными.
Аморфное состояние вещества
Свойства аморфных веществ
Среди твёрдых тел встречаются такие, в изломе которых нельзя обнаружить никаких признаков кристаллов. Например, если расколоть кусок обыкновенного стекла, то его излом окажется гладким и, в отличие от изломов кристаллов, ограничен не плоскими, а овальными поверхностями.
Подобная же картина наблюдается при раскалывании кусков смолы, клея и некоторых других веществ. Такое состояние вещества называется аморфным.
Различие между кристаллическими и аморфными телами особенно резко проявляется в их отношении к нагреванию.
В то время как кристаллы каждого вещества плавятся при строго определённой температуре и при той же температуре происходит переход из жидкого состояния в твёрдое, аморфные тела не имеют постоянной температуры плавления. При нагревании аморфное тело постепенно размягчается, начинает растекаться и, наконец, становится совсем жидким. При охлаждении оно также постепенно затвердевает.
В связи с отсутствием определённой температуры плавления аморфные тела обладают другой способностью: многие из них подобно жидкостям текучи, т.е. при длительном действии сравнительно небольших сил они постепенно изменяют свою форму. Например, кусок смолы, положенный на плоскую поверхность, в теплом помещении на несколько недель растекается, принимая форму диска.
Строение аморфных веществ
Различие между кристаллическим и аморфным состоянием вещества состоит в следующем.
Упорядоченное расположение частиц в кристалле, отражаемое элементарной ячейкой, сохраняется на больших участках кристаллов, а в случае хорошо образованных кристаллов – во всём их объёме.
В аморфных телах упорядоченность в расположении частиц наблюдается только на очень малых участках. Кроме того, в ряде аморфных тел даже эта местная упорядоченность носит лишь приблизительный характер.
Это различие можно коротко сформулировать следующим образом:
- структура кристаллов характеризуется дальним порядком,
- структура аморфных тел – ближним.
Примеры аморфных веществ.
К стабильно-аморфным веществам принадлежат стекла (искусственные и вулканические), естественные и искусственные смолы, клеи, парафин, воск и др.
Переход из аморфного состояния в кристаллическое.
Некоторые вещества могут находиться как в кристаллическом, так и в аморфном состоянии. Диоксид кремния SiO2 встречается в природе в виде хорошо образованных кристаллов кварца, а также в аморфном состоянии (минерал кремень).
При этом кристаллическое состояние всегда более устойчиво. Поэтому самопроизвольный переход из кристаллического вещества в аморфное невозможен, а обратное превращение – самопроизвольный переход из аморфного состояния в кристаллическое – возможно и иногда наблюдается.
Примером такого превращения служит расстеклование – самопроизволная кристаллизация стекла при повышенных температурах, сопровождающаяся его разрушением.
Аморфное состояние многих веществ получается при высокой скорости затвердевания (остывания) жидкого расплава.
У металлов и сплавов аморфное состояние формируется, как правило, если расплав охлаждается за время порядка долей-десятков миллисекунд. Для стёкол достаточно намного меньшей скорости охлаждения.
Кварц (SiO2) также имеет низкую скорость кристаллизации. Поэтому отлитые из него изделия получаются аморфными. Однако природный кварц, имевший сотни и тысячи лет для кристаллизации при остывании земной коры или глубинных слоёв вулканов, имеет крупнокристаллическое строение, в отличие от вулканического стекла, застывшего на поверхности и поэтому аморфного.
Жидкости
Жидкость – промежуточное состояние между твёрдым телом и газом.
Жидкое состояние является промежуточным между газообразным и кристаллическим. По одним свойствам жидкости близки к газам, по другим – к твёрдым телам.
С газами жидкости сближает, прежде всего, их изотропность и текучесть. Последняя обуславливает способность жидкости легко изменять свою форму.
Однако высокая плотность и малая сжимаемость жидкостей приближает их к твёрдым телам.
Способность жидкостей легко изменять свою форму говорит об отсутствии в них жёстких сил межмолекулярного взаимодействия.
В то же время низкая сжимаемость жидкостей, обусловливающая способность сохранять постоянный при данной температуре объём, указывает на присутствие хотя и не жёстких, но всё же значительных сил взаимодействия между частицами.
Соотношение потенциальной и кинетической энергии.
Для каждого агрегатного состояния характерно своё соотношение между потенциальной и кинетической энергиями частиц вещества.
У твёрдых тел средняя потенциальная энергия частиц больше их средней кинетической энергии. Поэтому в твёрдых телах частицы занимают определённые положения друг относительно друга и лишь колеблются относительно этих положений.
Для газов соотношение энергий обратное, вследствии чего молекулы газов всегда находятся в состоянии хаотического движения и силы сцепления между молекулами практически отсутствуют, так что газ всегда занимает весь предоставленный ему объём.
В случае жидкостей кинетическая и потенциальная энергия частиц приблизительно одинаковы, т.е. частицы связаны друг с другом, но не жёстко. Поэтому жидкости текучи, но имеют постоянный при данной температуре объём.
Стуктуры жидкостей и аморфных тел схожи.
В результате применения к жидкостям методов структурного анализа установлено, что по структуре жидкости подобны аморфным телам. В большинстве жидкостей наблюдается ближний порядок – число ближайших соседей у каждой молекулы и их взаимное расположение приблизительно одинаковы во всём объёме жидкости.
Степень упорядоченности частиц у различных жидкостей различна. Кроме того, она изменяется при изменении температуры.
При низких температурах, незначительно превышающих температуру плавления данного вещества, степень упорядоченности расположения частиц данной жидкости велика.
С ростом температуры она падает и по мере нагревания свойства жидкости всё больше и больше приближаются к свойствам газа. При достижении критической температуры различие между жидкостью и газом исчезает.
Вследствии сходства во внутренней структуре жидкостей и аморфных тел последние часто рассматриваются как жидкости с очень высокой вязкостью, а к твёрдым телам относят только вещества в кристаллическом состоянии.
Уподобляя аморфные тела жидкостям, следует, однако, помнить, что в аморфных телах в отличие от обычных жидкостей частицы имеют незначительную подвижность – такую же как в кристаллах.
xn----7sbb4aandjwsmn3a8g6b.xn--p1ai
Агрегатное состояние | Virtual Laboratory Wiki
Агрега́тное состоя́ние — состояние вещества, характеризующееся определёнными качественными свойствами — способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение агрегатного состояния сопровождается скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств.
Выделяют следующие агрегатные состояния:
Твёрдое тело: Состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия. Присутствует как дальний, так и ближний порядок. Жидкость: Состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако неспособно сохранять форму. Жидкость легко принимает форму сосуда, в которую она помещена. Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места. Присутствует только ближний порядок. Газ: Состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров. Плазма: Часто причисляемая к агрегатным состояниям вещества плазма отличается от газа большой степенью ионизации атомов.
Твёрдое и жидкие состояния вещества относятся к конденсированным состояниям — атомы или молекулы вещества в них находятся настолько близко друг к другу, что неспособны свободно двигаться.
Изменение агрегатного состояния — термодинамические процессы, являющиеся фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация.
Понятие агрегатного достаточно условно — существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью; высокоэластичные состояния некоторых полимеров, предстваляющте нечто среднее между стеклообразным и жидким состоянием, жидкие кристаллы и другие. Также существуют плавные переходы между некоторыми агрегатными состояниями (см. критические явления). С другой стороны стоит отметить наличие нескольких различных состояний твёрдых тел, как например, графит, алмаз и уголь, относящихся к одному агрегатному состоянию. Для описания различных состояний в физике чаще используется боле широкое понятие фазы.
Агрегатные состояния, наблюдающихся практически у всех веществ Править
- твердое тело (аморфное либо кристаллическое), держит как форму, так и объём.
- жидкость, характеризуется более низкой плотностью и промежуточными температурами. Жидкость держит объём, но не держит форму.
- газообразное состояние, характеризуется низкой плотностью и достаточно высокой температурой. Газ не держит ни форму, ни объём.
- сверхкритический флюид, который возникает при одновременном повышении температуры и давления до т. н. критической точки, в которой плотность жидкости сравнивается с плотностью газа; при этом исчезает граница между жидкой и газообразной фазами. Сверхкритический флюид отличается исключительно высокой растворяющей способностью
- плазма (часто называемое четвертое состояние вещества), представляет собой частично или полностью ионизованный газ и возникает при высокой температуре, от нескольких тысяч кельвинов и выше. В целом её свойства напоминают свойства газообразного состояния вещества, за исключением того факта, что для плазмы принципиальную роль играет электродинамика.
Вырожденная материя Править
- Ферми-газ 1-я стадия Электронно-вырожденный газ, наблюдается в белых карликах, играет важную роль в эволюции звезд
- 2-я стадия нейтронное состояние в него вещество переходит при сверхвысоком давлении, недостижимом пока в лаборатории, но существующем внутри нейтронных звёзд. При переходе в нейтронное состояние электроны вещества взаимодействуют с протонами и превращаются в нейтроны. В результате вещество в нейтронном состоянии полностью состоит из нейтронов и обладает плотностью порядка ядерной. Температура вещества при этом не должна быть слишком высока (в энергетическом эквиваленте не более сотни МэВ).
- при сильном повышении температуры (сотни МэВ и выше) в нейтронном состоянии начинают рождаться и аннигилировать разнообразные мезоны. При дальнейшем повышении температуры происходит деконфайнмент, и вещество переходит в состояние кварк-глюонной плазмы. Оно состоит уже не из адронов, а из постоянно рождающихся и исчезающих кварков и глюонов. Возможно (1), деконфайнмент происходит в два этапа.
- При дальнейшем неограниченном повышении давления без повышения температуры вещество коллапсирует в чёрную дыру.
- При одновременном повышении и давления, и температуры к кваркам и глюонам добавляются иные частицы. Что происходит с веществом, пространством и временем при температурах, близких к планковской, пока неизвестно...
Другие состояния Править
При глубоком охлаждении газы некоторых (далеко не всех) веществ переходят в состояние бозе-конденсата. Некоторые другие вещества при низких температурах переходят в сверхпроводящее или сверхтекучее состояние. Эти состояния безусловно являются отдельными термодинамическими фазами, однако их вряд ли стоит называть новыми агрегатными состояниями вещества в силу их неуниверсальности.
Неоднородные вещества типа паст, гелей, суспензий, аэрозолей и т. д., которые при определённых условиях демонстрируют свойства как твёрдых тел, так и жидкостей и даже газов, обычно относят к классу дисперсных материалов, а не к каким-либо конкретным агрегатным состояниям вещества.
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Агрегатное состояние. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .
ru.vlab.wikia.com
Агрегатное состояние — Википедия

Агрега́тное состоя́ние вещества (от лат. aggrego «присоединяю») — физическое состояние вещества, зависящее от соответствующего сочетания температуры и давления. Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других физических величин.[1]
Традиционно выделяют три агрегатных состояния: твёрдое тело, жидкость и газ. К агрегатным состояниям принято причислять также плазму[2], в которую переходят газы при повышении температуры и фиксированном давлении. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию. Существуют и другие агрегатные состояния.
Определения агрегатных состояний не всегда являются строгими. Так, существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью и способностью сохранять форму; жидкие кристаллы текучи, но при этом обладают некоторыми свойствами твёрдых тел, в частности, могут поляризовать проходящее через них электромагнитное излучение.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями.
Основным термодинамическим (феноменологическим) признаком различия видов агрегатного состояния вещества является наличие энергетической границы между фазами: теплота испарения как граница между жидкостью и её паром и теплота плавления как граница между твёрдым веществом и жидкостью[3].
Четыре основных состояния
Твёрдое тело
Кристаллические вещества: атомное разрешение изображения титаната стронция. Яркие атомы — Sr, темнее их Ti.В твёрдом состоянии вещество сохраняет как форму, так и объём. При низких температурах все вещества замерзают — превращаются в твёрдые тела. Температура затвердевания может быть несколько повышена при увеличении давления. Твёрдые тела делятся на кристаллические и аморфные. С микроскопической точки зрения твёрдые тела характерны тем, что молекулы или атомы в них в течение длительного времени сохраняют своё среднее положение неизменным, только совершая колебания с небольшой амплитудой вокруг них. В кристаллах средние положения атомов или молекул строго упорядочены. Кристаллы характеризуются пространственной периодичностью в расположении равновесных положений атомов, которая достигается наличием дальнего порядка и носит название кристаллической решётки. Естественная форма кристаллов — правильные многогранники.
В аморфных телах атомы колеблются вокруг хаотически расположенных точек, у них отсутствует дальний порядок, но сохраняется ближний, при котором молекулы расположены согласованно на расстоянии, сравнимом с их размерами. Согласно классическим представлениям, устойчивым состоянием (с минимумом потенциальной энергии) твёрдого тела является кристаллическое. Частным случаем аморфного состояния является стеклообразное состояние. Аморфное тело находится в метастабильном состоянии и с течением времени должно перейти в кристаллическое состояние, однако время кристаллизации часто столь велико, что метастабильность вовсе не проявляется. Аморфное тело можно рассматривать как жидкость с очень большой (часто бесконечно большой) вязкостью. Кристаллические твёрдые тела имеют анизотропные свойства, то есть их отклик на приложенные внешние силы зависит от ориентации сил относительно кристаллографических осей. В твердотельном состоянии вещества могут иметь много фаз, которые отличаются составлением атомов или другими характеристиками, такими как упорядочение спинов в ферромагнетиках.
Жидкость
Структура классической одноатомной жидкости.В жидком состоянии вещество сохраняет объём, но не сохраняет форму. Это означает, что жидкость может занимать только часть объёма сосуда, но также может свободно перетекать по всей поверхности сосуда. Жидкое состояние обычно считают промежуточным между твёрдым телом и газом. Форма жидких тел может полностью или отчасти определяться тем, что их поверхность ведёт себя как упругая мембрана. Так, вода может собираться в капли. Но жидкость способна течь даже под своей неподвижной поверхностью, и это тоже означает изменение формы (внутренних частей жидкого тела). Молекулы жидкости не имеют определённого положения, но в то же время им недоступна полная свобода перемещений. Между ними существует притяжение, достаточно сильное, чтобы удержать их на близком расстоянии. Вещество в жидком состоянии существует в определённом интервале температур, ниже которого переходит в твёрдое состояние (происходит кристаллизация либо превращение в твердотельное аморфное состояние — стекло), выше — в газообразное (происходит испарение). Границы этого интервала зависят от давления. Как правило, вещество в жидком состоянии имеет только одну модификацию. (Наиболее важные исключения — это квантовые жидкости и жидкие кристаллы.) Поэтому в большинстве случаев жидкость является не только агрегатным состоянием, но и термодинамической фазой (жидкая фаза). Все жидкости принято делить на чистые жидкости и смеси. Некоторые смеси жидкостей имеют большое значение для жизни: кровь, морская вода и др. Жидкости могут выполнять функцию растворителей. Как и газ, жидкости тоже в основном изотропные. Однако, существуют жидкости с анизотропными свойствами — жидкие кристаллы. Кроме изотропной, так называемой нормальной фазы, эти вещества, мезогены, имеют одну или несколько упорядоченных термодинамических фаз, которые называют мезофазы. Составление в мезофазы происходит благодаря особой форме молекул жидких кристаллов. Обычно это длинные узкие молекулы, которым выгодно укладываться так, чтобы их оси совпадали.
Газ
Основная статья: Газ Промежутки между молекулами газа очень большие. Молекулы газа обладают очень слабыми связями. Молекулы в газе могут перемещаться свободно и быстро.Газообразное состояние характерно тем, что оно не сохраняет ни форму, ни объём. Газ заполняет всё доступное пространство и проникает в любые его закоулки. Это состояние, свойственное веществам с малой плотностью. Переход из жидкого в газообразное состояние называют испарением, а противоположный ему переход из газообразного состояния в жидкое — конденсацией. Переход из твёрдого состояния в газообразное, минуя жидкое, называют сублимацией или возгонкой. С микроскопической точки зрения газ — это состояние вещества, в котором его отдельные молекулы взаимодействуют слабо и движутся хаотически. Взаимодействие между ними сводится к спорадическим столкновениям. Кинетическая энергия молекул превышает потенциальную. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда). По химическим свойствам газы и их смеси весьма разнообразны — от малоактивных инертных газов до взрывчатых газовых смесей. Понятие «газ» иногда распространяют не только на совокупности атомов и молекул, но и на совокупности других частиц — фотонов, электронов, броуновских частиц, а также плазму. Некоторые вещества не имеют газообразного состояния. Это вещества со сложным химическим строением, которые при повышении температуры распадаются вследствие химических реакций раньше, чем становятся газом. Не существует различных газообразных термодинамических фаз одного вещества. Газам свойственна изотропия, то есть независимость характеристик от направления. В привычных для человека земных условиях, газ имеет одинаковую плотность в любой точке, однако это не является универсальным законом, во внешних полях, например в поле тяготения Земли, или в условиях различных температур плотность газа может меняться от точки к точке. Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется паром.
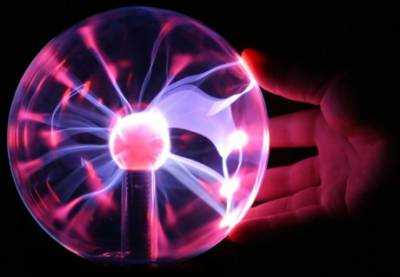
Плазма
Плазменная декоративная лампа.Четвёртым агрегатным состоянием вещества часто называют плазму. Плазма является частично или полностью ионизированным газом и в равновесном состоянии обычно возникает при высокой температуре, от нескольких тысяч К[1] и выше. В земных условиях плазма образуется в газовых разрядах. Её свойства напоминают свойства газообразного состояния вещества, за исключением того факта, что для плазмы принципиальную роль играет электродинамика, то есть равноправной с ионами и электронами составляющей плазмы является электромагнитное поле.
Плазма — самое распространённое во Вселенной агрегатное состояние вещества. В этом состоянии находится вещество звёзд и вещество, наполняющее межпланетное, межзвёздное и межгалактическое пространство. Бо́льшая часть барионного вещества (по массе около 99,9 %) во Вселенной находится в состоянии плазмы.[4].
Видео по теме
Фазовый переход
Фазовый переход по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и тому подобное) происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём, количество запасённой внутренней энергии, концентрация компонентов и т. п. Фазовые переходы второго рода происходят в тех случаях, когда меняется симметрия строения вещества (симметрия может полностью исчезнуть или понизиться).
Низкотемпературные состояния
Сверхтекучесть
Способность вещества в особом состоянии (квантовой жидкости), возникающем при понижении температуры к абсолютному нулю (термодинамическая фаза), протекать через узкие щели и капилляры без трения. До недавнего времени сверхтекучесть была известна только у жидкого гелия, однако в последние годы сверхтекучесть была обнаружена и в других системах: в разреженных атомных бозе-конденсатах, твёрдом гелии.
Сверхтекучесть объясняется следующим образом. Поскольку атомы гелия являются бозонами, квантовая механика допускает нахождение в одном состоянии произвольного числа частиц. Вблизи абсолютного нуля температур все атомы гелия оказываются в основном энергетическом состоянии. Поскольку энергия состояний дискретна, атом может получить не любую энергию, а только такую, которая равна энергетическому зазору между соседними уровнями энергии. Но при низкой температуре энергия столкновений может оказаться меньше этой величины, в результате чего рассеяния энергии попросту не будет происходить. Жидкость будет течь без трения.
Конденсат Бозе — Эйнштейна
Получается в результате охлаждения бозе-газа до температур, близких к абсолютному нулю. В таком сильно охлаждённом состоянии достаточно большое число атомов оказывается в своих минимально возможных квантовых состояниях и квантовые эффекты начинают проявляться на макроскопическом уровне. Конденсат Бозе — Эйнштейна проявляет ряд квантовых свойств, таких как сверхтекучесть и резонанс Фешбаха[en].
Фермионный конденсат
Представляет собой Бозе-конденсацию в режиме БКШ «атомных куперовских пар» в газах состоящих из атомов-фермионов. (В отличие от традиционного режима бозе-эйнштейновской конденсации составных бозонов).
Такие фермионные атомные конденсаты являются «родственниками» сверхпроводников, но с критической температурой порядка комнатной и выше. [5]
Вырожденный газ
Газ, на свойства которого существенно влияют квантовомеханические эффекты, возникающие вследствие тождественности его частиц. Вырождение наступает в условиях, когда расстояния между частицами газа становятся соизмеримыми с длиной волны де Бройля; в зависимости от спина частиц выделяются два типа вырожденных газов — ферми-газ, образованный фермионами (частицами с полуцелым спином) и бозе-газ, образованный бозонами (частицами с целым спином).
Сверхтекучее твёрдое тело
Термодинамическая фаза квантовой жидкости, представляющей собой твёрдое тело со свойствами сверхтекучей жидкости.
Высокоэнергетические состояния
Глазма
Состояние адронного поля[6], предшествующее при столкновениях кварк-глюонной плазме. Состоит из цветных токовых трубок.[7] Глазма является особенностью теоретической модели «конденсата цветового стекла» (англ. color glass condensate) — подхода к описанию сильного взаимодействия в условиях высоких плотностей[8].
Глазма образуется при столкновении адронов друг с другом (например, протонов с протонами, ионов с ионами, ионов с протонами). Считается также, что в эволюции Вселенной состояние глазмы предшествовало кварк-глюонной плазме, которая существовала в первые миллионные доли секунды сразу после Большого взрыва. Время существования глазмы — несколько иоктосекунд[9].
Кварк-глюонная плазма
Состояние вещества в физике высоких энергий и физике элементарных частиц, при котором адронное вещество переходит в состояние, аналогичное состоянию, в котором находятся электроны и ионы в обычной плазме. Ему предшествует состояние глазмы[10] (глазма термализуется, то есть разрушается, порождая множество хаотично движущихся кварков, антикварков и глюонов: кварк-глюонную плазму[11]).
Состояния при большом давлении
Нейтронное состояние
Принципиально отличное от других состояние вещества, состоящее только из нейтронов. В нейтронное состояние вещество переходит при сверхвысоком давлении, недоступном пока в лаборатории, но которое существует внутри нейтронных звезд. При переходе в нейтронное состояние, электроны вещества объединяются с протонами и превращаются в нейтроны. Для этого необходимо, чтобы силы гравитации сжали вещество настолько, чтобы преодолеть отталкивание электронов, обусловленное принципом Паули. В результате, в нейтронном состоянии, вещество полностью состоит из нейтронов и имеет плотность порядка ядерной. Температура вещества при этом не должна быть очень высокой (в энергетическом эквиваленте, в пределах от сотни МэВ).
Другие состояния
Тёмная материя
Форма материи, которая не испускает электромагнитного излучения и не взаимодействует с ним. Это свойство данной формы вещества делает невозможным её прямое наблюдение. Однако возможно обнаружить присутствие тёмной материи по создаваемым ею гравитационным эффектам.
Обнаружение природы тёмной материи поможет решить проблему скрытой массы, которая, в частности, заключается в аномально высокой скорости вращения внешних областей галактик.
Сверхкритический флюид
Состояние вещества, при котором исчезает различие между жидкой и газовой фазой. Любое вещество, находящееся при температуре и давлении выше критической точки, является сверхкритической жидкостью. Свойства вещества в сверхкритическом состоянии промежуточные между его свойствами в газовой и жидкой фазе. Так, СКФ обладает высокой плотностью, близкой к жидкости, низкой вязкостью и при отсутствии межфазных границ поверхностное натяжение также исчезает. Коэффициент диффузии при этом имеет промежуточное между жидкостью и газом значение. Вещества в сверхкритическом состоянии могут применяться в качестве заменителей органических растворителей в лабораторных и промышленных процессах. Наибольший интерес и распространение в связи с определёнными свойствами получили сверхкритическая вода и сверхкритический диоксид углерода.
Вырожденная материя
- Ферми-газ 1-я стадия Электронно-вырожденный газ, наблюдается в белых карликах, играет важную роль в эволюции звёзд.
- 2-я стадия нейтронное состояние в него вещество переходит при сверхвысоком давлении, недостижимом пока в лаборатории, но существующем внутри нейтронных звёзд. При переходе в нейтронное состояние электроны вещества взаимодействуют с протонами и превращаются в нейтроны. В результате вещество в нейтронном состоянии полностью состоит из нейтронов и обладает плотностью порядка ядерной. Температура вещества при этом не должна быть слишком высока (в энергетическом эквиваленте не более сотни МэВ).
- при сильном повышении температуры (сотни МэВ и выше) в нейтронном состоянии начинают рождаться и аннигилировать разнообразные мезоны. При дальнейшем повышении температуры происходит деконфайнмент, и вещество переходит в состояние кварк-глюонной плазмы. Оно состоит уже не из адронов, а из постоянно рождающихся и исчезающих кварков и глюонов. Возможно[12], деконфайнмент происходит в два этапа.
- При дальнейшем неограниченном повышении давления без повышения температуры вещество коллапсирует в чёрную дыру.
- При одновременном повышении и давления, и температуры к кваркам и глюонам добавляются иные частицы. Что происходит с веществом, пространством и временем при температурах, близких к планковской, пока неизвестно.
См. также
Примечания
Литература
- Шульц М. М., Мазурин О. В. Современное представление о строении стёкол и их свойствах. — Л.: Наука. 1988 ISBN 5-02-024564-X
wikipedia.green
Агрегатные состояния вещества
Молекулярное строение и свойства газообразных, жидких и твердых тел
Структура вещества и его физические свойства очень сильно зависят от характера межмолекулярного взаимодействия и теплового движения молекул. В зависимости от условий тела могут находиться в жидком, твердом или газообразном состоянии. Эти состояния называются агрегатными состояниями вещества.
Рис.1. Молекулярная структура вещества в газообразном (а), жидком (б) и твердом (в) состояниях.
Силы сцепления между частицами ничтожно малы, расстояние между молекулами газа во много раз больше размеров молекул. Малые силы притяжения не могут удержать молекулы друг около друга, поэтому газ равномерно заполняет любой доступный объём. Газы характеризуются полной беспорядочностью расположения и движения молекул (рис.1,а), молекулы газа практически не взаимодействуют. Газы легко сжимаются под действием внешнего давления, т.к. расстояния между молекулами велики, а силы взаимодействия пренебрежимо малы.
Расстояния между частицами очень близкие и равны приблизительно диаметру молекулы. При уменьшении расстояния между молекулами (сжимании жидкости) резко увеличиваются силы отталкивания, поэтому жидкости несжимаемы. В жидкостях молекулы достаточно прочно связаны друг с другом силами притяжения, что объясняет неизменность объема жидкости. Тепловое движение молекул в жидкости выражено колебаниями около положения устойчивого равновесия внутри объема, предоставленного молекуле ее соседями. Молекулы не могут свободно перемещаться по всему объему вещества, но возможны переходы молекул на соседние места. Этим объясняется текучесть жидкости, способность менять свою форму. В жидкостях наблюдается ближний порядок, т.е. наличие закономерности в расположении соседних атомов или молекул (рис.1,б). Жидкое состояние является промежуточным между газообразным и твёрдым состояниями. Современная наука имеет гораздо менее отчетливое представление о строении жидкости, чем о строении газов и твердых тел, что объясняется большой сложностью явлений, характеризующих жидкость. По сути дела, полная и строгая теория жидкого состояния еще не создана. Сложность решения этой задачи во многом определяется особенностями строения жидкости.
Силы сцепления между молекулами достаточно сильны; расстояния между частицами очень маленькие. Из-за больших сил притяжения молекулы практически не могут менять свое положение в веществе, этим и объясняется неизменность объема и формы твердых тел. В твёрдом состоянии во взаимном расположении атомов и молекул наблюдается упорядоченность на неограниченно больших расстояниях (так называемый дальний порядок) (рис.1,в). Тепловое движение молекул в твердом теле выражается только лишь колебаниями частиц (атомов, молекул) около положения устойчивого равновесия.
Среди твердых тел существует особый класс тел -аморфные тела, занимающие промежуточное положение между кристаллическими телами и жидкостями. Для них характерно долговременное сохранение формы, но при этом их атомы не образуют упорядоченную кристаллическую решетку.
Среди жидкостей так же выделяется особый класс -жидкие кристаллы, механические свойства которых близки к свойствам жидкости, но при этом для них, так же как и для твердых кристаллических тел, характерно наличие анизотропии свойств. Такое состояние возможно у веществ с большими протяжёнными молекулами, например у органических соединений. Молекулы жидких кристаллов могут достаточно легко совершать поступательные перемещения, сохраняя при этом свою ориентацию в пространстве. Анизотропия жидких кристаллов особенно проявляется в их оптических свойствах, что позволяет использовать их в устройствах формирования изображения.
Примеры решения задач
ru.solverbook.com
| Агрегатные состояния вещества План 1.Введение 2.Агрегатное состояние вещества 3.Агрегатное состояние вещества – газ 4.Агрегатное состояние вещества – жидкость 5.Агрегатное состояние вещества – твердое тело 6.Четвертое состояние вещества – плазма 7. Опыт: изменение агрегатного состояния воды 8.Заключение Введение Как известно, многие вещества в природе могут находиться в трех состояниях: твердом, жидком и газообразном. А также некоторые могут находиться еще и в четвертом - плазматическом состоянии Я выбрал данную тему потому что многие вещества используются в жизни и в разных агрегатных состояниях. Целью данной работы является – рассмотреть существующие агрегатные состояния вещества, выявить все их достоинства и недостатки. Агрегатные состояния вещества Взаимное расположение, характер движения и взаимодействия молекул одного и того же вещества существенно зависящие от внешних условий (температура, давление), характеризуют его агрегатное состояние. Различают четыре агрегатных состояния вещества: твердое, жидкое, газообразное, плазменное. Фазовый переход – переход системы из одного агрегатного состояния в другое. При фазовом переходе скачкообразно изменяется какая-либо физическая величина (например, плотность, внутренняя энергия) или симметрия системы. Переход вещества из твердого состояния в жидкое называется плавлением, а температуру, при которой это происходит – температурой плавления. Переход вещества из жидкого состояния в твердое называется кристаллизацией, а температуру перехода – температурой кристаллизации. Переход вещества из жидкого состояния в газообразное называется парообразованием. Переход вещества из газообразного состояния в жидкое называется конденсацией. Реализация того или иного агрегатного состояния вещества зависит от соотношения кинетической и потенциальной энергии молекул, входящих в его состав. Потенциальная энергия молекулы характеризует степень ее связи с другими частицами. Между любыми двумя молекулами вещества на расстоянии, большем диаметра молекул, действуют силы притяжения электромагнитного происхождения. Эти силы стремятся связать молекулы в единое целое. Кинетическая энергия молекул препятствует этой тенденции сцепления их между собой. Газ
Газ (газообразное состояние) – одно из четырех агрегатных состояний вещества, характеризующееся очень слабыми связями между составляющими его частицами (молекулами, атомами или ионами), а также их большой подвижностью. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения. Так же термин «газ» можно определить как вещество, температура которого равна или превышает критическую точку, при такой температуре сжатие газа не приводит к образованию жидкости. В этом и заключается отличие газа от пара. При повышении давления насыщенный пар частично превращается в жидкость, газ нет. Вещество находится в газообразном состоянии, если средняя кинетическая энергия молекул превышает их среднюю потенциальную энергию. Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется паром. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда). Газы могут неограниченно расширяться в пространстве, так как силы притяжения между молекулами незначительны. Большая сжимаемость газов по сравнению со сжимаемостью жидкостей и твердых тел объясняется наличием большего межмолекулярного пространства (рис.1). Рис.1 При сжатии газа уменьшается среднее расстояние между его молекулами. Однако силы взаимного отталкивания молекул на этом расстоянии невелики и практически не препятствуют сжатию. ЖИДКОСТЬ
Жидкость — вещество, находящееся в жидком агрегатном состоянии, занимающем промежуточное положение между твёрдым и газообразным состояниями. Вещество находится в жидком агрегатном состоянии, если средняя кинетическая энергия молекул соизмерима со средней потенциальной энергией их притяжения. Основным свойством жидкости, отличающим её от веществ, находящихся в других агрегатных состояниях, является способность неограниченно менять форму под действием касательных механических напряжений, даже сколь угодно малых, практически сохраняя при этом объём. При нагревании твердого тела средняя кинетическая энергия молекул, колеблющихся около положений равновесия, возрастает. Рост кинетической энергии молекул приводит к увеличению амплитуды ее колебаний. Уменьшение энергии связи при нагревании позволяет молекулам перескакивать из одного положения равновесия в другое. В результате нарушается правильное расположение частиц, характерное для кристаллической решетки твердого тела. Происходит фазовый переход вещества из твердого состояния в жидкое. Молекулы в жидкости упакованы так же плотно, как и в твердом теле, так как плотность жидкости и твердого тела примерно одинакова. При упаковке частиц в жидкости, так же как и в твердых телах, упорядоченное расположение частиц наблюдается лишь в пределах двух-трех слоев. Это означает, что при фазовом переходе твердое тело- жидкость происходит нарушение симметрии системы. Относительные положения молекул в жидкости не фиксированы. Под действием внешней силы жидкость течет, сохраняя свой объем, и принимая форму сосуда. Текучесть жидкости объясняется тем, что перескоки молекул из одного положения равновесия в другое происходят преимущественно в направлении действия внешней силы. Вещество в жидком состоянии существует в определённом интервале температур, ниже которого переходит в твердое состояние (происходит кристаллизация либо превращение в твердотельное аморфное состояние — стекло), выше — в газообразное (происходит испарение). Границы этого интервала зависят от давления. Как правило, вещество в жидком состоянии имеет только одну модификацию. Все жидкости принято делить на чистые жидкости и смеси. Некоторые смеси жидкостей имеют большое значение для жизни: кровь, морская вода и др. Жидкости могут выполнять функцию растворителей. Жидкость чрезвычайно трудно сжать механически, поскольку, в отличие от газа, между молекулами очень мало свободного пространства. Давление, производимое на жидкость, заключенную в сосуд, передаётся без изменения в каждую точку объёма этой жидкости. Эта особенность, наряду с очень малой сжимаемостью, используется в гидравлических машинах. ТВЕРДЫЕ ТЕЛА
Твёрдое тело — это одно из четырёх агрегатных состояний вещества, отличающееся от других агрегатных состояний (жидкости, газов, плазмы) стабильностью формы и характеромтеплового движения атомов, совершающих малые колебания около положений равновесия. Вещество находится в твердом состоянии, если средняя потенциальная энергия притяжения молекул много больше их средней кинетической энергии. Различают кристаллические и аморфные твёрдые тела. Аморфные тела – конденсированные вещества, атомная структура которых имеет ближний порядок, и не имеет дальнего порядка, характерного для кристаллических структур. Кристаллические тела – твердые тела, в которых атомы расположены закономерно, образую кристаллическую решетку. Молекулы в твердом теле располагаются упорядоченно. Упаковка молекул в пространстве аналогична заполнению плоскости правильными многоугольниками. Частицы твердого тела, образуя кристаллическую решетку, колеблются около некоторых средних положений равновесия, называемых узлами кристаллической решетки. Колебания молекул возможны по различным направлениям и могут иметь разную амплитуду. Значительная средняя потенциальная энергия взаимодействия препятствует изменению среднего расстояния между ними. Следствиями этого является сохранение твердыми телами формы и объема. В прошлом твёрдое тело применялось как конструкционный материал и в основе употребления лежали непосредственно ощутимые механические свойства как твёрдость, масса, пластичность, упругость, хрупкость. В современном мире применение твёрдого тела основывается на физических свойствах, которые зачастую обнаруживаются только при лабораторных исследованиях. ПЛАЗМА
Плазма— частично или полностью ионизированный газ, образованный из нейтральных атомов (или молекул) и заряженных частиц (ионов и электронов). Важнейшей особенностью плазмы является то что не смотря на наличие свободных зарядов, суммарный электрический заряд плазмы приблизительно равен нулю, это означает, что объемные плотности положительных и отрицательных заряженных частиц, из которых она образована, оказываются почти одинаковыми. Плазма иногда называется четвёртым (после твёрдого, жидкого и газообразного) агрегатным состоянием вещества. Присутствие свободных электрических зарядов делает плазму проводящей средой, что обуславливает ее заметно большее взаимодействие с магнитным и электрическим полями. Классификация Плазма обычно разделяется на идеальную и неидеальную, низкотемпературную и высокотемпературную, равновесную и неравновесную, при этом довольно часто холодная плазма бывает неравновесной, а горячая равновесной. Плазму делят на низкотемпературную (температура меньше миллиона K) и высокотемпературную (температура миллион K и выше). Такое деление обусловлено важностью высокотемпературной плазмы в проблеме осуществления управляемого термоядерного синтеза. Разные вещества переходят в состояние плазмы при разной температуре, что объясняется строением внешних электронных оболочек атомов вещества: чем легче атом отдает электрон, тем ниже температура перехода в плазменное состояние. В неравновесной плазме электронная температура существенно превышает температуру ионов. Это происходит из-за различия в массах иона и электрона, которое затрудняет процесс обмена энергией. Такая ситуация встречается в газовых разрядах, когда ионы имеют температуру около сотен, а электроны около десятков тысяч K. В равновесной плазме обе температуры равны. Поскольку для осуществления процесса ионизации необходимы температуры, сравнимые с потенциалом ионизации, равновесная плазма обычно является горячей (с температурой больше нескольких тысяч K). Степень ионизации Для того, чтобы газ перешел в состояние плазмы, его необходимо ионизировать. Степень ионизации пропорциональна числу атомов, отдавших или поглотивших электроны, и больше всего зависит от температуры. Даже слабо ионизированный газ, в котором менее 1 % частиц находятся в ионизированном состоянии, может проявлять некоторые типичные свойства плазмы (взаимодействие с внешним электромагнитным полем и высокая электропроводность). Ионизация- процесс образования ионов из атомов. Для низкотемпературной плазмы характерна малая степень ионизации (до 1 %). Так как такие плазмы довольно часто употребляются в технологических процессах, их иногда называют технологичными плазмами Горячая плазма почти всегда полностью ионизирована (степень ионизации ~100 %). Обычно именно она понимается под «четвертым агрегатным состоянием вещества». Примером может служить Солнце. Помимо температуры, которая имеет фундаментальную важность для самого существования плазмы, вторым наиболее важным свойством плазмы является плотность. Словосочетание плотность плазмы обычно обозначает плотность электронов, то есть число свободных электронов в единице объёма. Формы плазмы: Искусственно созданная плазма – Плазменные ракетные двигатели, плазменные лампы, светящая сфера ядерного взрыва и др. Земная природная плазма – Молния, Северное сияни и др. Космическая плазма – Солнце и другие звезды, космическое пространство и др. Опыт: изменение агрегатного состояния воды 1.Берем лед( твердое состояние воды) 2.Нагреваем его до перехода в жидкое состояние 3.Нагреваем до кипения и перехода в газообразное состояние Заключение Подведем итоги проделанной работы: Газ – агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Жидкость – агрегатное состояние вещества, промежуточное между твёрдым и газообразным состояниями. Жидкость, сохраняя отдельные черты как твёрдого тела, так и газа, обладает, однако, рядом только ей присущих особенностей, из которых наиболее характерная - текучесть. Подобно твёрдому телу, жидкость сохраняет свой объём, имеет свободную поверхность. Твёрдое тело – одно из четырёх агрегатных состояний вещества, отличающееся от других агрегатных состояний стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Кристаллы характеризуются дальним порядком в расположении атомов. В аморфных телах дальний порядок отсутствует. Плазма – частично или полностью ионизованный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. Выполнил: Латышев Аркадий |
fizik-school11.ucoz.ru
Агрегатные состояния вещества
Самые известные агрегатные состояния вещества
В зависимости от температуры и давления любое вещество способно принимать различные агрегатные состояния. Каждое такое состояние характеризуется определенными качественными свойствами, которые остаются неизменными в рамках температур и давлений, требуемых для данного агрегатного состояния.
К характерным свойствам агрегатных состояний можно отнести, например, способность тела, находящегося в твердом состоянии, сохранять свою форму, или наоборот – способность жидкого тела изменять форму. Однако, иногда границы между различными состояниями вещества довольно размыты, как в случаях с жидкими кристаллами, либо так называемыми «аморфными телами», которые могут быть упругими как твердые тела и текучими как жидкости.
Переход между агрегатными состояниями может происходить с выделением свободной энергии, изменением плотности, энтропии или других физических величин. Переход от одного агрегатного состояния к другому называется фазовым переходом, а явления, сопровождающие такие переходы – критическими явлениями.
Список известных агрегатных состояний
Аморфные тела(в т. ч. стеклообразные) | Твердые тела, атомы или молекулы которых не образуют кристаллическую решетку. |
Кристаллы | Твердые тела, атомы или молекулы которых образуют кристаллическую решетку. |
Жидкие кристаллы | Жидкий кристалл – это такое фазовое состояние, во время которого вещество одновременно обладает как свойствами жидкостей, так и свойствами кристаллов. |
Расплав | Состояние вещества при температурах, выше температуры плавления и ниже температуры кипения. |
Перегретая жидкость | Жидкость, температура которой превышает температуру кипения. |
Переохлажденная жидкость | Жидкость, температура которой меньше температуры кристаллизации. |
Растянутая жидкость | Состояние жидкого вещества при отрицательном давлении, вызываемым силами Ван-дер-Ваальса (силами притяжения между молекулами). |
Сверхкритическая жидкость | Состояние жидкости при температуре выше критической точки. |
Квантовая жидкость(сверхтекучесть) | Жидкость, на свойства которой влияют квантовые эффекты. |
Реальный газ | Состояние вещества, имеющего очень слабые связи между молекулами или атомами. Не поддается математическому описанию идеального газа. |
Вырожденный газ | Газ, на свойства которого влияют квантовые эффекты. |
Электромагнитная | Агрегатное состояние, представленное набором отдельных заряженных частиц, суммарный заряд которых в любом объеме системы равен нулю. |
Кварк-глюонная | Состояние вещества, при котором оно представляет собой набор глюонов, кварков и антикварков. |
Глазма | Кратковременное состояние, во время которого глюонные силовые поля натягиваются между ядрами. Предшествует кварк-глюонной плазме. |
Ферми-газ | Газ, состоящий из фермионов, на свойства которого влияют квантовые эффекты. |
Конденсат Бозе-Эйнштейна | Газ, состоящий из бозонов, на свойства которого влияют квантовые эффекты. |
spacegid.com