Большая Энциклопедия Нефти и Газа. Валентность у серы
Валентность серы (S), формулы и примеры
Общие сведения о валентности серы
При обычном давлении сера образует хрупкие кристаллы желтого цвета, плавящиеся при температуре 112,8oС. Плотность 2,07 г/см3. Нерастворима в воде, но довольно хорошо растворима в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде прозрачных желтых кристалликов ромбической системы, имеющих форму октаэдров (ромбическая модификация).
Если расплавленную серу медленно охлаждать и в тот момент, когда она частично затвердевает слить еще не успевшую застыть жидкость можно получить длинные темно-желтые игольчатые кристаллы моноклинной системы (моноклинная модификация). Плотность 1,96 г/см3. Температура плавления 119,3oС.
Валентность серы в соединениях
Сера — шестнадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Она находится в третьем периоде в VIA группе. В ядре атома серы содержится 16 протонов и 16 нейтронов (массовое число равно 32). В атоме серы есть три энергетических уровня, на которых находятся 16 электронов (рис. 1).
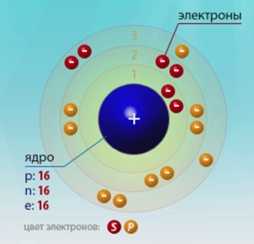
Рис. 1. Строения атома серы.
Электронная формула атома серы в основном состоянии имеет следующий вид:
1s22s22p63s23p4.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие двух неспаренных электронов свидетельствует о том, что сера способна проявлять валентность II в своих соединениях (h3SII).
Для атома серы характерно наличие нескольких возбужденных состояний из-за того, что орбитали 3d-подуровня являются вакантными (на третьем энергетическом слое помимо 3s- и 3p-подуровней есть еще и 3d-подуровень). Сначала распариваются электроны 3p -подуровня и занимают свободные d-орбитали, а после – электроны 3s-подуровня:
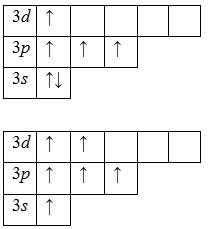
Наличие четырех и шести неспаренных электронов в возбужденном состоянии свидетельствует о том, что сера проявляет в своих соединениях валентности IV (SIVO2, h3SIVO3, Na2SIVO3) и VI (SVIO3, h3SVIO4, CaSVIO4).
Примеры решения задач
ru.solverbook.com
какая валентность у серы? срочно
(+ 16), 2,8,6 - атомы серы проявляют свойства окислителя и, присоединяя от атомов Других элементов два недостающие им электроны, превращаются в отрицательно двухвалентные ионы: S0 + 2е = S2-. Но сера - менее активный окислитель, чем кислород, поскольку ее валентные электроны более удаленные от ядра атома и слабее с ним связаны, чем валентные электроны атомов кислорода. В отличие от кислорода сера может проявлять свойства и восстановителя: S0 - 6e = S6 + или S0 - 4e = S4 +. Восстановительные свойства серы проявляются при взаимодействии ее с сильным от нее окислителем, т. е. с веществами, атомы которых имеют большую силу к приобщению электронов.Сера может непосредственно реагировать почти со всеми металлами (кроме благородных) , но преимущественно при нагревании. Так, если смесь порошков серы и железа нагреть хоть в одном месте, чтобы началась реакция, то дальше вся смесь сама собой накалится (за счет теплоты реакции) и превратится в черную хрупкую вещество - моносульфид железа: Fe + S = FeS
Смесь порошков серы и цинка при поджогах реагирует очень бурно, со вспышкой. В результате реакции образуется сульфид цинка: Zn + S = ZnS
С ртутью сера реагирует даже при обычной температуре. Так, при растирании ртути с порошком серы возникает черное вещество - сульфид ртути: Hg + S = HgS
При высокой температуре сера реагирует также с водородом с образованием сероводорода: h3 + S = h3S
При взаимодействии с металлами и водородом сера играет роль окислителя, а сама восстанавливается до ионов S2-Поэтому во всех сульфидах сера негативно двухвалентное. Сера сравнительно легко реагирует и с кислородом. Так, подожжена сера горит на воздухе с образованием диоксида серы SO2 (сульфитного ангидрида) и в очень незначительном количестве триоксида серы SO3 (сульфатного ангидрида) . S + O2 = SO2 2S + 3O2 = 2SO3
При этом окислителем является кислород, а сера - восстановителем. В первой реакции атом серы теряет четыре, а во второй - шесть валентных электронов, в результате чего сера в соединении SO2 положительно четырехвалентный, а в SO3 - положительно ШЕСТИВАЛЕНТНАЯ.
Валентность - сера - Большая Энциклопедия Нефти и Газа, статья, страница 1
Валентность - сера
Cтраница 1
Валентность серы в ионе SO3 имеет промежуточное значение ( 4), поэтому она может не только повышаться, но и понижаться. Другими словами, ион SO - способен и окисляться, и восстанавливаться. [1]
Валентность серы, равная шести, проявляется атомом S в состоянии его максимального возбуждения. Для этого потребовалась бы добавочная энергия возбуждения, что химическими методами, как мы уже говорили, не достигается. Поэтому валентность серы, равная шести, является для нее максимальной. [2]
Валентность серы в двух ее оксидах, SO2 и SO3, должна быть различной. Ведь сера в каждом из этих оксидов соединена с различным числом атомов кислорода. [3]
Повышение валентности серы происходит вследствие перехода двух электронов от молекулы сернистой кислоты к молекуле хлора. [4]
Так как валентность серы в ( Nh5) 2S2O8, находимая при подсчете ( - j - 7), не соответствует действительности ( как элемент VI группы периодической си стемы сера не может иметь валентность больше 6), то при составлении схемы перераспределения электронов следует исходить из того, что ион SaO превращается в два иона SO4, имеющих 4 избыточных электрона. [5]
Так как валентность серы в ( Nh5) jSjO8, находимая при подсчете ( 7), является фиктивной ( как элемент VI группы периодической системы сера не может иметь валентность больше 6), то при составлении схемы перераспределе -, ния электронов следует исходить из того, что ион S2Oa - - превращается при реакции в 2 иона SO4 -, имеющие в общей сложности 4 избыточных электрона. [6]
При повышении валентности серы и числа координированных вокруг атома серы атомов фтора и кислорода химическая активность соединений уменьшается так же, как и в случае фторидов серы. Особой химической инертностью обладает фтористый сульфурил, напоминающий в этом отношении SFe. Вероятно, и в этом случае химическая инертность вызвана не столько условиями равновесия, сколько кинетическими причинами. Причиной этого может являться большее отклонение формы молет кулы от правильного тетраэдра, вызванное различием радиусов атомов кислорода и хлора. [7]
Объясняется это низкой валентностью серы, вследствие чего понижается число связей кислорода и фтора с серой. Низкое состояние окисления, однако, обуславливает повышенную реакционную способность производных серы ( IV) [ по сравнению с соответствующими производными серы ( VI) ], так как сера ( IV) более восприимчива к воздействию различных химических реагентов. [8]
В этой молекуле валентность серы равна шести. [9]
Вследствие того, что валентность серы в ионе SO3 - - имеет не наименьшее, а промежуточное значение ( 4), она может не только повышаться, но и понижаться. Другими словами, ион SO3 - - способен не только окисляться, но и восстанавливаться. [10]
Тесную связь с вопросом о валентности серы имеют и некоторые другие проблемы в химии сульфонов. [11]
Однако, приняв во внимание валентность серы, которая в анионе SOj положительно четырехвалентна, а в анионе SOT шестивалентна, мы увидим, что указанное выше правило, касающееся изменения зарядов ионов при окислении, соблюдается и здесь. [12]
Химические процессы, сопровождающиеся понижением валентности серы, для сернистого газа сравнительно малохарактерны. [13]
Химические процессы, сопровождающиеся понижением валентности серы, для двуокиси серы малохарактерны. [14]
Химические процессы, сопровождающиеся понижением валентности серы, для сернистого газа сравнительно малохарактерны. [15]
Страницы: 1 2 3
www.ngpedia.ru
какая валентность у серы? срочно
какая валентность у серы? срочно
- (+ 16), 2,8,6 - атомы серы проявляют свойства окислителя и, присоединяя от атомов Других элементов два недостающие им электроны, превращаются в отрицательно двухвалентные ионы: S0 + 2е = S2-. Но сера - менее активный окислитель, чем кислород, поскольку ее валентные электроны более удаленные от ядра атома и слабее с ним связаны, чем валентные электроны атомов кислорода. В отличие от кислорода сера может проявлять свойства и восстановителя: S0 - 6e = S6 + или S0 - 4e = S4 +. Восстановительные свойства серы проявляются при взаимодействии ее с сильным от нее окислителем, т. е. с веществами, атомы которых имеют большую силу к приобщению электронов.
Сера может непосредственно реагировать почти со всеми металлами (кроме благородных) , но преимущественно при нагревании. Так, если смесь порошков серы и железа нагреть хоть в одном месте, чтобы началась реакция, то дальше вся смесь сама собой накалится (за счет теплоты реакции) и превратится в черную хрупкую вещество - моносульфид железа: Fe + S = FeS
Смесь порошков серы и цинка при поджогах реагирует очень бурно, со вспышкой. В результате реакции образуется сульфид цинка: Zn + S = ZnS
С ртутью сера реагирует даже при обычной температуре. Так, при растирании ртути с порошком серы возникает черное вещество - сульфид ртути: Hg + S = HgS
При высокой температуре сера реагирует также с водородом с образованием сероводорода: h3 + S = h3S
При взаимодействии с металлами и водородом сера играет роль окислителя, а сама восстанавливается до ионов S2-Поэтому во всех сульфидах сера негативно двухвалентное. Сера сравнительно легко реагирует и с кислородом. Так, подожжена сера горит на воздухе с образованием диоксида серы SO2 (сульфитного ангидрида) и в очень незначительном количестве триоксида серы SO3 (сульфатного ангидрида) . S + O2 = SO2 2S + 3O2 = 2SO3
При этом окислителем является кислород, а сера - восстановителем. В первой реакции атом серы теряет четыре, а во второй - шесть валентных электронов, в результате чего сера в соединении SO2 положительно четырехвалентный, а в SO3 - положительно ШЕСТИВАЛЕНТНАЯ.
- ой 2, 4, 6
4u-pro.ru
Валентность - сера - Большая Энциклопедия Нефти и Газа, статья, страница 3
Валентность - сера
Cтраница 3
Сера образует с фтором большее число соединений, чем с другими галогенами; только в соединениях с фтором проявляется характеристичная валентность серы. [31]
Докажите, что реакция ( 21) - окислительно-восстановительная и что одновременно с изменением валентности углерода при окислении изменяется и валентность серы. [32]
При реакции двувалентной серы с диолефинами, очевидно, можно ожидать не только структурирования; не исключена возможность, что обе валентности серы прореагируют с активными участками той же полимерной цепи, в результате чего произойдет замыкание цикла. [33]
Это явление можег быть объяснено энолизацией и образованием двойной связи между углеродом и серой или прямой ионизацией водорода. Вопрос о валентности серы возникает во всех случаях, когда сульфоно-вая группа активирует присоединенный водород и облегчает реакции галогенирования, конденсации или рацемизации. [34]
Положительные концы молекул воды направлены к атомам кислорода из сульфатного иона. Остальная часть компенсируется валентностью серы: 13 / 5 для первых двух и 12Д для двух других. [36]
Напомним, что соединения, в которых валентность азота равна 4, содержат одну координационную связь. Подобным образом соединения серы, в которых валентность серы больше 2, имеют одну или две координационные связи. [37]
В табл. 21 - 1 приведен ряд типичных соединений, содержащих серу, а также их тривиальные названия и названия по системе IUPAC. Часто оказывается удобным классифицировать сернистые производные в соответствии с валентностью серы в этих соединениях. Из данных табл. 21 - 1 следует, что производные двухвалентной серы в структурном отношении сходны с соединениями кислорода, типы которых были рассмотрены в предыдущих главах. [38]
В табл. 21 - 1 приведен ряд типичных соединений, содержащих серу, а также их тривиальные названия и названия по системе ШРАС. Часто оказывается удобным классифицировать сернистые производные в соответствии с валентностью серы в этих соединениях. Из данных табл. 21 - 1 следует, что производные двухвалентной серы в структурном отношении сходны с соединениями кислорода, типы которых были рассмотрены в предыдущих главах. Такие производные серы часто называют, используя частицу тио и название соответствующего кислородного аналога. [39]
Сернистый газ химически весьма активен. Характерные для него реакции можно разбить на три группы: а) протекающие без изменения валентности серы, б) связанные с ее понижением и в) идущие с ее повышением. [40]
Двуокись серы химически весьма активна. Характерные для нее реакции можно разбить на три группы: а) протекающие без изменения валентности серы, б) связанные с ее понижением и в) идущие с ее повышением. [41]
Диоксид серы химически весьма активен. Характерные для него реакции можно разбить на три группы: а) протекающие без изменения валентности серы, б) связанные с ее понижением и в) идущие с ее повышением. [42]
Свободная электронная пара в соединениях, содержащих трехвалентную серу ( как ц в случае фосфинов), не обладает такой подвижностью, как в соединениях азота, и потому удалось синтезировать оптически активные сульфониевые соли, сульф-оксиды, эфиры сульфиновой кислоты и сульфиниламины. Конфигурационная устойчивость этих трехвалентных асимметрических атомов по сравнению с атомами азота, вероятно, обусловлена тем, что благодаря большим межатомным расстояниям пирамида, образованная валентностями серы или фосфора, несколько выше, чем пирамида, образованная валентностями азота. [43]
Страницы: 1 2 3
www.ngpedia.ru
Валентность - сера - Большая Энциклопедия Нефти и Газа, статья, страница 2
Валентность - сера
Cтраница 2
Из процессов, не сопровождающихся изменением валентности серы, практическое значение имеют реакции присоединения SO2, h3SO3 и ее солей к некоторым органическим веществам. В частности, это относится ко многим красителям, причем образующиеся продукты присоединения большей частью либо бесцветны, либо слабо окрашены. [16]
Из процессов, не сопровождающихся изменением валентности серы, практическое значение имеют реакции присоединения SO2, h3SO3 и ее солей к некоторым органическим веществам. В частности, это относится ко многим красителям, причем образующиеся продукты присоединения большей частью либо бесцветны, либо слабо окрашены. [17]
Из процессов, не сопровождающихся изменением валентности серы, практическое значение имеют реакции присоединения SO2, h3SO3 и ее солей к некоторым органическим веществам. В частности, это относится ко многим. [18]
Соединения теллура с состоянием валентности, аналогичным валентности серы в серной кислоте, практически неизвестны. [19]
Соединения с состоянием валентности теллура, аналогичным валентности серы в серной кислоте, практически неизвестны. [20]
Из данных таблицы видно, что при повышении валентности серы ( от четырех до шести) и валентности фосфора ( от трех до пяти) происходит уменьшение основности илидов. Сульфоксониевый фенацилилид ( X) на пять порядков менее осиовен, чем сульфониевый ( XI), а фосфонильный илид ( VII) на семь-восемь порядков менее основен, чем илиды с трехвалентным атомом фосфора ( II-VI) ( ср. Результаты исследований делокализующей способности атомов фосфора и серы находятся в соответствии с представителями [10] о более эффективном d - p связывании при увеличении положительного заряда на атоме высшего периода. Из таблицы видно, что замена заместителей у атома фосфора на более электроотрицательные ведет к снижению основности илидов. Разница в значениях рКа при этом достигает несколькох порядков. [21]
Для самого сернистого газа процессы, ведущие к повышению валентности серы, протекают значительно труднее, чем для сернистой кислоты и ее солей. Наиболее важными из подобных реакций являются взаимодействия SO2 с хлором и кислородом. [22]
Следовательно, биологические свойства соединений в зависимости от увеличения валентности серы меняются. Возможны разные варианты соотношения веществ по токсичности. [23]
Для самого сернистого газа процессы, ведущие к повышению валентности серы, протекают значительно труднее, чем для сернистой кислоты и ее солей. Наиболее важными из подобных реакций являются взаимодействия SO2 с хлором и кислородом. [24]
Образование связи S-S снижает среднюю степень окисления серы до 5, хотя валентность серы, измеряемая числом образуемых ею ковалентных связей, равна В этом соединении шести. [25]
Если подсчитать число связей, исходящих из атома серы, то нетрудно будет определить валентность серы в сероводороде. [26]
Особый интерес представляли превращения ar - 8-тетралилметилсуль-фида [12], в котором с одной из валентностей серы связан простейший радикал - метил. Соединения, содержащие в своем составе метальную группу, часто отличаются от высших гомологов особыми свойствами. [27]
Особый интерес представляли превращения аг - - тетралилметилсуль-фида [12], в котором с одной из валентностей серы связан простейший радикал - метил. Соединения, содержащие в своем составе метальную группу, часто отличаются от высших гомологов особыми свойствами. [28]
С точки зрения правил валентности такое различие в строении молекул никак не вытекает, поскольку в обеих формах валентности серы и теллура равны 6 и, следовательно, серная кислота может иметь формулу HjSC и H6SCV To же относится и к теллуровой кислоте. Однако если принять во внимание, что координационное число шестивалентной серы равно 4, а шестивалентного теллура - 6, то разница в строении молекул серной и теллуровой кислот становится понятной. [29]
Дисульфиды в нефти представлены соединениями, в которых два атома серы связаны друг с другом, а остающиеся две валентности серы соединены с радикалами. Могут существовать, естественно, и смешанные дисульфиды, но в нефтях они не найдены. [30]
Страницы: 1 2 3
www.ngpedia.ru
Валентность серы — какая валентность у серы? срочно — 22 ответа
сера валентность
В разделе Школы на вопрос какая валентность у серы? срочно заданный автором философичный лучший ответ это (+ 16), 2,8,6 - атомы серы проявляют свойства окислителя и, присоединяя от атомов Других элементов два недостающие им электроны, превращаются в отрицательно двухвалентные ионы: S0 + 2е = S2-. Но сера - менее активный окислитель, чем кислород, поскольку ее валентные электроны более удаленные от ядра атома и слабее с ним связаны, чем валентные электроны атомов кислорода. В отличие от кислорода сера может проявлять свойства и восстановителя: S0 - 6e = S6 + или S0 - 4e = S4 +. Восстановительные свойства серы проявляются при взаимодействии ее с сильным от нее окислителем, т. е. с веществами, атомы которых имеют большую силу к приобщению электронов.Сера может непосредственно реагировать почти со всеми металлами (кроме благородных) , но преимущественно при нагревании. Так, если смесь порошков серы и железа нагреть хоть в одном месте, чтобы началась реакция, то дальше вся смесь сама собой накалится (за счет теплоты реакции) и превратится в черную хрупкую вещество - моносульфид железа:Fe + S = FeSСмесь порошков серы и цинка при поджогах реагирует очень бурно, со вспышкой. В результате реакции образуется сульфид цинка:Zn + S = ZnSС ртутью сера реагирует даже при обычной температуре. Так, при растирании ртути с порошком серы возникает черное вещество - сульфид ртути:Hg + S = HgSПри высокой температуре сера реагирует также с водородом с образованием сероводорода:h3 + S = h3SПри взаимодействии с металлами и водородом сера играет роль окислителя, а сама восстанавливается до ионов S2-Поэтому во всех сульфидах сера негативно двухвалентное. Сера сравнительно легко реагирует и с кислородом. Так, подожжена сера горит на воздухе с образованием диоксида серы SO2 (сульфитного ангидрида) и в очень незначительном количестве триоксида серы SO3 (сульфатного ангидрида) .S + O2 = SO22S + 3O2 = 2SO3При этом окислителем является кислород, а сера - восстановителем. В первой реакции атом серы теряет четыре, а во второй - шесть валентных электронов, в результате чего сера в соединении SO2 положительно четырехвалентный, а в SO3 - положительно ШЕСТИВАЛЕНТНАЯ.
Ответ от 22 ответа[гуру]Привет! Вот подборка тем с ответами на Ваш вопрос: какая валентность у серы? срочно
Ответ от 2 ответа[гуру]Привет! Вот еще темы с нужными ответами:
Ответить на вопрос:
22oa.ru