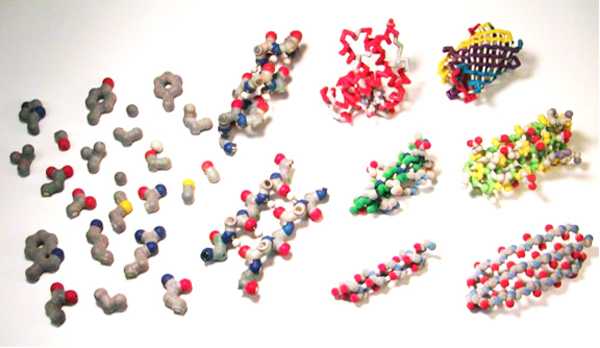Функции белков в организме человека. Функция белки
- функции белков - Биохимия
Работа и функции белков лежат в основе структуры любого организма и всех протекающих в нем жизненных реакций. Любые нарушения этих белков приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
Определение Ф.Энгельса "Жизнь есть способ существования белковых тел" до сих пор, по прошествии полутора веков, не потеряло своей правильности и актуальности.
Структурная функция
Вещество соединительной ткани и межклеточный матрикс формируют белки коллаген, эластин, кератин, протеогликаны.Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности).К данной функции можно отнести участие в создании органелл – рибосомы.
Ферментативная функция
Все ферменты являются белками.Но вместе с тем, имеются экспериментальные данные о существовании рибозимов, т.е. рибонуклеиновой кислоты, обладающей каталитической активностью.
Гормональная функция
Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками.
Рецепторная функция
Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
Транспортная функция
Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (транспорт кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
Транспорт веществ через мембраны осуществляют белки - Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры.
Резервная функция
В качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени.
Сократительная функция
Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).
Защитная функция
Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента (пропердин), при повреждении тканей работают белки свертывающей системы крови - например, фибриноген, протромбин, антигемофильный глобулин. Механическую защиту в виде слизистых и кожи осуществляют коллаген и протеогликаны.
К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови.
Белковая буферная система участвует в регуляции кислотно-щелочного состояния.
Существуют белки, которые являются предметом особого изучения:
Монеллин – выделен из африканского растения, обладает очень сладким вкусом, не токсичен и не способствует ожирению.
Резилин – обладает почти идеальной эластичностью, составляет „шарниры" в местах прикрепления крыльев насекомых.
Белки со свойствами антифриза обнаружены у антарктических рыб, они предохраняют кровь от замерзания
Вы можете спросить или оставить свое мнение.
biokhimija.ru
|
Строительная: Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
|
|
Транспортная: |
Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
|
Регуляторная: Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
|
|
Защитная: В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки - антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
|
|
Двигательная: Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
|
|
Сигнальная: В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
|
|
Запасающая: В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
|
|
Энергетическая: При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов - воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
|
|
Каталитическая: Одна из важнейших функций белков. Обеспечивается белками - ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. Copyright © BioFile 2007-2016 |
biofile.ru
Защитная функция белков. Строение и функции белков
Белки являются основой всех живых организмов. Именно эти вещества выступают компонентом клеточных мембран, органелл, хрящей, сухожилий и роговых производных кожи. Однако защитная функция белков - одна из самых важных.
Белки: особенности строения
Наряду с липидами, углеводами и нуклеиновыми кислотами белки являются органическими веществами, составляющими основу живых существ. Все они - природные биополимеры. Эти вещества состоят из многократно повторяющихся структурных единиц. Они называются мономеры. Для белков такими структурными единицами являются аминокислоты. Соединяясь в цепочки, они образуют крупную макромолекулу.
Уровни пространственной организации белка
Цепочка, состоящая из двадцати аминокислот, может образовывать различные структуры. Это уровни пространственной организации или конформации белка. Первичная структура представлена цепью из аминокислот. Когда она закручивается в спираль, возникает вторичная. Третичная структура возникает при закручивании предыдущей конформации в клубок или глобулу. А вот следующая структура самая сложная - четвертичная. Она состоит из нескольких глобул.
Свойства белков
Если четвертичная структура разрушается до первичной, а именно до цепи аминокислот, то происходит процесс, который называется денатурацией. Он обратим. Цепочка аминокислот способна снова образовать более сложные структуры. А вот когда происходит деструкция, т.е. разрушение первичной структуры, белок восстановить уже невозможно. Такой процесс является необратимым. Деструкцию осуществлял каждый из нас, когда термически обрабатывал продукты, состоящие из белка - куриные яйца, рыбу, мясо.

Функции белков: таблица
Белковые молекулы очень многобразны. Это обусловливает широкий спектр их возможностей, которые обусловлены строением аминокислот. Функции белков (таблица содержит необходимую информацию) являются необходимым условием существования живых организмов.
| Функция белка | Значение и суть процесса | Название белков, осуществляющих функцию |
Строительная (структурная) | Белок является строительным материалом для всех структур организма: от мембран клетки до мышц и связок. | Коллаген, фиброин |
| Энергетическая | При расщеплении белков выделяется энергия, необходимая для осуществления процессов жизнедеятельности организма (1 г белка - 17, 2 кДж энергии). | Проламин |
| Сигнальная | Белковые соединения клеточных мембран способны распознавать специфические вещества из окружающей среды. | Гликопротеиды |
| Сократительная | Обеспечение двигательной активности. | Актин, миозин |
| Резервная | Запас питательных веществ. | Эндосперм семян |
| Транспортная | Обеспечение газообмена. | Гемоглобин |
| Регуляторная | Регуляция химических и физиологических процессов в организме. | Белки гормонов |
| Каталитическая | Ускорение протекания химических реакций. | Ферменты (энзимы) |
Защитная функция белков в организме
Как видите, функции белков очень разнообразны и важны по своему значению. Но мы не упомянули еще об одной из них. Защитная функция белков в организме заключается в предотвращении проникновения чужеродных веществ, которые могут нанести существенный вред организму. Если же это произошло, специализированные белки способны их обезвредить. Эти защитники называются антителами или иммуноглобулинами.

Процесс формирования иммунитета
С каждым вздохом в наш организм проникают болезнетворные бактерии и вирусы. Они попадают в кровь, где начинают активно размножаться. Однако на их пути встает значительная преграда. Это белки плазмы крови - иммуноглобулины или антитела. Они являются специализированными и характеризуются способностью распознавать и обезвреживать чужеродные для организма вещества и структуры. Они называются антигенами. Так проявляется защитная функция белков. Примеры ее можно продолжить информацией об интерфероне. Этот белок также является специализированным и распознает вирусы. Это вещество даже является основой многих иммуностимулирующих лекарственных препаратов.
Благодаря наличию защитных белков организм способен противостоять болезнетворным частицам, т.е. у него формируется иммунитет. Он может быть врожденным и приобретенным. Первым все организмы наделены еще с момента появления на свет, благодаря чему и возможна жизнь. А приобретенный появляется после перенесения различных инфекционных заболеваний.
Механическая защита
Белки выполняют защитную функцию, непосредственно предохраняя клетки и весь организм от механических воздействий. К примеру, наружный скелет ракообразных играет роль панциря, надежно защищая все содержимое. Кости, мышцы и хрящи образуют основу организма, и не только предотвращают повреждение мягких тканей и органов, но и обеспечивают его передвижение в пространстве.
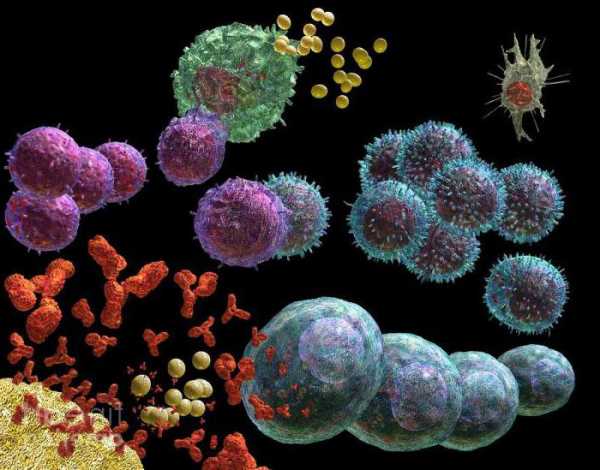
Образование тромбов
Процесс свертывания крови - это также защитная функция белков. Он возможен благодаря наличию специализированных клеток - тромбоцитов. При повреждении кровеносных сосудов они разрушаются. В результате растворимый белок плазмы фибриноген превращается в его нерастворимую форму - фибрин. Это сложный ферментативный процесс, в результате которого нити фибрина очень часто переплетаются и образуют густую сеть, которая препятствует вытеканию крови. Другими словами, образуется сгусток крови или тромб. Это является защитной реакцией организма. При нормальной жизнедеятельности этот процесс длится максимум до десяти минут. Но при болезни несвертываемости крови - гемофилии, которой страдают в основном мужчины, человек может погибнуть даже при незначительном ранении.
Однако если тромбы образуются внутри кровеносного сосуда, это может быть очень опасно. В некоторых случаях это даже приводит к нарушению его целостности и внутреннему кровоизлиянию. В этом случае рекомендованы препараты, наоборот, разжижающие кровь.

Химическая защита
Защитная функция белков проявляется и в химической борьбе с болезнетворными веществами. И начинается она уже в ротовой полости. Попадая в нее, пища вызывает рефлекторное выделение слюны. Основу этого вещества составляет вода, ферменты, которые расщепляют полисахариды и лизоцим. Именно последнее вещество обезвреживает вредоносные молекулы, защищая организм от их дальнейшего воздействия. Содержится он и в слизистых оболочках желудочно-кишечного тракта, и в слезной жидкости, которая омывает роговицу глаза. В большом количестве лизоцим находится в грудном молоке, слизи носоглотки и белке куриных яиц.
Итак, защитная функция белков проявляется в первую очередь в обезвреживании бактериальных и вирусных частиц в крови организма. В результате у него формируется способность противостоять болезнетворным агентам. Ее и называют иммунитетом. Белки, которые входят в состав наружного и внутреннего скелета, защищают внутреннее содержимое от механических повреждений. А белковые вещества, находящиеся в слюне и других средах, предотвращают действие на организм химических агентов. Другими словами, защитная функция белков заключается в обеспечении необходимых условий для всех процессов жизнедеятельности.
fb.ru
Функции белка в организме — Науколандия
Белки в живых организмах выполняют множество важных функций. Поэтому в организмах существует множество различных белков.
Ферментативная функция белков заключается в том, что они служат катализаторами различных химических реакций, протекающих в организме. Ферментативную функцию по-другому называют каталитической. При катализе происходит ускорение химических реакций, причем это ускорение может быть даже в миллионы раз.
Белков-ферментов тысячи, каждый из них обслуживает свою химическую реакции или группу схожих реакций. По типу обслуживаемых реакций ферменты делят на классы. Например, оксидоредуктазы катализируют окислительно-восстановительные реакции, гидролазы обеспечивают гидролиз химических связей и т. д. Реакцию катализирует не вся молекула фермента, а только ее так называемый активный центр. Он включает часть молекулы, которая связывает субстрат (молекулу, которая подвергается превращению), и несколько аминокислот (часто не вместе расположенных), которые обеспечивают саму реакцию.
Белки выполняют структурную функцию. Они входят в состав клеточных мембран и органоидов, межклеточного вещества (белки коллаген и эластин), волос, ногтей и т. п. (кератин).
Двигательная функция белков заключается в сокращении мышц (актин и миозин), обеспечении движения клеток, их ресничек и жгутиков.
Существуют белки, которые обеспечивают перенос различных веществ как внутри клетки, так и по всему организму. Такие белки обеспечивают транспортную функцию. Они легко связываются с субстратом, когда его концентрация высока, и легко высвобождают его при низкой концентрации. К транспортным белкам относится гемоглобин. В легких он связывает кислород и высвобождает углекислый газ, а в тканях наоборот.
Ряд белков, входящих в состав мембран клеток, обеспечивают транспорт малых молекул через мембрану. Такой транспорт может быть как пассивным (белки-каналы), так и активным (белки-переносчики).
Регуляторная и сигнальная функции белков разнообразны. Многие внутриклеточные процессы (клеточный цикл, транскрипция и трансляция, активация или подавление активности других белков и т. д.) регулируются белками.
Многие гормоны — это белки, переносимые кровью. Когда гормон связывается с определенным рецептором, то клетка получает сигнал, в результате чего в ней запускается ответная реакция. Гормоны регулируют концентрации веществ, процесс роста, период размножения и др.
Клетки взаимодействуют между собой посредством сигнальных белков, которые передаются через межклеточное вещество. Например, такие сигналы могут стимулировать или подавлять рост клеток. Таким образом обеспечивается согласованность работы клеток той или иной системы органов.
Выделяют рецепторную функцию белков. Белки-рецепторы могут находиться как в цитоплазме, так и в мембранах. Когда на рецептор действует химическое вещество или физический стимул (свет, давление и др), то он изменяется. Это изменение молекулы передается в другие части клетки, посредством катализа определенной реакции, прохождения ионов или связывания молекул-посредников.
Защитная функция белков также весьма разнообразна. Коллаген и кератин обеспечивают не только структурную функцию, но и физическую защиту организма. Также физически организм защищают фибриногены и тромбины, свертывающие кровь в местах ранения (контакта с воздухом).
Белки обеспечивают химическую защиту, связывая и расщепляя чужеродные токсины или вырабатывая свои (для защиты от других организмов).
Защитными белками являются антитела, которые обезвреживают микроорганизмы и чужеродные белки. Так белки обеспечивают иммунную защита.
Если в организме возникает дефицит углеводов и жиров, то белки, распадаясь до конечных продуктов, могут выполнять энергетическую функцию.
Белки могут запасаться как источник энергии и источник аминокислот (например, в яйцеклетках). Это запасающая функция белков.
scienceland.info
Функции белков в организме человека :: SYL.ru
Белки - что это такое?
Белки - биологические полимеры, структурными единицами которых являются аминокислоты. Часто эти соединения называют важнейшими для живых организмов химическими веществами. И действительно, функции белков чрезвычайно многообразны и значимы. Некоторые из этих функций уникальны для рассматриваемых биополимеров, некоторые реализуются также и другими соединениями.
Каталитическая (ферментативная) функция
Ферменты - белки, выполняющие функцию природных катализаторов. Иными словами, ферменты ускоряют реакции, происходящие в организме человека (и других живых существ), при этом не расходуясь. О каталитической функции часто говорят как о важнейшей функции белков.
Защитная
Белки-антитела играют одну из главных ролей в работе иммунной системы. Антитела активизируются при попадании в организм чужеродных тел (вирусов, бактерий, других микроорганизмов, токсинов). Защитные белки распознают чужеродные (антигены) по определенному биохимическому механизму и нейтрализуют их. За счет этого здоровье человека остается неповрежденным. Некоторые белки способны свертываться - это также обеспечивает им возможность выполнить защитную функцию. Например, без фибриногена было бы невозможно свертывание крови. Функции белков в организме человека различны, но нельзя не отметить особую значимость именно защитной функции.
Структурная (строительная, опорная)
Само существование организма невозможно без реализации строительной функции. Белков, являющихся структурными компонентами клеток, в теле человека больше, чем всех остальных групп. В состав почти всех тканей организма входят те или иные белки, необходимые для формирования собственно этих тканей.
Гормональная функция
Регуляция метаболизма (обмена веществ) в человеческом организме - сложный процесс, немаловажную роль в нем играют особые белки - гормоны. Функции, выполняемые каждым отдельно взятым гормоном, крайне специфичны. Важно отметить, что эти белки образуются далеко не только в железах внутренней секреции.

Транспортная
Транспортная функция реализуется по-разному различными белками. Например, гемоглобин, содержащийся в эритроцитах крови человека, отвечает за перенос кислорода по организму. Многие другие транспортные белки способны соединяться с веществами самой разнообразной природы, затем доставляя их в нужные органы.
Сократительная функция
Актин и миозин - белки, содержащиеся в мышечной ткани человека. Именно благодаря им мышцы способны к сокращению - напряжению и расслаблению. Белки с аналогичной функцией существуют и в цитоскелете клетки, благодаря им возможны определенные молекулярные процессы.
Питательная функция
В крайних случаях, при недостатке в организме более энергетически выгодных соединений - углеводов и жиров - в качестве резервного вещества могут начать использоваться белки. Иными словами, такая ситуация возможна при голодании. Питательная функция также естественна для белков, имеющих отношение к развитию зародыша (например, для тех, что находятся в яйце).
www.syl.ru
Функции белков в организме | Химия онлайн
Функции белков в природе универсальны. Белки входят в состав всех живых организмов. Мышцы, кости, покровные ткани, внутренние органы, хрящи, шерсть, кровь — все это белковые вещества.
Растения синтезируют белки из углекислого газа и воды за счет фотосинтеза. Животные организмы получают, в основном, готовые аминокислоты с пищей и на их базе строят белки своего организма.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
Видеофильм «Функции белков»
Разнообразные функции белков определяются a-аминокислотным составом и строением их высокоорганизованных макромолекул.

1. Каталитическая (ферментативная) функция
Каталитическая функция — одна из основных функций белков. Абсолютно все биохимические процессы в организме протекают в присутствии катализаторов – ферментов. Все известные ферменты представляют собой белковые молекулы.
Белки – это очень мощные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой фермент.
В настоящее время известно свыше 2000 различных ферментов, которые являются биологическими катализаторами.
Например, фермент пепсин расщепляет белки в процессе пищеварения.
Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК.
2. Транспортная функция
Некоторые белки способны присоединять и переносить (транспортировать) различные вещества по крови от одного органа к другому и в пределах клетки.
Белки транспортируют липиды (липопротеиды), углеводы (гликопротеиды), ионы металлов (глобулины), кислород и углекислый газ (гемоглобин), некоторые витамины, гормоны и др.
Например, альбумины крови транспортируют липиды и высшие жирные кислоты (ВЖК), лекарственные вещества, билирубин.
Белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин. Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
Белок миоглобин запасает кислород в мышцах.
Специфические белки-переносчики обеспечивают проникновение минеральных веществ и витаминов через мембраны клеток и субклеточных структур.
3. Защитная функция
Защитную функцию выполняют специфические белки (антитела — иммуноглобулины), которые вырабатываются иммунной системой организма. Они обеспечивают физическую, химическую и иммунную защиту организма путем связывания и обезвреживания веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов.
Например, белок плазмы крови фибриноген участвует в свертывании крови (образовывает сгусток). Это защищает организм от потери крови при ранениях.
Альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови.
Антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки. Интерфероны — универсальные противовирусные белки.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
4. Сократительная (двигательная) функция
Важным признаком жизни является подвижность, в основе которой лежит данная функция белков, таких как актин и миозин – белки мышц. Кроме мышечных сокращений к этой функции относят изменение форм клеток и субклеточных частиц.
B результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
5. Структурная функция
Структурная функция — одна из важнейших функций белков. Белки играют большую роль в формировании всех клеточных структур.
Белки – это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
Некоторые из них (коллаген соединительной ткани, кератин волос, ногтей, эластин стенок кровеносных сосудов, фиброин шелка и др.) выполняют почти исключительно структурную функцию.
Кератин синтезируется кожей. Волосы и ногти – это производные кожи.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
6. Гормональная (регуляторная) функция
Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Интересно знать!
В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
7. Питательная (запасная) функция
Питательная функция осуществляется резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
8. Рецепторная (сигнальная) функция
Некоторые белки (белки-рецепторы), встроенные в клеточную мембрану, способны изменять свою структуру под воздействием внешней среды. Так происходит прием сигналов извне и передача информации в клетку.
Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином.
Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
9. Энергетическая функция
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке (после их гидролиза). Обычно белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров.
При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Белки
himija-online.ru
Белки и их функции | Спорт и Здоровье
Наиболее важными соединениями каждого организма являются белки. Они обязательно обнаруживаются во всех клетках организма, в большинстве из них на долю белка приходится более половины сухого остатка. Все основные проявления жизни связаны с белками.
Белки — высокомолекулярные азотсодержащие органические соединения, состоящие из остатков аминокислот. В составе некоторых белков наряду с аминокислотами обнаруживают и другие соединения.
Для живых организмов характерно большое разнообразие белков, которые составляют основу структуры организма и обеспечивают множество функций.
Несмотря на сложность строения и многообразие, все белки построены из сравнительно простых структурных элементов — аминокислот. Белки представляют собой полимерные молекулы, в состав которых входит 20 различных аминокислот. Изменение числа аминокислотных остатков и последовательности их расположения в молекуле белка обеспечивает возможность образования громадного количества белков, отличающихся своими физико-химическими свойствами, структурной или функциональной ролью в организме.
Классификация аминокислот. Большинство аминокислот, участвующих в обмене веществ, входящих в состав белков, могут поступать с пищей или синтезироваться в организме в процессе обмена (из других аминокислот, поступающих в избытке). Они получили название заменимых  аминокислот. Некоторые аминокислоты не могут синтезироваться в организме и должны поступать с пищей. Они получили название незаменимых.
аминокислот. Некоторые аминокислоты не могут синтезироваться в организме и должны поступать с пищей. Они получили название незаменимых.
Некоторые аминокислоты обнаружены в тканях организма, однако они не используются для построения белковых молекул (орнитин, цитруллин). Есть также аминокислоты (оксипролин и цистеин), которые образуются из других (пролин, цистин) после включения в состав белков.
Аминокислоты с разветвленной цепью. К аминокислотам с разветвленной цепью относятся три аминокислоты: валин, лейцин и изолейцин. Своё название аминокислоты с разветвленной цепью получили из-за структурных особенностей строения молекулы, что придает им ряд уникальных свойств. Помимо вхождения в структуру мышечной ткани (42% от общего количества незаменимых аминокислот) аминокислоты с разветвленной цепью играют первостепенную роль в обмене белков и снабжении мышц энергией. Основным источником энергии при интенсивных нагрузках служит гликоген печени и мышц, запасы которого быстро истощаются, и организм переходит к сжиганию свободных аминокислот — в первую очередь именно аминокислот с разветвленной цепью. В этом случае тренировка носит катаболический характер, то есть приводит не к росту, а к уменьшению мышц. Аминокислоты с разветвленной цепью активизируют обмен инсулина и стимулируют поступление других аминокислот в мышцы для последующего синтеза белка. Активация обмена инсулина приводит к улучшению работы пищеварительных ферментов 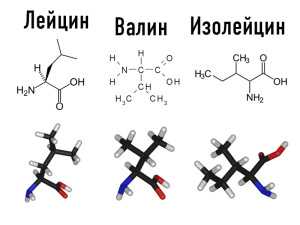 и метаболитов цикла Кребса (основного цикла обмена энергии в организме), способствующих восстановлению энергетического потенциала мышечных клеток. В мышцах аминокислоты с разветвленной цепью перерабатывают продукты обмена (молочную кислоту и др.) в аминокислоту аланин, которая участвует в образовании мышечного гликоген.
и метаболитов цикла Кребса (основного цикла обмена энергии в организме), способствующих восстановлению энергетического потенциала мышечных клеток. В мышцах аминокислоты с разветвленной цепью перерабатывают продукты обмена (молочную кислоту и др.) в аминокислоту аланин, которая участвует в образовании мышечного гликоген.
Биологические функции белков. С белками связано всё многообразие функций организма, но наиболее важными из них являются: каталитическая, защитная, транспортная, сократительная, структурная, гормональная и питательная.
Каталитическая функция белков осуществляется с помощью специфических белков-катализаторов — ферментов. При их участии увеличивается скорость различных реакций обмена веществ и энергии в организме.
Транспортная функция белков заключается в том, что при их участии происходит связывание и доставка (транспорт) различных веществ от одного органа к другому. Так, белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин. Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдаёт кислород, необходимый для обеспечения окислительных процессов в тканях. Другие белки крови связывают триглицериды, жирные кислоты, холестерин, кальций, некоторые гормоны, витамины и другие вещества и транспортируют их к месту использования или действия.
Защитную функцию выполняют специфические белки-антитела, образующиеся в организме. Они обеспечивают связывание и обезвреживание веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов. Защитную функцию выполняет белок плазмы крови фибриноген, участвуя в свёртывании крови и тем самым уменьшая кровопотери.
Сократительную функцию выполняют белки, в результате взаимодействия которых происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
Структурная функция белков заключается в том, что они составляют основу строения клетки; некоторые из них (коллаген соединительной ткани, кератин волос, ногтей и кожи, эластин сосудистой стенки) выполняют исключительно структурную функцию. В комплексе с липидами (преимущественно фосфолипидами) белки участвуют в построении мембран клеток и внутриклеточных образований.
Гормональную функцию выполняют белки-регуляторы обмена веществ. Они относятся к гормонам, которые образуются в железах внутренней секреции, некоторых органах и тканях организма.
Питательная функция осуществляется белками, которые являются резервными или питательными. Белки яйца обеспечивают рост и развитие плода, белки молока служат источником питания новорожденного.
Перечисленные функции белков являются наиболее важными, но ими не ограничивается значение белков для жизнедеятельности организма.
Биологическая ценность белков. По современным представлениям под биологической ценностью белков понимают, зависящую от аминокислотного состава и других структурных особенностей, степень задержки азота или эффективность его утилизации для поддержания азотистого баланса у человека. Иными словами, указанный критерий позволяет установить место тех или иных пищевых белков по степени сравнительной пользы для организма человека. Биологическая ценность белков зависит от следующих факторов:
Сбалансированный аминокислотный состав, в первую очередь по незаменимым аминокислотам. Для построения подавляющего большинства белков организма человека требуются все 20 аминокислот, причём в определённых соотношениях. Более того, важно не столько достаточное количество каждой из незаменимых аминокислот, сколько их соотношение, максимально приближённое к таковому в белках тела человека. Нарушение сбалансированности аминокислотного состава пищевого белка приводит к нарушению синтеза собственных белков, сдвигая динамическое равновесие белкового анаболизма и катаболизма в сторону преобладания распада собственных белков организма, в том числе белков-ферментов. Недостаток той или иной незаменимой аминокислоты, лимитирует использование других аминокислот в процессе биосинтеза белка. Значительный же избыток ведет к образованию высокотоксичных продуктов обмена неиспользованных для синтеза аминокислот.
Доступность отдельных аминокислот может снижаться при наличие в пищевых белках ингибиторов пищеварительных ферментов (присутствующих, например, в бобовых) или тепловом повреждении белков и аминокислот, при кулинарной обработке.
Степень усваиваемости белка отражает его расщепление в желудочно-кишечном тракте и последующее всасывание аминокислот. По скорости переваривания пищеварительными ферментами пищевые белки можно расположить в следующей последовательности:
— яичные и молочные;— мясные и рыбные;— растительные белки;
Биологическую ценность белков определяют путем сравнения аминокислотного состава изучаемого белка со справочной шкалой аминокислот идеального белка или аминограммами высококачественных стандартных белков. Этот методический прием получил название аминокислотного скора. Наиболее простым способом расчета аминокислотного скора является расчет отношения количества каждой незаменимой аминокислоты в испытуемом белке к количеству этой же аминокислоты в гипотетическом белке с идеальной аминокислотной шкалой по следующей формуле:
где АК — любая незаменимая аминокислота.
При этом принято, что аминокислотой, лимитирующей биологическую ценность белка, считается та, скор которой имеет наименьшее значение. В идеальном или стандартном белке аминокислотный скор каждой незаменимой аминокислоты принимают за 1,00, а в белках пищевых продуктов, обычно потребляемых человеком, значение скора для отдельных аминокислот могут быть существенно ниже.
Рассмотренные представления о биологической ценности белков необходимы для правильного выбора белковых добавок.
Белки куриных яиц. Цельный яичный белок имеет наивысшую усваиваемость и считается эталонным, относительно которого оцениваются все остальные белки. Как известно куриное яйцо состоит из белка, который практически на 100% состоит из альбумина (овоальбумина) и желтка, который содержит 7 различных белков — альбумин, овоглобулин, коальбумин, овомукоид, овомуцин, лизоцин, авидин. Для производства пищевых добавок используется как цельный яичный белок, так и отдельно яичный альбумин.
Также необходимо отметить, что употреблять в пищу большое количество сырых куриных яиц не рекомендуется, так как они содержат ингибитор пищеварительного фермента трипсина. Более того, белок авидин, содержащийся в желтке, присоединяет к себе жизненно важный биотин (витамин Н), образуя прочный комплекс, который не переваривается и не усваивается организмом. Поэтому рекомендуют употреблять куриные яйца только после термической обработки (при 70°С разрушается ингибитор трипсина, а при 80°С высвобождается активный биотин из биотин-авидинового комплекса).
Белки молочной сыворотки. Белки молочной сыворотки (лактальбумин, лактоглобулин и иммуноглобулин) имеют наивысшую скорость расщепления среди цельных белков. Концентрация аминокислот и пептидов в крови резко возрастает уже в течение первого часа после приема питания на основе белков молочной сыворотки. При этом не меняется кислотообразующая функция желудка, что исключает нарушение его работы и образование газов. Усваиваемость белков молочной сыворотки исключительно высока.Аминокислотный состав сывороточных белков наиболее близок к аминокислотному составу мышечной ткани человека, а по содержанию незаменимых аминокислот и аминокислот с разветвленной цепью (ВСАА): валина, лейцина и изолейцина, они превосходят все остальные белки животного и растительного происхождения. Кроме того, примерно 14% белков молочной сыворотки находится в виде продуктов гидролиза (аминокислот, ди-, три- и полипептидов), которые являются инициаторами пищеварения и участвуют в синтезе большинства жизненно важных ферментов и гормонов. Также белки молочной сыворотки заметно снижают уровень холестерина в крови.
Основным источником получения сывороточных белков является сладкая молочная сыворотка, образующаяся при производстве сычужных сыров. Сама по себе сладкая молочная сыворотка не находит применения при производстве пищевых добавок, что связано с низким содержанием белка (около 5 %) и наличием большого количества лактозы (молочного сахара) — основного вещества вызывающего непереносимость молочных продуктов некоторыми людьми. Технология получения так называемых концентратов сывороточных белков (КСБ — УФ) в нативной форме с содержанием белка 35%, 65% и 80%, основана на методе ультрафильтрации. В настоящее время в СНГ производится только 65%-й КСБ и только на Березовском сыродельном комбинате, расположенном в Республике Беларусь.
Впервые КСБ использовался в рационе питания велосипедистов (шоссейные гонки) сборной СССР при подготовке к Олимпиаде — 80 (все стали олимпийскими чемпионами). Отмечалось, что применение сывороточных белков ускоряло процесс адаптации спортсменов к неблагоприятным внешним условиям. В течение сезона 1985 — 86 гг. КСБ использовали в рационе питания футболистов команды мастеров киевского «Динамо», в период их подготовке к участию в Кубке Кубков, который они впоследствии триумфально завоевали. По отзывам руководства команды, футболистов, а также врача команды, пищевые добавки на основе КСБ «способствовали созданию высокого функционального уровня, эффективному удержанию его, профилактике заболеваемости и травматизма у спортсменов».
Практически аналогичные или более впечатляющие результаты были получены при использовании сывороточных белков в рационе питания людей, работающих в условиях сверхвысоких эмоционально-физических нагрузок (летчиков, космонавтов, подводников и др.). По заключению специалистов Института медико-биологических проблем «пищевые продукты, обогащенные КСБ обладают уникальной пищевой и биологической ценностью, а включение подобных продуктов в рацион питания способствует повышению резистентности организма к неблагоприятным внешним воздействиям, повышают работоспособность и психологическую устойчивость».
Экспериментальным путем установлено, что содержание белка в пищевых добавках на основе белков молочной сыворотки оптимально на уровне 60-65%.
Казеин. Как правило, казеин вводится в смеси для детского питания, что по современным представлениям считается биологически оправданным. Так при попадании в желудок казеин створаживается, превращаясь в сгусток, который переваривается продолжительное время, обеспечивая сравнительно низкий темп расщепления белка. Это приводит к стабильному и равномерному поступлению аминокислот в организм интенсивно растущего ребенка. При нарушении этого ритма усваивания (применение смесей на основе белков молочной сыворотки) приводит к тому, что организм ребенка на этом этапе развития не успевает усваивать интенсивный поток аминокислот, что может приводить к различного рода отклонениям в развитии ребенка. Поэтому диетологи рекомендуют для грудных детей применять смеси на основе казеина.Что же касается взрослого человека, то низкая усваиваемость, а также медленное прохождение сгустков казеина по желудочно-кишечному тракту неприемлемы, особенно при повышенных физических нагрузках. Поэтому пищевые добавки созданные на основе казеина и казеинатов, по всей вероятности, малоэффективны.Однако выход из положения может быть найден за счет использования белковых композиций на основе казеина и сывороточных белков. После научных исследований был определен максимальный коэффициент эффективности белка и соответствующие ему пропорции сывороточных белков и казеина. Этой пропорцией оказалось соотношение 63:37 при коэффициенте эффективности белка 3,49. Полученное значение биологической ценности для данного соотношения белков оказалось очень высоким и, судя по данным литературы, не уступающим таковым для других высокоценных белков животного происхождения.Что касается усваиваемости, то по мере увеличения содержания сывороточных белков она постепенно возрастала, это подтверждает известный факт лучшей перевариваемости сывороточных белков пищеварительными ферментами по сравнению с казеином.
Соевые белки. Соевый белок хорошо сбалансирован по аминокислотам, в том числе по незаменимым. После потребления соевых белков появляется четкое снижение уровня холестерина в крови, поэтому их целесообразно использовать в рационе людей с избыточным весом, а также людей страдающих непереносимостью молочных продуктов.Однако главный недостаток соевого белка — наличие ингибитора пищеварительного фермента трипсина. Его количество зависит от технологии переработки соевых бобов. Для избавления от ингибитора нужна дополнительная обработка белка с помощью ферментативного гидролиза (пятидесятиминутный электрофорез панкреатином). Также существуют данные, что соевый белок оказывает повреждающее действие на стенки тонкой кишки. Все это значительно ограничивает применение соевого белка в пищевых добавках.
Растительные белки. В настоящее время уже неопровержимо доказано, что растительные белки, даже содержащие необходимый набор аминокислот усваиваются очень плохо. Плохое усвоение растительного белка вызвано несколькими причинами:— Толстые оболочки клеток растительных белков, часто не поддающиеся действию пищеварительных соков;— Наличие ингибиторов пищеварительных ферментов в некоторых растениях, например, в бобовых;— Трудности расщепления растительных белков до аминокислот;
Рыбный белок. Предполагалось использование изолятов рыбного белка в питании спортсменов. Исследования проводились в НИИ Гигиены Питания г.Киева. Сравнивалась перевариваемость рыбного изолята, свежей рыбы и казеина. Было установлено, что изолят рыбного белка еще значительно медленнее, чем казеин расщепляется до аминокислот. Расщепление изолята до пептидов не прекращалось даже через 3 часа с момента введения белка.
Расчет дневной потребности в белке.Количество потребляемого белка зависит от интенсивности тренировок и может рассчитываться по формуле:
дневная потребность в белке (в г) = сухая масса тела (в кг) * фактор интенсивности,где факторы интенсивности:
1.4 — умеренные атлетические тренировки 3 раза в неделю;1.6 — ежедневные умеренные атлетические или аэробные тренировки;1.8 — ежедневные интенсивные атлетические тренировки;2.0 — предсоревновательная подготовка;
Например для спортсмена весом 80 кг имеющего 10% жира (сухая масса тела равна 72 кг) и тренирующегося 3 (три) раза в неделю (фактор интенсивности равен 1,4) дневная потребность в белке составляет: 72 * 1,4 = 101 г.
Источник: Каталог спортивного питания, одежды и аксессуаров. Федерация Бодибилдинга и Фитнеса России (ФБФР).
Вконтакте
Google+
Одноклассники
Мой мир
на Ваш сайт.
sportizdorovie.ru