Формула карбоната калия. Карбонаты формула
Формула карбоната кальция в химии
Определение и формула карбоната кальция

Формула –
Молярная масса равна г/моль.
Физические свойства – белые кристаллы, находится в различных минералах (кальцит – тригональный, арагонит – ромбический).
Практически не растворяется в воде. Произведение растворимости
Является главной составной частью известняка, мрамора, мела.
Плавится без разложения под избыточным давлением углекислого газа.
Химические свойства карбоната кальция
Получение
Карбонат кальция добывается их полезных ископаемых. Чистый , необходимый для пищевой или фармацевтической промышленности, можно получить из мрамора. Альтернативный способ получения основывается на процессе кальцинации . При этом можно записать химические превращения сопровождающие его:
Применение
В пищевой промышленности карбонат кальция применяется в качестве белого пищевого красителя . Поскольку он входит в состав мела, то применяется для письма. Используется для побелки потолков, покраски стволов деревьев. Также данное вещество находит применение при производстве красок, резины, бытовой химии (зубной пасты), в строительстве (шпаклевки, герметики). Его используют как отбеливающее средство. Можно с уверенностью сказать, что одними из массовых потребителей карбоната кальция являются производители пластмассы, которые используют его в качестве наполнителя и красителя. Еще одна отрасль применения – его использование в очистительных системах.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Формула Карбоната кальция структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: CCaO3
Химический состав Карбоната кальция
| C | Углерод | 12,011 | 1 | 12% |
| Ca | Кальций | 40,08 | 1 | 40% |
| O | Кислород | 15,999 | 3 | 48% |
Молекулярная масса: 100,088
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула — CaCO3. В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц. Нерастворим в воде и этаноле. Зарегистрирован как белый пищевой краситель (E170).
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Очищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и в медицинской промышленности. В пищевой промышленности часто используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей. Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т. п. Карбонат кальция составляет порядка 20 % красящего пигмента, используемого при производстве красок.
Строительство
Строительство — ещё один из основных потребителей карбоната кальция. Шпатлевки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви. Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
Нахождение в природе
Карбонат кальция находится в минералах в виде полиморфов:
- Арагонит
- Кальцит
- Фатерит (или μ-CaCO3)
- Мел
- Известняк
- Мрамор
- Травертин
Геология
Карбонат кальция является распространенным минералом. В природе встречаются три полиморфные модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит). Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с некоторыми примесями. Кальцит является стабильным полиморфом карбоната кальция и встречается в самом разнообразном геологическом окружении: в осадочных, метаморфических и магматических горных породах. Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является вторым по устойчивости полиморфом CaCO3 и в-основном образуется в раковинах моллюсков и скелетах некоторых других организмов. Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках. Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Изготовление
Подавляющее большинство карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из чистого источника (как правило, мрамор). В качестве альтернативы карбонат кальция может быть приготовлен кальцинацией оксида кальция. Вода добавляется к этому оксиду, давая гидроксид кальция, и затем проводится углекислый газ, который проходит через этот раствор для осаждения желаемого карбоната кальция: CaO + h3O → Ca(OH)2 Ca(OH)2 + CO2 → CaCO3 + h3O
Химические свойства
При нагревании до 900−1000 °C расщепляется на кислотный оксид — углекислый газ CO2 и оксид — негашёную известь CaO по уравнению: CaCO3 → CaO + CO2. В воде с углекислым газом растворяется, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2: CaCO3 + CO2 + h3O → Ca(HCO3)2. Существование именно этой реакции дает возможность образовываться сталактитам, сталагмитам и прочим красивейшим формам, да и вообще развиваться карсту. При 1500 °C вместе с углеродом образует карбид кальция и оксид углерода (II) CaCO3 + 4C → CaC2 + 3CO.
formula-info.ru
Карбонат кальция, фомула, получение, применение, температурные показатели
Характеристика карбонат кальция
 Кальция карбонат представляет собой твердые белые кристаллы без запаха и вкуса нерастворимые в воде, этаноле и легко растворимые в кислотах с выделением углекислого газа. Это неорганическое химическое соединение, соль угольной кислоты и кальция. В природе встречается в виде минералов, различающиеся кристаллической структурой - широко распространённый кальцит, арагонит и ватерит, является главной составной частью известняка, мела и мрамора, одно из самых распространенных на Земле соединений.
Кальция карбонат представляет собой твердые белые кристаллы без запаха и вкуса нерастворимые в воде, этаноле и легко растворимые в кислотах с выделением углекислого газа. Это неорганическое химическое соединение, соль угольной кислоты и кальция. В природе встречается в виде минералов, различающиеся кристаллической структурой - широко распространённый кальцит, арагонит и ватерит, является главной составной частью известняка, мела и мрамора, одно из самых распространенных на Земле соединений.
Плотность карбоната кальция
Плотность (кальцит) 2,74 г/см³, (арагонит) 2,83 г/см³.
Температура плавления карбонат кальция
Температура плавления (кальцит) 825° C, (арагонит) 1339° C,
Температура разложения карбоната кальция
Температура разложения 900-1000° C.
Формула карбоната кальция
Химическая формула: CaCO3.
Получение карбоната кальция
Кальция карбонат получают взаимодействием известкового молока с углекислотой или хлоридом кальция (СаСl2) с карбонатом натрия (Na2CO3) в водном растворе.
Применение карбоната кальция
Кальция карбонат (углекислый кальций, мел, кальциевая соль угольной кислоты) применяется:
- в лакокрасочной промышленности, в производстве красок и отделочных материалов;
- в химической промышленности при производстве карбида кальция;
- в стекольной промышленности при изготовлении стекла;
- в строительстве при производстве шпатлевок, различных герметиков и др.;
- в сельском хозяйстве, как известковое удобрение и для комплексного агрохимического окультуривания полей;
- в качестве наполнителя для резиновых смесей, бумаги, линолеума;
- в медицине как антацидное, противоязвенное, восполняющее дефицит кальция средство;
- в косметической промышленности при производстве зубного порошка, как наполнитель косметических средств;
- в пишевой промышленности, как пищевая добавка краситель E170.
Таблица 1. Физико-химические показатели карбоната кальция
| Содержание хлоридов, %, не более | 0,033 |
| Содержание cульфатов, %, не более | 0,25 |
| Содержание мышьяка (As), %, не более | 0,0001 |
| Содержание бария (Ba), %, не более | 0,0001 |
| Содержание железа (Fe), %, не более | 0,01 |
| Содержание фтора (F), %, не более | 0,005 |
| Содержание ртути (Hg), %, не более | 0,00005 |
| Содержание свинца (Pb), %, не более | 0,0003 |
| Содержание тяжелых металлов, %, не более | 0,002 |
Электрические свойства наполнителей на основе карбоната кальция (2 таблицы):
Таблица 2.
| кальцит в направлении, перпендикулярном оптической оси | 8,5 |
| кальцит в направлении параллельном оптической оси | 8,0 |
| доломит, в направлении, перпендикулярном оптической оси | 8,0 |
| доломит, в направлении параллельном оптической оси | 6,8 |
Таблица 3.
| объемное, Ом·см | 109-1011 |
| поверхностное при 50%-ной отн. влажности, Ом | (3-8)·109 |
| поверхностное при 90%-ной отн. влажности, Ом | (1-3)·107 |
| кальцит (CaCO3) | 17 000-25 000 |
| доломит (CaCO3·MgCO3) | 3 000-5 000 |
| pH кальцита | 9,0-9,5 |
| pH доломита | 9-10 |
| Удельное объемное электрическое сопротивление ПВХ композиции электроизоляционного назначения при 50°C, Ом·см | >4·1014 |
Таблица 4. Физические свойства различных типов карбонатов.
| Плотность, кг/м3 | 2600 - 2750 | 2920 - 2940 | 2800 - 2900 | 3000 - 3100 |
| Твердость по Мосу | 3,0 | 3,5 - 4,0 | 3,5 - 4,0 | 3,5 - 4,5 |
| Содержание растворимых фракций | 0,99·10-8 (при 15°C)0,87·10-8 (при 25°C) | - | - | 2,6·10-5 (при 12°C) |
| Растворимость при 18°С | ||||
| г/100 г воды | 0,0013 | 0,0019 | 0,032 | 0,0106 |
| г/100 г водного раствора СО2 | 0,13 | 0,19 | 3,2 | 1,06 |
| Температура разложения, °C | 900 | 825, переходит в кальцит при Т>400°C | 730-760 | 350 |
| Природные источники | Известняк, мрамор, известковый шпат, яичная скорлупа, кости (с примесью фосфата кальция), горные породы (в сочетании с доломитом) | Панцири моллюсков, кораллы.Образуется при Т>30°C; переходит в кальцит при Т>400°C и Т<30°C | - | - |
lkmprom.ru
Карбонат кальция: свойства и все характеристики
Характеристики и физические свойства карбоната кальция
Практически не растворяется в воде.

Рис. 1. Карбонат кальция. Внешний вид.
Основные характеристики карбоната кальция приведены в таблице ниже:
|
Молекулярная формула |
CaCO3 |
|
Молярная масса, г/моль |
100 |
|
Плотность, г/см3 |
2,74 – 2,83 |
|
Температура плавления, oС |
825 |
|
Температура разложения, oС |
900 – 1000 |
|
Растворимость в воде (25oС), г/100 мл |
0,0015 |
Получение карбоната кальция
Основной способ получения карбоната кальция заключается в смешивании твердого оксида кальция с водой — образуется так называемое известковое молоко. Так как гидроксид кальция немного растворяется в воде, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода.
CaO + h3O = Ca(OH)2;
Ca(OH)2 + CO2 = CaCO3↓.
Химические свойства карбоната кальция
Карбонат кальция — это средняя соль, образованная сильным основанием (гидроксид кальция Ca(OH)2) и слабой кислотой (угольная h3CO3). В водном растворе он гидролизуется. Гидролиз протекает по аниону. Наличие анионов OH— свидетельствует о щелочном характере среды.
CaCO3↔ Ca2+ +CO32-;
Ca2+ +CO32- + HOH ↔ HCO3— + Ca2+ + OH—;
CaCO3 + HOH ↔ Ca(HCO3)2 + Ca(OH)2↓.
Карбонат кальция взаимодействует с концентрированными растворами сильных минеральных кислот:
CaCO3 + 2HClconc = CaCl2 + CO2↑ + h3O.
Он способен реагировать с щелочами в водных растворах:
CaCO3 + 2NaOHaq = Na2CO3 + Ca(OH)2↓.
Взаимодействие карбоната кальция с другими солями возможно только если продукт взаимодействия выводится из реакционной среды:
CaCO3 + 2Nh5Clcon = CaCl2 + 2Nh4↑ + CO2↑ + h3O.
При нагревании данная соль разлагается:
CaCO3 = CaO + CO2↑ (t,oС = 900 — 1000).
Пропускание диоксида углерода через раствор карбоната кальция приводит к образованию кислой соли – гидрокарбоната кальция:
CaCO3 + CO2 + h3O ↔Ca(HCO3)2.
Применение карбоната кальция
Карбонат кальция нашел широкое применение в различных отраслях промышленности. Так, например, его используют в пищевой (добавка Е710 – белый краситель) и бумажной промышленности, при производстве полимеров, лакокрасочных материалов, бытовой химии и т.д.
Примеры решения задач
ru.solverbook.com
Формула карбоната калия в химии
Определение и формула карбоната калия
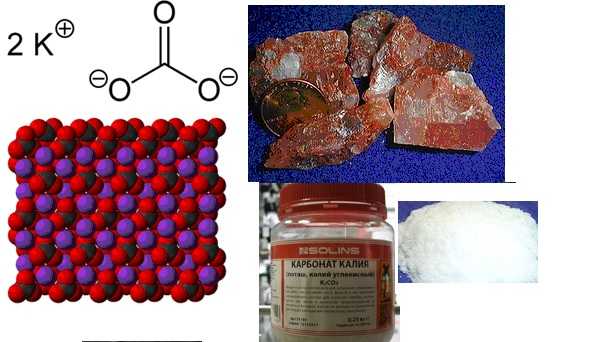
Формула –
Молярная масса равна г/моль.
Физические свойства – соль белого цвета растворимая в воде, но не растворимая в этиловом спирте, образует растворы с сильно щелочной реакцией.
Плавится без разложения, при более глубоком нагревании разлагается.
Очень хорошо растворяется в воде (сильный гидролиз по аниону):
Карбонат калия является основным компонентом калийных удобрений. Исторически сложилось так, что карбонат калия получали при спекании поташа из золы растений в печи для удаления примесей. Мелкий белый оставшийся порошок являлся поташем. Первый патент, выданный патентным ведомством США был присужден Сэмюэлю Хопкинсу в 1790 году для улучшенного способа изготовления поташа из золы растений и карбоната калия.
В конце 18-го века в Северной Америке, до развития разрыхлителей, поташ использовался в качестве разрыхлителя в быстрых хлебах.
Химические свойства карбоната калия
Получение
В настоящее время, карбонат калия получают в промышленных масштабах путем электролиза хлорида калия. Полученный гидроксид калия приводят во взаимодействие с диоксидом углерода с образованием карбоната калия, который часто используется для получения других соединений калия:
Применение
Исторически карбонат калия использовался для производства мыла, стекла, фарфора. В качестве мягкого сушильного агента, где другие влагопоглощающие вещества, такие как хлорид кальция и сульфат магния, нельзя применить. Он не подходит для кислотных соединений, но может быть полезен для сушки органической фазы, если есть небольшое количество кислотных примесей. Он также может быть использован для сушки некоторых кетонов, спиртов и аминов перед перегонкой.
Используется в производстве порошка какао, чтобы сбалансировать натуральных какао-бобов (это также помогает улучшить аромат).
Примеры решения задач
ru.solverbook.com
формула, цена, что это такое, инструкция по применению на Medside.ru
Читайте нас и будьте здоровы! Пользовательское соглашение о портале обратная связь- Врачи
- Болезни
- Кишечные инфекции (4)
- Инфекционные и паразитарные болезни (20)
- Инфекции, передающиеся половым путем (6)
- Вирусные инфекции ЦНС (2)
- Вирусные поражения кожи (5)
- Микозы (9)
- Гельминтозы (3)
- Злокачественные новообразования (8)
- Доброкачественные новообразования (4)
- Болезни крови и кроветворных органов (3)
- Болезни щитовидной железы (5)
- Болезни эндокринной системы (12)
- Недостаточности питания (1)
- Психические расстройства (26)
- Воспалительные болезни ЦНС (2)
- Болезни нервной системы (17)
- Двигательные нарушения (4)
- Болезни глаза (16)
- Болезни уха (3)
- Болезни системы кровообращения (8)
- Болезни сердца (4)
- Цереброваскулярные болезни (2)
- Болезни артерий, артериол и капилляров (7)
- Болезни вен, сосудов и лимф. узлов (6)
- Болезни органов дыхания (17)
- Болезни полости рта и челюстей (13)
- Болезни органов пищеварения (25)
- Болезни печени (1)
- Болезни желчного пузыря (5)
- Болезни кожи (27)
- Болезни костно-мышечной системы (30)
- Болезни мочеполовой системы (10)
- Болезни мужских половых органов (8)
- Болезни молочной железы (3)
- Болезни женских половых органов (26)
- Беременность и роды (5)
- Болезни плода и новорожденного (3)
- Врожденные аномалии (пороки развития) (10)
- Травмы и отравления (8)
- Симптомы
- Амнезия (потеря памяти)
- Анальный зуд
- Апатия
- Афазия
- Афония
- Ацетон в моче
- Бели (выделения из влагалища)
- Белый налет на языке
- Боль в глазах
- Боль в колене
- Боль в левом подреберье
- Боль в области копчика
- Боль при половом акте
- Вздутие живота
- Волдыри
- Воспаленные гланды
- Выделения из молочных желез
- Выделения с запахом рыбы
- Вялость
- Галлюцинации
- Гнойники на коже (Пустула)
- Головокружение
- Горечь во рту
- Депигментация кожи
- Дизартрия
- Диспепсия (Несварение)
- Дисплазия
- Дисфагия (Нарушение глотания)
- Дисфония
- Дисфория
- Жажда
- Жар
- Желтая кожа
- Желтые выделения у женщин
- ...
- ПОЛНЫЙ СПИСОК СИМПТОМОВ>
- Лекарства
- Антибиотики (211)
- Антисептики (122)
- Биологически активные добавки (210)
- Витамины (192)
- Гинекологические (183)
- Гормональные (156)
- Дерматологические (258)
- Диабетические (46)
- Для глаз (124)
- Для крови (77)
- Для нервной системы (385)
- Для печени (69)
- Для повышения потенции (24)
- Для полости рта (68)
- Для похудения (40)
- Для суставов (161)
- Для ушей (14)
- Другие (306)
- Желудочно-кишечные (314)
- Кардиологические (149)
- Контрацептивы (48)
- Мочегонные (32)
- Обезболивающие (280)
- От аллергии (102)
- От кашля (137)
- От насморка (91)
- Повышение иммунитета (123)
- Противовирусные (114)
- Противогрибковые (126)
- Противомикробные (144)
- Противоопухолевые (65)
- Противопаразитарные (49)
- Противопростудные (90)
- Сердечно-сосудистые (351)
- Урологические (89)
- ДЕЙСТВУЮЩИЕ ВЕЩЕСТВА
- Справочник
- Аллергология (4)
- Анализы и диагностика (6)
- Беременность (25)
- Витамины (15)
- Вредные привычки (4)
- Геронтология (Старение) (4)
- Дерматология (3)
- Дети (15)
- Другие статьи (22)
- Женское здоровье (4)
- Инфекция (1)
- Контрацепция (11)
- Косметология (23)
- Народная медицина (17)
- Обзоры заболеваний (27)
- Обзоры лекарств (34)
- Ортопедия и травматология (4)
- Питание (53)
- Пластическая хирургия (8)
- Процедуры и операции (23)
- Психология (10)
- Роды и послеродовый период (35)
- Сексология (9)
- Стоматология (9)
- Травы и продукты (13)
- Трихология (7)
- Слов
medside.ru
Карбонат кальция - это... Что такое Карбонат кальция?
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула — . В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Таблетки из карбоната кальцияОчищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и в медицинской промышленности. В пищевой промышленности часто используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т. п. Карбонат кальция составляет порядка 20 % красящего пигмента, используемого при производстве красок.
Строительство
Строительство — еще один из основных потребителей карбоната кальция. Шпатлевки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
Нахождение в природе

Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Геология
Карбонат часто встречается в геологической среде. Он находится как полиморф. Полиморфами являются минералы с той же химической формулой, но разной химической структуры. Арагонит, кальцит, известняк, мел, мрамор, травертин, туф и др. — все они имеют формулу CaCO3, но каждый из них имеет несколько иной химический состав. Кальцит, как карбонат кальция, геологи обычно находят в морских условиях. Также кальцит, как правило, находится около теплых тропических условий. Это связано с его химией и свойствами. Кальцит может выпадать чаще как осадок в теплой среде, чем в холодной, поскольку теплая среда не дает улетучиваться в больших объемах CO2. Это аналогично тому как CO2 растворяется в воде. Когда вы открываете крышку пластиковой бутылки происходит выделение CO2. Из-за того что сода нагревается, выделяется углекислый газ. Этот же принцип может быть применен к кальциту и в океане. Карбонаты данного вещества в холодной воде существуют в более высоких широтах, но имеют очень медленный темп роста.
В тропических условиях вода теплая и чистая. Таким образом, вы можете увидеть много кораллов в данной среде по сравнению с холодной, где вода холодная. Производители карбоната кальция, такие как кораллы, водоросли и микроорганизмы, которые обычно встречаются в мелководных водоемах, как фильтраторы, требуют солнечный свет для производства карбоната кальция.
Изготовление
Подавляющее большинство карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из чистого источника (как правило, мрамор).
В качестве альтернативы карбонат кальция может быть приготовлен кальцинацией оксида кальция. Вода добавляется к этому оксиду, давая гидроксид кальция, и затем проводится углекислый газ, который проходит через этот раствор для осаждения желаемого карбоната кальция[1]:
Химические свойства
При нагревании до 900−1000 °C расщепляется на кислотный оксид — углекислый газ CO2 и оксид — негашёную известь CaO по уравнению:
.В воде с углекислым газом растворяется, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
.Существование именно этой реакции дает возможность образовываться сталактитам, сталагмитам и прочим красивейшим формам, да и вообще развиваться карсту.
При 1500 °C вместе с углеродом образует карбид кальция и оксид углерода (II)
.Примечания
Ссылки
Шаблон:АТХ код A02
dic.academic.ru











