Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества. Как определить эквивалентную массу металла
3. Эквивалент. Закон эквивалентов. Эквивалентная масса. Эквивалентный объём
Выше уже говорилось, что простые вещества (или химические соединения), вступающие в химические реакции друг с другом, а также продукты реакций находятся в строго определенных количественных соотношениях. Следствием этого факта было введение в научный и практический обиход понятия эквивалент.
Эквивалентом химического элемента (или молем эквивалентов) называется такое его количество, которое может заместить или присоединить к себе в химических реакциях 1моль атомов водорода или любого другого химического элемента, эквивалент которого известен.
В соединениях НС1, h3S, Nh4, Ch5 эквиваленты хлора, серы, азота и углерода равны 1 молю, 1/2 моля, 1/3 моля и 1/4 моля, соответственно.
Эквивалент (или моль эквивалентов) сложного вещества - это такое его количество, которое взаимодействует без остатка с одним эквивалентом атомов водорода или с одним эквивалентом любого другого вещества.
Масса одного эквивалента (или моля эквивалентов) химического элемента или вещества называется их эквивалентной массой (или молярной массой эквивалентов).
Единицей измерения эквивалентной массы служит г/моль.
Эквивалентная масса химического элемента Мэ равна отношению мольной массы атомов МА к его валентности В:
.
Так, эквивалентные массы хлора, серы, азота и углерода в приведенных выше соединениях равны 34,45 г/моль, (32/2 = 16) г/моль, (14/3 = 4,67) г/моль и (12/4 = 3) г/моль.
Способ определения эквивалентной массы сложных соединений зависит от их класса. Так, эквивалентная масса Мэк кислоты равна ее мольной массе Мк, деленной на основность О (число ионов водорода Н+, которое кислота отдает в реакции с основанием: основность НС1 равна 1, h3SO4 - 2, Н3РО4 - 3):
.
Эквивалентная масса Мэо основания равна его мольной массе М, отнесенной к валентности металла ВМе:
.
И наконец, эквивалентная масса Mэc соли определяется как отношение ее мольной массы Мс к произведению валентности металла ВМе на число k его атомов в молекуле:
.
Многие элементы, соединяясь друг с другом, могут образовывать по несколько соединений (например, СО и СО2). Отсюда следует, что эквивалент химического элемента и его эквивалентная масса могут различаться в зависимости от того, какое соединение было взято для их определения. Так, в случае приведенных выше моно- и диоксида углерода эквивалентные массы углерода равны, соответственно, (12/2 = 6) г/моль и (12/4 = 3) г/моль, поскольку мольная масса атомов углерода равна 12 г/моль, а его валентность равна 2 в случае монооксида углерода и 4 - в случае диоксида.
Кроме понятия эквивалентной массы, широко пользуются также понятием эквивалентного объема, под которым понимают объем, который занимает 1 эквивалент рассматриваемого газообразного вещества. Единицей измерения эквивалентного объема является л/моль. Поскольку 1 эквивалент водорода (атомарного) составляет половину 1 моля молекулярного водорода, становится понятно, что эквивалентный объем водорода при нормальных условиях равен половине мольного объема, т. е. 11,2 л/моль. Соответственно, эквивалентный объем кислорода равен 5,6 л/моль, так как эквивалент кислорода равен 1/4 моля, т. е. в 2 раза меньше эквивалента водорода.
Изучение количественных закономерностей химических реакций привело к установлению закона эквивалентов.
Массы m1 и m2 (или объемы V1 и V2) реагирующих друг с другом веществ пропорциональны их эквивалентным массам МЭ1 и МЭ2 (объемам VЭ1, и VЭ2):
.
Из этого уравнения легко получается соотношение:
.
где v1, и v2 — количества эквивалентов реагентов.
Таким образом, количества эквивалентов реагирующих без остатка веществ равны между собой.
Пример 3.1. Чему равна эквивалентная масса металла, если при взаимодействии 3 г его оксида с серной кислотой образовалось 9 г сульфата?
Решение:
Составим уравнение реакции и для наглядности проставим под формулами оксида и сульфата их массы:
МеО + h3SO4 = MeSO4 + Н2О
Эквивалентная масса металла равна отношению его мольной массы ММе к валентности. Записав формулу оксида в виде МеО, мы тем самым определили, что валентность металла равна 2. Нам остается найти мольную массу металла. Для этого составим пропорцию:
3 г оксида так относится к 9 г сульфата, как
мольная масса оксида относится к мольной массе сульфата
(ММс + 16) г/моль (Мме + 96) г/моль
Из этой пропорции получаем следующее равенство:
(ММе + 16)*9 = (ММе + 96)*3.
Откуда находим, что ММе=24 г/моль.
Деля эту величину на найденную валентность, находим, что эквивалентная масса металла Мэ = 12 г/моль.
Ответ: Мэ = 12 г/моль.
Пример 3.2. При взаимодействии с водой некоторого количества металла с эквивалентной массой, равной 19,55 г/моль, выделилось 3 л водорода. Определить массу металла.
Решение:
Поскольку эквивалентный объем водорода известен (11,2 л/моль), составим пропорцию:
19,55 г/моль металла эквивалентны 11,2 л/моль водорода
х г металла эквивалентны 3 л водорода
Откуда: г.
Ответ: Масса металла равна 5,24 г
Задачи
3.2. Определить эквивалентные массы металла и серы, если 3,24 г металла образует 3,48 г оксида и 3,72 г сульфида.
3.3. Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34 г металла окисляются при нормальных условиях 0,680 л кислорода.
3.4. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
3.5. 1,60 г кальция и 2,61 г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
3.6. На нейтрализацию 2,45 г кислоты идет 2,00 г гидроксида натрия. Определить эквивалентную массу кислоты.
3.7. Сколько эквивалентных масс содержится в молярной массе ортофосфорной кислоты?
3.8. Найти отношение между эквивалентными массами серы в следующих ее соединениях:
1) SO2;
2) SO3;
3) h3S;
4) h3SО4.
3.9. Определить эквивалент серы в ее оксидах, содержащих 40 и 50 % серы.
3.10. На нейтрализацию 2,45 г кислоты израсходовано 2 г гидроксида натрия. Определить эквивалентную массу кислоты.
3.11. 1 г четырехвалентного элемента соединяется с 0,27 г кислорода. Определить, какой это элемент.
3.12. При сгорании 10,8 г металла расходуется 6,72 л кислорода при нормальных условиях. Определить эквивалентную массу металла.
3.13. Одно и то же количество металла соединяется с 4.8 г кислорода и с 48 г одного из галогенов. Какой это галоген?
3.14. При сгорании 5,4 г трехвалентного металла образовалось 10,2 г оксида. Какой взят металл?
3.15. 2,71 г хлорида трехвалентного металла взаимодействуют с 2 г гидроксида натрия. Назвать металл, входящий в состав соли.
3.16. Для растворения 5,4 г металла потребовалось 29,4 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося при нормальных условиях водорода.
3.17. Определить валентность железа в хлоридах, если в одном содержится 34,5 % железа, а в другом - 44.1 %.
3.18. Одно и то же количество металла соединяется с 1 г кислорода и с 2 г другого элемента. Определить эквивалент этого элемента.
3.19. Определить эквивалент металла в следующих соединениях:
1) Mn2O7;
2) Mg2P2O7;
3) CrO3;
4) Ва(ОН)2;
5) Са3(РО4)2.
3.20. При нагревании 5 г металла получено 5,4 г оксида. Определить эквивалент металла.
3.21. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите молярную массу эквивалента металла.
3.22. В какой массе Сa(OH)2 содержится столько же эквивалентных масс, сколько в 312 г Al(OH)3?
3.23. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействуют с 310 см3 кислорода при нормальных условиях?
3.24. При взаимодействии 3,24 г трёхвалентного металла с кислородом выделилось 4,03 л водорода при нормальных условиях. Вычислить молярную массу эквивалента, молярную и относительную массы металла.
3.25. Из 3,31 г нитрата металла получено 2,78 г его хлорида. Вычислите молярную массу эквивалента этого металла.
studfiles.net
Определение эквивалента и эквивалентной массы металла по водороду
Цель работы: практически, опытным путем научиться определять эквивалент и эквивалентную массу металла по объему газа, выделенного в ходе реакции. Научиться проводить различные рациональные расчеты с использованием закона эквивалентов.
Теоретическая часть.
Из закона постоянства состава, кратных и объемных отношений следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях, которые называют эквивалентами или эквивалентными массами.
Для определения эквивалентов и эквивалентных масс нужно знать, что такое моль и мольная масса.
Моль- это количество вещества, в котором содержится число частиц любого определяемого сорта, равное постоянной Авогадро (6,02 .1023). Например: 3 .1024 молекул воды составят 5 моль.
Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.). Масса 1 моля вещества выражается в г/моль. Например: молярная масса Н2О и атомная масса кислорода соответственно равны 18 и 16 а.е.м., их мольные массы равны 18 г/моль и 16 г/моль. Эквивалентом элемента называется такое его количество, которое соединяется 1с молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединениях НВг, Н2О, РН3 эквиваленты брома, кислорода, фосфора соответственно равны 1 моль, 1/2 моль, 1/3 моль.
Масса одного эквивалента называется его эквивалентной массой. Так, в приведенных выше примерах, эквивалентные массы брома, кислорода, фосфора соответственно равны 79,9 г/моль, 16:2 = 8 г/моль, 31:3= 10,3 г/моль.
Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества. Расчеты, связанные с определением эквивалентных масс, проводятся по закону эквивалентов: массы (объемы) реагирующих друг с другом веществ, пропорциональны их эквивалентным массам (объемам). Математически закон выражается зависимостью:
(1)
где: m, (V) - массы (объемы) реагирующих веществ;
Э, (Vэкв.) - эквивалентные массы (объемы).
Эквивалентную массу простого вещества можно вычислить по формуле:
где - мольная масса атома элемента,
В - валентность элемента.
Так, например, эквивалентные массы водорода и кислорода соответственно равны:
Эквивалентный объем газа можно вычислить по формуле:
Так, например, эквивалентные объемы водорода и кислорода соответственно равны:
Эквивалентные массы сложных веществ можно вычислить по формулам:
(2)
nO, nOH, nH, nMe– число атомов кислорода, гидроксильных групп, атомов водорода, металла соответственно в оксиде, основании, кислоте, соли; В – валентность, 8 – эквивалентная масса кислорода, 1 – эквивалентная масса водорода, 17 – эквивалентная масса гидроксильной группы.
В данной работе определение эквивалентной массы металла основано на измерении объема водорода, вытесненного активным металлом из разбавленной кислоты. Измеренный объем водорода при условиях опыта приводится к нормальным условиям:
Затем по формуле (1) определяют эквивалентную массу.
Рис.1.1
Прибор состоит из бюретки 1, соединенной резиновыми трубками с воронкой 2 и двухколенной пробиркой 3. Прибор смонтирован на штативе Бунзена.
Реактивы и посуда.
Прибор для определения эквивалента металла (рис.1.1), барометр, термометр, мерный цилиндр емкостью 10 мл, воронка, 10 % - ный раствор соляной кислоты, металлический магний.
Практическая часть
1. В одно колено пробирки 3 внесите магний, а в другое колено пробирки через воронку налейте около 12мл 10%- ного раствора соляной кислоты. Наденьте двухколенную пробирку на пробку, соединенную резиновой трубкой с бюреткой.
2. Необходимым условием протекания опыта является герметичность всей системы, поэтому проверьте прибор на герметичность. Для этого воронку 2 опустите или поднимите на 25-30 см и держите на одном уровне 1 -2 минуты. Если уровень воды в бюретке 1 не изменится за это время, то прибор герметичен. Если же уровень воды в бюретке будет снижаться или подниматься до уровня воды в воронке, то вращательными движениями добейтесь плотного прилегания всех пробок и снова проверьте герметичность прибора.
3. Убедившись в герметичности прибора, отметьте уровень воды в бюретке 1, а затем постепенно (первая порция кислоты должна быть небольшой во избежание бурного выделения газа) наклоните двухколенную пробирку так, чтобы кислота перелилась в колено с магнием.
4. По окончании реакции подождите 1 минуту, пока газ примет температуру помещения и измерьте объем водорода, вытесненного магнием. Для этого установите воронку на такой высоте, чтобы вода в воронке и бюретке была на одном уровне, то есть газ находился при атмосферном давлении. Деление бюретки, против которого установится уровень воды, будет соответствовать объему выделившегося водорода при условиях проведения опыта. ( Если в начале опыта уровень воды находился не на нулевой отметке, то из конечного показания уровня воды надо вычесть число, соответствующее начальному уровню воды). В таблицу 1.1 запишите значения указанных в ней величин.
Таблица 1.1 Параметры для расчета эквивалента металла.
| m, г | P, Па | Т, К | V , мл | Р0, Па | Т0, К | V0, мл | h, Па |
Определите давление Р по барометру и температуру Т по термометру.
Давление насыщенного водяного пара h, соответствующее температуре опыта Т, выпишите из следующей таблицы:
Таблица 1.2 Давление насыщенного водяного пара при различных температурах
| Т, К | h, Па |
| 293 | 2300 |
| 294 | 2500 |
| 295 | 2700 |
| 296 | 2900 |
| 297 | 3100 |
| 298 | 3300 |
| 299 | 3500 |
| 300 | 3700 |
Р0 - давление при нормальных условиях, равное 101325 Па;
Т0 - температура при нормальных условиях, равная 273 К.
Расчет
Напишите уравнение реакции магния с соляной кислотой.
Измеренный объем водорода V приведите к нормальным условиям по уравнению Клапейрона (3):
Из математического выражения (1) закона эквивалентов определите эквивалентную массу магния:
Определите теоретическое значение эквивалентной массы магния по формуле:
где - мольная масса металла, В валентность металла.
Сравните полученное практическое значение эквивалентной массы Э магния с теоретическим значением Эт.
Рассчитайте процент относительной ошибки опыта по формуле:
Указания по технике безопасности
Необходимым условием протекания опыта является герметичность всей системы. Она в основном определяется тем, насколько плотно прилегают пробки к двухколенной пробирке и бюретке. При проверке герметичности прибора во избежание порезов рук стеклом, которые могут возникнуть при чрезмерном нажиме пробки на стекло, необходимо двухколенную пробирку, пробку и бюретку держать полотенцем.
Лабораторная работа №2
studfiles.net
ЭКВИВАЛЕНТНАЯ МАССА | Энциклопедия Кругосвет
Содержание статьиЭКВИВАЛЕНТНАЯ МАССА (химический эквивалент). Эквивалентная масса элемента - это масса 1 эквивалента элемента; эквивалентом элемента называют такое его количество, которое реагирует с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. При образовании соединений элементы взаимодействуют друг с другом в количествах, пропорциональных их эквивалентным массам или величинам, кратным этим массам. Для численного выражения эквивалентных масс необходим эталон; в качестве такого эталона приняты атомная масса водорода или ее эквивалент, например атомная масса хлора (Cl–), 1/2 атомной массы кислорода (O2–) или 1/3 атомной массы алюминия (Al3+). Таким образом, эквивалентная масса элемента равна его атомной массе, деленной на его валентность или степень окисления. В настоящее время атомные массы указывают в единицах, отнесенных к массе изотопа углерода с массовым числом 12; этому изотопу приписана масса 12,0000. Тогда атомная масса водорода будет равна 1,00797, хлора – 35,453, кислорода – 15,9994, алюминия – 26,9815. Следовательно, эквивалентная масса элемента – это масса, которая может химически соединяться или замещать в химическом соединении 1,00797 ч. (ч. – часть) водорода, 35,453 ч. хлора, 7,9997 (15,9994:2) ч. кислорода, 8,9938 (26,9815:3) ч. алюминия либо их эквиваленты. При таком определении эквивалентную массу можно найти экспериментально.
Методы определения.
Первые опыты по определению эквивалентных масс провели Дж.Дальтон, Й.Берцелиус, Ж.Дюма, Ж.Стас и другие ученые, но основная заслуга принадлежит здесь Т.Ричардсу, который впервые выполнил тщательные измерения эквивалентных масс с высочайшей точностью. Нагревая чистый перхлорат калия KClO3, превращали его в хлорид калия (KCl), при этом из 100 масс. ч. KClO3 образовывалось 60,835 масс. ч. KCl и 39,165 масс. ч. кислорода. Поскольку одна молекула KClO3 содержит на 3 атома кислорода, т.е. на 47,998 масс. ч., больше, чем KCl, то эквивалентная масса хлорида равна 47,998Ч(60,835:39,165) = 74,555. Далее, известное количество чистого серебра превращали в нитрат серебра, который использовали для осаждения хлорида серебра из раствора при взаимодействии с чистым хлоридом калия. Было установлено, что для полного превращения 74,555 масс. ч., т.е. массового эквивалента хлорида калия KCl, в хлорид серебра, который содержит 35,453 масс. ч. хлора, требуется 107,87 масс. ч. серебра. Эквивалентная масса калия при этом равна 74,555 – 35,453 = 39,102. Аналогично, зная эквивалентную массу серебра и изучая реакции образования им соответствующих галогенидов, например бромида AgBr, можно рассчитать эквивалентную массу галогена (в частности, брома). С использованием эквивалентных масс хлора и брома были определены эквивалентные массы многих металлов. Для нахождения эквивалентной массы какого-либо металла (М) синтезируют его чистый хлорид или бромид MBrx и осаждают галоген в виде галогенида серебра. Зная массы использованного MBrx и полученного AgBr, эквивалентные массы серебра (107,87) и брома (79,999), несложно определить эквивалентную массу металла М, который соединяется с 79,999 масс. ч. брома.
Описанный метод используется для точных расчетов, а для приближенных оценок можно применять другие способы, основанные на измерении объема и расчете массы водорода, выделившегося при растворении металла в кислоте, на определении массы одного металла, вытесняемого известным количеством другого из раствора, на определении состава гидридов или оксидов непосредственно по реакции соединения или аналитическими методами. Эквивалентные массы позволяют не только устанавливать соотношения, в которых элементы соединяются или замещают друг друга, но и точно определять атомные массы.
Кратные эквивалентные массы.
Иногда два элемента соединяются друг с другом в разных соотношениях, образуя два (или более) разных соединения. Например, известны два оксида меди. В одном из них, оксиде меди(II), 31,8 ч. меди соединены с эквивалентной массой, т.е. с 7,9997 масс. ч., кислорода, тогда как в оксиде меди(I) эта же эквивалентная масса кислорода соединена с 63,6 масс. ч. меди. Соответственно эквивалентные массы меди равны 31,8 и 63,6, при этом последняя величина ровно в два раза больше первой, а значит, эквивалентные массы являются кратными величинами. Этот вывод согласуется с ранее высказанным утверждением, что элементы соединяются пропорционально их эквивалентным массам или величинам, кратным этим массам.
Электрохимический эквивалент.
При прохождении через электролит количества электричества 1 F (фарадей) = 96 500 Кл (1 Кл = 1 АЧс) выделяется один химический эквивалент (т.е. эквивалентная масса) любого вещества. Следовательно, масса, выделяемая при прохождении 1 Кл (кулон), равна 1 экв., деленному на 96 500. Эта величина, называемая электрохимическим эквивалентом данного элемента, лежит в основе еще одного метода экспериментального определения эквивалентных масс.
Эквивалентные массы соединений.
Понятие эквивалентной массы было распространено и на соединения; в этом случае эквивалентная масса определяется как масса вещества, кратная эквивалентной массе элемента, являющегося ключевым для данного соединения. Например, для кислот ключевым элементом является водород, образующий в растворе ионы водорода; таким образом, эквивалентная масса кислоты есть масса кислоты, кратная 1,00797 массовым частям водорода, способного образовывать ионы водорода, т.е. водорода, который может быть замещен. Другими словами, эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты. Эквивалентная масса основания есть масса основания, которая реагирует с эквивалентной массой любой кислоты и, следовательно, является химическим эквивалентом этой массы. Иначе можно сказать, что эквивалентная масса основания равна его молярной массе, деленной на валентность металла, образующего основание. Для солей эквивалентная масса обычно кратна эквивалентной массе металла, образовавшего эту соль; она равна молярной массе соли, деленной на произведение валентности металла и числа его атомов в молекуле соли. Для эквивалентной массы окислителей и восстановителей можно дать несколько определений. С практической точки зрения наиболее удобно определение, согласно которому эквивалентная масса есть количество вещества, кратное 7,9997 ч. кислорода (или реагирующее с ними) либо его эквиваленту. Другое определение основано на том, что при восстановлении этого количества кислорода происходит перенос одного электрона. В этом случае эквивалентная масса окислителя или восстановителя есть масса, соответствующая массе вещества, принимающего или отдающего один электрон в окислительно-восстановительной реакции.
www.krugosvet.ru
Химик.ПРО - Молярная масса эквивалента металла
При окислении 16,74 грамм двухвалентного металла образовалась 21,54 грамма оксида. Вычислите молярную массу эквивалента металла и его оксида. Чему равна атомная масса металла?
Решение задачи
Согласно закону эквивалентов: массы реагирующих веществ пропорциональны молярным массам эквивалента этих веществ.
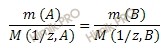
По условию задачи оксид образован двухвалентным металлом, следовательно, формулу запишем так MeO.
Исходя из массы оксида металла и массы металла, определим массу кислорода по формуле:
m (O) = m (MeO) – m (Me)
Получаем:
m (O) = 21,54 – 16,74 = 4,8 (г).
Закон эквивалентов в данном случае имеет вид:
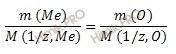
Из уравнения находим молярную массу эквивалента металла:
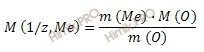 Получаем:
Получаем:
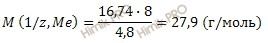
Рассчитаем молярную массу металла по формуле:
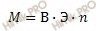
Где:
М – молярная масса,
В – валентность,
Э – эквивалентная масса
n – число атомов элемента в соединении.
Получаем:
M (Мe) = 2 ∙ 27,9 = 55,8 (г/моль).
Напомню, что молярная масса вещества, имеющего атомную или металлическую структуру, численно равна относительной атомной массе.
Следовательно, атомная масса металла равна 55,8 г/моль. А металл – железо (Fe).
Учитывая, что молярная масса оксида железа (FeO) равна 71,8 г/моль, найдем молярную массу эквивалента оксида железа (FeO) рассчитаем по формуле:
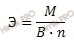
Получаем:
Э (FeO) = 71,8/2 = 35,9 (г/моль).
Ответ:
молярная масса эквивалента металла равна 27,9 г/моль;
атомная масса металла равна 55,8 г/моль;
молярная масса эквивалента оксида равна 35,9 г/моль.
Похожие задачи по химии
himik.pro
Определение эквивалентной массы металла
Министерство образования Российской Федерации
Владимирский государственный университет
Кафедра химии и экологии
Лабораторная работа № 3
Определение эквивалентной массы металла.
Выполнил студент группы МТС – 104
Сазонова Е.В.
Приняла
Гришина Е.П.
Владимир 2005
План
Цель работы.
Краткое теоретическое введение.
Приборы и реактивы.
Ход выполнения работы.
Таблица экспериментальных данных.
Расчеты.
Выводы.
Цель работы
Определение эквивалентной массы металла.
Краткое теоретическое введение.
Эквивалентом называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать один ион водорода в кислотно-основных или ионообменных реакциях или один электрон в окислительно-восстановительных процессах. Количество эквивалентов вещества обозначают nэ.
Масса одного моля эквивалентов называется молярной массой эквивалента (эквивалентной массой), обозначается Мэ и измеряется в граммах на моль (г/моль):
Мэ=m/nэ
В общем случает эквивалентная масса (Мэ) определяется отношением молярной массы(М) к фактору эквивалентности(fэкв):
Мэ=М*fэкв
Для газообразных веществ существует также и молярный объем эквивалента (эквивалентный объём) Vэ, который определяется как отношение молярного объёма газа Vm к фактору эквивалентности вещества:
Vэ=Vm*fэкв
Физический смысл эквивалентного объёма заключается в том, что он показывает объём, занимаемый одним молем эквивалентов газообразного вещества.
Фактор эквивалентности веществ зависит от характера реакции, в которой данного вещество принимает участие.
Фактор эквивалентности сложных соединений определяется следующим образом:
а) фактор эквивалентности кислоты определяется её основностью, т.е. числом атомов водорода в молекуле кислоты.
б) фактор эквивалентности основания определяется валентностью металла, образующего основание, или числом гидроксогрупп.
в) фактор эквивалентности соли определяется произведение валентности металла на число его атомов в молекуле.
Закон эквивалентов: вещества в химических реакциях взаимодействуют друг с другом в эквивалентных количествах. Математически закон эквивалентов выражается следующим образом:
Приборы и реактивы:
Установка.
Металл (Fe, Zn или Mg).
Соляная кислоты (16%).
Ход выполнения работы.
На штативе 3 укрепить две стеклянные трубки с делениями (бюретки) 2 и 5, соединенные между собой резиновой трубкой 1.
Бюретки заполнить наполовину водой. К бюретке 5 подсоединить через резиновую трубку 4 реакционную пробирку 6. Проверить герметичность прибора. Для этого приподнять вверх бюретку 2. Вода в обеих бюретках должны держаться на полученных уровнях.
Получить у лаборанта навеску металла. Отмерить в вытяжном шкафу 4 мл 16%-ной соляной кислоты при помощи цилиндра и кислоту перенести в реакционную пробирку 6.
Приподнять бюретку 2 и установить уровень воды в бюретке 5 на нулевой отметке. Открыть реакционную пробирку 6, опустить в нее полученный металл и быстро закрыть пробирку 6 пробкой. Попав в кислоту, металл начинает с ней реагировать. Выделившийся водород по резиновой трубке 4 попадет в бюретку 5 и вытеснит воду. Уровень воды в бюретке 5 понижается. По объему вытесненной воды судят об объеме выделившегося водорода.
После прекращения реакции добиться совпадения уровня воды в обеих бюретках, перемещая бюретку 2. Этим создается давление внутри бюретки 5, равное атмосферному давления. По положению нижнего мениска воды в бюретке 5 определяется объем выделившегося водорода.
Таблица экспериментальных данных.
| Параметры | Обозначение | Единица измерения | Результат |
| Масса металла | mМе | г | 0,114 |
| Объем выделившегося водорода | V | Мл | 43,2 |
| Температура | t | 0C | 21 |
| Атмосферное давление | Р | мм рт.ст. | 744 |
| Давление насыщенного водяного пара при температуре воды | РН2О | мм рт.ст. | 18,7 |
Расчеты.
а) перевести объем водорода к значению объема при нормальных условиях. По объединенному газовому закону
P* V P0 * V0
T T0
В данном уравнении вместо Р брать парциальное давление водорода РН2.
РН2 = Р – РН2О
РН2= 744 мм рт.ст. – 18,7 мм рт.ст. = 725,3 мм рт.ст.
732,2 * 273 * (41,4 -3,6)
V0= =33,7
760 * 295
V0 = 33,7 мл
б) По закону эквивалентов определить экспериментальное значение эквивалентной массы металла
МЭме =mМе * 11200 / V0
МЭме = 0,114 * 11200/ 38,28 = 33,35
в) Зная, что для эксперимента был взят двухвалентный металл, рассчитать атомную массу:
АМЕэкс = МЭМЕэкс * В
АМЕэкс = 66,71
г) Взять из таблицы точно значение атомной массы металла АМEтеор. Рассчитать относительную погрешность опыта η
η=[ (АМEтеор- АМЕэкc)/ АМEтеор] * 100%
η= ((65,37 – 66,71)/65,37)*100%=2,05%
в) Zn + 2HCl = ZnCl2 + h3
Выводы.
В результате опыта было установлено что использовался Цинк(Zn). Погрешность определения массы составила 2% это связано с тем, что точность определения объема выделившегося водорода лишь десятые доли миллилитра.
6
studfiles.net
Эквивалент. Эквивалентная масса | Задачи 1
Определение эквивалентной массы вещества
Задача №1При сгорании 5,00г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.Решение: Из условия задачи следует, что в оксиде металла на 5г металла приходится 4,44г кислорода (9,44 – 5 = 4,44). Согласно закону эквивалентов, массы (объёмы) взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
5г металла эквивалентны 4,44г кислорода mЭ(Ме) г/моль металла эквивалентны 8г/моль кислорода
Откуда mЭ(Ме) = 8 . 5/4,44 = 9,01г/моль.
Ответ: mЭ(Ме) = 9,01г/моль.
Задача №2Одно и то же количество металла соединяется с 0,200г кислорода и с 3,17г одного из галогенов. Определить эквивалентную массу галогена.Решение:
I Вариант:
Из условия задачи следует, что 0,200г кислорода и 3,17г галогена эквивалентно соединяются с металлом. Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
0,200г кислорода эквивалентны 3,17г галогена mЭ(О2) 8г/моль кислорода эквивалентны mЭ(Г) Х г/моль
Откуда: mЭ(Г) 8 . 3,17/0,200 = 126,8г/моль.
Ответ: mЭ(Г) = 126,8г/моль.
II Вариант:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):

Таким образом, количество эквивалентов галогена и кислорода численно равны между собой, что составляет:
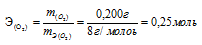
Зная количество эквивалентов и массу вещества можно определить эквивалентную массу этого вещества:
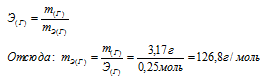
Ответ: 126,г/моль.
Задача №3Масса 1л кислорода равна 1,4г. Сколько литров кислорода расходуется при сгорании 21г магния, эквивалент которого равен 1/2 моля? Решение:Находим эквивалентную массу магния: mЭ(Mg) = 1/2M(Mg) =24/2 = 12г/моль. Следовательно, 21г магния составляет 21/2 =1,75 эквивалентной массы Mg. Согласно закону эквивалентов масса израсходованного кислорода составляет 1,75 его эквивалентной массы. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, рассчитаем массу кислорода, расходуемую на сжигание магния: m(O2) = 1,75 . 8 = 14г. Зная, что 1л кислорода по массе составляет 1,4г, рассчитаем объём кислорода расходуемого при сгорании 21г магния, составив пропорцию:
1,4 : 1 = 14 : х; х = 14 . 1/1,4 = 10л.
Ответ: V(O2) = 10л.
Задача№4Определить эквивалентные массы металла и серы, если 3,24г металла образует 3,48г оксида и 3,72г сульфида.Решение:Из условия задачи следует, что в оксиде металла на 3,24г металла приходится 0,24г кислорода (3,48 – 3,24 = 0,24г). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам). Так как эквивалентная масса кислорода составляет 8г/моль, то эквивалентную массу металла находим из пропорции:
8 : 0,24 = х : 3,24;х = 8 .3,24/0,24 =108г/моль.
В сульфиде металла на 3,24г металла приходится 0,48г серы (3,72 – 3,24 = 0,48г). Эквивалентную массу серы находим из пропорции:
3,24 : 108 = 0,48 : х;х = 108 . 3,24/0,48 = 16г/моль.
Ответ: mэ(Me) = 108г/моль; mэ(S) = 16г/моль.
Задача№5Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34г металла окисляются 0,680л кислорода (условия нормальные).Решение:Зная, что эквивалентный объём кислорода равен 5,6л/моль, рассчитаем эквивалентную массу металла, составив пропорцию:
8,345 : 0,680 = х : 5,6; х = 8,34 . 5,6/0,680 = 68,68г/моль.
Атомную массу металла находим, учитывая, что металл двухвалентный, умножением его эквивалентной массы на 2:
М(Ме) = mэ(Ме) .В, где
В – валентность металла; М – молярная масса металла; mэ(Ме) – эквивалентная масса металла.
М(Ме) = 68,68 . 2 = 137,4г/моль.
Определяем, какой это металл по таблице «Периодическая система химических элементов Д.И. Менделеева», учитывая, что его атомная масса составляет 137,4. Такой атомной массе соответствует барий – элемент№56.
Ответ: 137,4; Ba.
Задача№6Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.Решение:а) Находим формулу оксида мышьяка, учитывая, что оксид содержит 65,2% As по массе. Тогда оксид содержит кислорода по массе 34,8% (100 – 65,2 = 34,8). Находим формулу оксид мышьяка:
AsхОу = х : у = 65,2/Ar(As) : 34,8/Ar(O2) = 65,2/74,92 : 34,8/16 = 1 : 2,5 = 2 : 5
Формула оксида будет иметь вид: As2O5.
M(As2O5) = 229,84г/моль.
Находим массу мышьяка и массу кислорода в оксиде:
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 5 = 80г.
Согласно закону эквивалентов массы элементов в оксиде пропорциональны их эквивалентным массам:
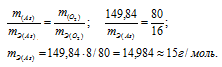
б) Подобные расчеты производим, учитывая, что оксид содержит 75,7% As и 24,3% О2 (100 – 75,7 = 24,3) по массе:
AsхОу = х : у = 75,7/74,92 : 24,3/16 = 1,01 : 1,51 = 1 : 1,5 2 : 3
Формула оксида будет иметь вид: As2O3.
M(As2O5) = 197,84г/моль.m(As) = 74,92 .2 = 149,84г; m(O2) = 16 .3 = 48г.
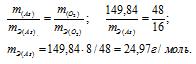
Ответ: а) 15г/моль; 24,97г/моль.
Задача№7,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.Решение:Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их а (объёмам):
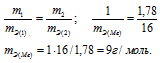
Находим эквивалентную массу брома, учитывая, что эквивалентная масса металла равна 9г/моль:

Ответ: 9г/моль; 79,9г/моль.
Задача№8Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?Решение:Согласно закону эквивалентов:
mэ(соли) = mэ(Cu) + mэ(Cl2).
Отсюда mэ(Cl2) = mэ(соли) - mэ(Cl2) = 99,5 – 35,5 = 64г/моль.
Зная эквивалентные массы хлора и меди можно определить количество их атомов в молекуле соли: mэ(А) = М(А)/mэ(А).
Тогда: CuxCly = x : y = 63,5/63,546 : 35,45/35,5 = 0,992 : 0,999 = 1 : 1
Отсюда CuxCly = CuCl.
Ответ: CuCl.
Задача№9. Для растворения 16,8г металла потребовалось 14,7г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).Решение:M(h3SO4) =98г/моль.Находим массу водорода в 14,7г серной кислоты, составив пропорцию: 98 : 2 14,7 : х;
х = 2 . 14,7/98 = 0,3г.
Согласно закону эквивалентов массы взаимодействующих веществ пропорциональны их эквивалентным массам:

Учитывая, что эквивалентный объём водорода равен 11,2л/моль, рассчитаем объём который занимает 0,3г водорода: из пропорции:
1 : 11,2 = 0,3 : х;х = 11,2 . 0,3/ 1 = 3,36л.
Ответ: mэ(Ме) = 56г/моль; V(h3) = 3,36л.
Задача№10На восстановление 1,80г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.Решение:Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
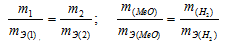
Так как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 4л. Отсюда эквивалентный объём водорода равен, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000мл/моль. Отношение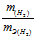 заменим равным ему отношением
заменим равным ему отношением 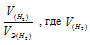 - объём водорода;
- объём водорода;
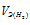 - эквивалентный объём водорода.
- эквивалентный объём водорода.
Тогда получим отношение 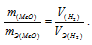
Находим эквивалентную массу оксида металла:
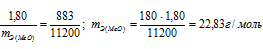
Согласно закону эквивалентов
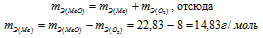
Ответ: 22,83г/моль; 14,83г/моль.
buzani.ru
Эквивалентная масса - металл - Большая Энциклопедия Нефти и Газа, статья, страница 1
Эквивалентная масса - металл
Cтраница 1
Эквивалентная масса металла равна 12 г / моль, Чему равна эквивалентная масса его оксида: а) 24 г / моль; б) нельзя определить; в) 20 г / моль. [1]
Эквивалентная масса металла равна 12 г / моль. Чему равна эквивалентная масса его оксида; а) 24 г / моль; б) нельзя определить; в) 20 г / моль. [2]
Эквивалентная масса металла может быть определена также по закону Фарадея, согласно которому при прохождении через раствор или расплав 96500 Кл электричества на электродах выделяется по одной эквивалентной массе вещества. [3]
Эквивалентная масса металла равна 12 г / моль. [4]
Эквивалентная масса металла равна 12 г / молй. [5]
Вычислить эквивалентную массу металла ( II), если известно, что при взаимодействии 8 г его с концентрированной серной кислотой выделяется такой же объем газа ( сернистый газ), как и при взаимодействии 3 г магния с избытком соляной кислоты. [6]
Чему равна эквивалентная масса металла. [7]
Вначале определяем эквивалентную массу металла, зная состав оксида и эквивалентную массу кислорода тэ ( О) 8 г / моль. [8]
По закону эквивалентов эквивалентная масса металла МЕ 2 28 - 8 / 1 5 12 16 г / моль. [9]
По экспериментальным данным и истинному значению эквивалентной массы металла определяют относительную ошибку опыта. [10]
Металл массой 0 864 г образовал хлорид массой 1 148 г. Определите эквивалентную массу металла, зная, что эквивалентная масса хлора равна 35 5 г / моль. [11]
На восстановление 1 80 г оксида металла израсходовано 0 838 л водорода, измеренного при н.у. Вычислите эквивалентную массу металла. [12]
Каждый моль алюминия косвенно ответствен за участие в реакции 6 молей ( или 12 экв) брома, следовательно, эквивалентная масса металла равна одной двенадцатой его молекулярной массы. [13]
ПА и / Пв - массы взаимодействующих веществ А и В, г; ЭА и Эв - эквивалентные массы этих веществ, г / моль. Формулу (1.8) используют для вычисления эквивалентных масс простых и сложных веществ. Например, если известно, что 1 44 г металла образуют 2 72 г оксида, то эквивалентную массу металла вычисляют следующим образом: масса металла тме1 44г, масса кислорода то2 72 - 1 441 28 г, эквивалентная масса кислорода Эо8 г / моль. [14]
Ширина рабочей поверхности призм не должна быть слишком большой во избежание лишнего трения и не должна быть очень малой во избежание вмятин на шейках вала или оправки при опускании детали. Приспособление устанавливают на полу или фундаменте строго горизонтально. Перед балансировкой проверяют параллельность и горизонтальность призм. Верх детали отмечают мелом. Если деталь уравновешена, то повернутая на любой угол она остается в покое. В качестве временного груза используют пластилин или замазку. Временный уравновешивающий груз после балансировки снимают и на его место прикрепляют равную по массе металлическую пластину или с противоположной стороны детали удаляют эквивалентную массу металла, не нарушая ее прочности. [15]
Страницы: 1
www.ngpedia.ru











