Формула бензола: какой из вариантов написания правильный? Бензольное кольцо это особенность строения
какой из вариантов написания правильный?
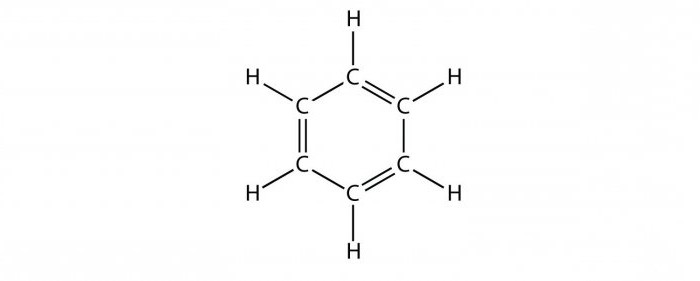
Ароматические углеводороды имеют циклическое строение. Первый представитель этого ряда – бензол (C6H6). Формулу, отражающую строение вещества, впервые предложил химик Кекуле в 1865 году. По рассказам ученого, он долго размышлял над загадкой бензола. Однажды ночью ему приснился змей, укусивший себя за хвост. Утром структурная формула бензола уже была составлена. Она представляла собой кольцо, состоящее из 6 углеродных атомов. Три из них были при двойной связи.

Строение бензола
Углерод в составе ароматических углеводородов образует правильный шестиугольник. Иногда при записи уравнений реакций его изображают вытянутым в вертикальном направлении. Эта группа атомов получила специальное название – бензольное ядро. Подтверждением циклического строения бензола является его получение из трех молекул ацетилена – непредельного углеводорода с тройной связью. Ароматические углеводороды тоже являются непредельными и проявляют некоторые свойства, характерные для алкенов. По этой причине в бензольном кольце тремя черточками, идущими параллельно граням, отмечают наличие двойной связи. Такая формула бензола не в полной мере отражает состояние углеродных атомов в молекуле.
Бензол: формула, отражающая истинное строение
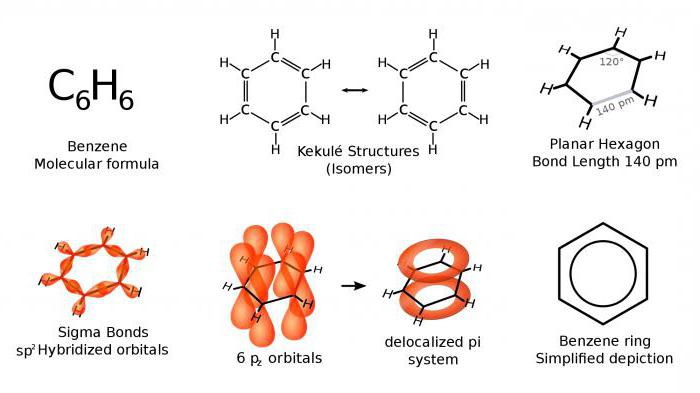
В реальности связи между углеродом в кольце равноценны между собой. Среди них не удалось выделить одинарные и двойные. Объясняется такая особенность электронным строением бензола, при котором углерод в ядре находится в sp2-гибридизованном состоянии, соединен с соседями по кольцу и водородом тремя обычными одинарными связями. В этом случае возникает шестиугольник, в котором находятся в одной плоскости 6 атомов углерода и 6 - водорода. Только электронные облака четвертых p-электронов, не участвующих в гибридизации, расположены иначе. Их форма напоминает гантели, центр приходится на плоскость кольца. А утолщенные части находятся сверху и снизу. В таком случае над бензольным ядром и под ним расположены две электронные плотности, возникшие при перекрывании облаков p-электронов. Возникает общая химическая связь для углерода в кольце.
Свойства бензольного кольца
За счет общей электронной плотности сокращаются расстояния между углеродом в кольце. Они равны 0,14 нм. Если бы в ядре бензола существовали одинарные и двойные связи, то было бы два показателя: 0,134 и 0,154 нм. Истинная структурная формула бензола не должна содержать простых и двойных связей. Поэтому ароматические углероды причисляют к непредельным органическим соединениям лишь формально. По составу они напоминают алкены, но могут вступать в реакции замещения, что характерно для предельных углеводородов. Ароматическое ядро бензола обладает значительной устойчивостью к окислителям. Все перечисленные особенности позволяют считать кольцо особым типом связи - не двойной и не одинарной.
Как изобразить формулу бензола?
Правильной является формула бензола не с тремя двойными связями, как у Кекуле, а в виде шестиугольника с кружком внутри. Он символизирует общую принадлежность 6 электронов.
Находит подтверждение симметрия строения и в свойствах вещества. Кольцо бензола является устойчивым, имеет значительную энергию сопряжения. Свойства первого представителя ароматических углеводородов проявляются у его гомологов. Каждый из них может быть представлен как производное, в котором происходит замещение водорода на различные углеводородные радикалы.
fb.ru
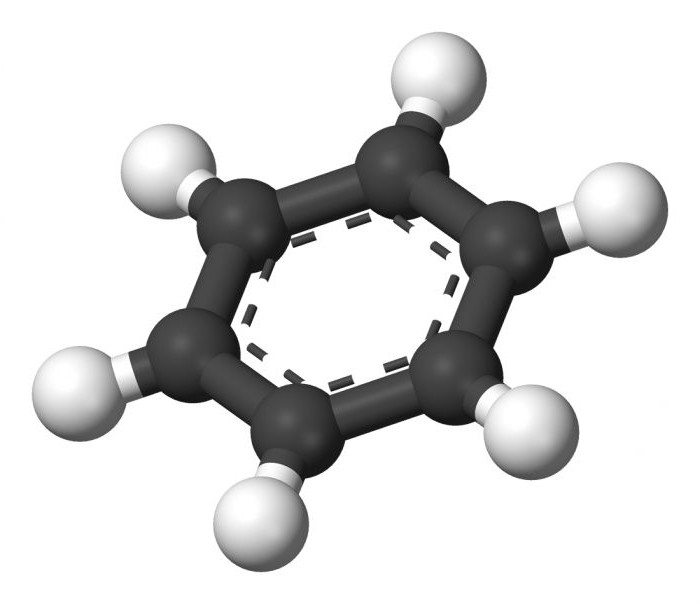
Бензол является ароматическим углеводородом, в основе которого лежит группа атомов углерода, связанная между собой циклически. И именно эта особая группа называется бензольным кольцом, или ароматическим ядром. Специфика строения бензолаВ далеком 1825 году, Майкл Фарадей английский естествоиспытатель, исследовал ворвань. При ее термическом разложении выделилось вещество с сильным запахом. Молекулярная его формула была С6Н6. Именно это соединение сегодня называют простейшим ароматическим углеводородом, или бензолом.Структурная формула, предложенная уже немецким химиком Кекуле в 1865 году, получила широкое распространение. Она представляет собой чередующиеся одинарные и двойные связи между атомами углерода, замыкаясь в кольцо. Когда Кекуле работал над этой темой, во сне он увидел змею, что кусала себя хвост. Благодаря этому сну он сумел создать бензольное кольцо структурно, определил пространственное положение атомов углерода относительно друг друга. В молекуле бензола привычные одинарные и двойные связи между атомами углерода отсутствуют, они одинаково равноценны, представляют собой промежуточные, так называемые полуторные, связи. С их помощью образованное единственное бензольное кольцо, в других веществах этот вид связи не встречается. Особенностью бензольного кольца является то, что все атомы, входящие в состав этого вещества, находятся в одной плоскости, и каркас его образуют атомы углерода, создавая правильный шестиугольник. Все валентные углы составляют 120 градусов, они равны.
Каждый атом углерода в молекуле бензола имеет одинаковую электронную плотность. Состояние каждого из них – sр2-гибридизация. Из этого видно, что гибридизированы всего три орбитали, одна – s, и две – р. Одна р-орбиталь остается негибридной. Две гибридные р-орбитали перекрыты с двумя смежными атомами углерода, s-орбиталь водорода перекрывается с третьей орбиталью. Негибридная р-орбиталь имеет форму гантели, она расположена под углом в 90 градусов к s-орбитали. В результате того, что у бензола р-орбиталь каждого атома углерода перекрывается с двумя смежными аналогичными р-орбиталями атомов, получается, что смежные электроны между собой взаимодействуют, образуют р-электронное облако, единое для всех атомов. Графически оно изображается в виде кольца внутри правильного шестигранника. |
completerepair.ru
Что такое бензольное кольцо? - Полезная информация для всех
Как я понял из своей школы, бензольное кольцо - это органическое соединение газа.
Например фенолы, спирты часто состоят из бензольно кольца.
Если мне не изменяет память, то формула бензольного кольца C6H6.
Обычно бензольное кольцо имеет запах, но не во всех соединениях.
Повторю вопрос.

Прежде всего замечу ,, что бензольное кольцо это формула Кекуле.
Да это именно формула, которая обозначает структуру молекулы бензола.
Ее еще называют и химической формулой и структурной формулой.
Дело в том, что именно такое расположение атомов бензола в молекуле и помогает описать его свойство.
А вот как это выглядит.

Бензольное кольцо - это форма соединения группы органических соединений. Кольцом называется потому, что 6 атомов углерода соединены между собой по кольцу. Формула бензольного кольца записывается следующим образом C6Hn.
Бензольное кольцо это фрагмент структуры многих органических соединений.
Химическая формула бензольного кольца такова: C6Hn, n = 0...6.
Характерным признаком бензольного кольца является ароматическая связь между углеродными атомами, входящими в его состав. Ароматическая связь это особый вид связи, отличающийся от простой и двойной связи. Важно помнить, что в реальности ни простых, ни двойных связей в бензольном кольце не имеется.
Изобразить бензольное кольцо двумя способами.
Первый способ: бензольное кольцо можно изобразить по старинке, в виде правильного шестиугольника с тремя простыми и тремя двойными связями внутри.

Второй способ: можно нарисовать бензольное колечко в виде опять-таки правильного шестиугольника, но только с окружностью внутри. Шестиугольник обозначает шесть атомов углерода (так называемый сигма-каркас), а окружность обозначает п-систему электронов.

Но если Вы хотите нарисовать структуру не самогО бензола, а его двух- или трхъядерных производных, например, нафталина, то от окружностей придтся отказаться. Нафталин рисуют, пользуясь только простыми и двойными связями:

Бензольное кольцо или кольца входят в состав многих органических соединений: аренов, ароматических спиртов, фенолов, ароматических альдегидов (например, бензальдегид) ароматических кислот (бензойная кислота) и многих других.
Бензольное кольцо является фрагментом структуры многих органических соединений (по сути - форма соединения группы органических соединений): ароматические кислоты, ароматические альдегиды, фенол, ароматические спирта и имеет химическую формулу C6Hn. Кольцом эту форму (фрагмент) называют потому, что все шесть атомов углерода соединены между собой попарно и симметрично (см картинку)

Фрагмент структуры многих органических соединений, вот более правильное обозначение - как называют бензольное кольцо, более подробно об этом можно узнать из этой статьи.
Состоит же это самое бензольное кольцо из химического состава, в который входят такие компоненты как кислоты, фенол, альдегиды, ароматические спирта и другие. Все это в месте образует бензольное кольцо, состоящее из шести атомов соединенных между собой попарно.
Бензольное кольцо - это не то кольцо, которое мы привыкли воспринимать как замкнутый круг из железа или какого другого материала.
Это кольцо, которое состоит из 6 атомов углерода, вот эти 6 атомов скреплены между собой в виде кольца.
Конечно же, это колечко, кое мы носим на пальце. Сие кольцо quot;родом из химииquot;. Это органич-ие соединения.

Оно весьма стойко к окислителям. Посему, ему не так-то просто окислиться.
В Большой Энциклопедии Нефти Газа дано много свойств сего кольца.

Бензольное кольцо могут иметь хлордефенилы. Бензольное кольцо состоит из неподеленных электронных пар, которые располагаются вокруг ядер углерода. Скелет бензольного кольца представляет шестиугольник, электроны образуют замкнутую кривую.
Бензольное кольцо несет аромат, это углеродные атомы, которые образуют группу атомов. А кольцом называется, потому что атомы соединены в симметричном порядке шестиугольником и атомы эти в парном порядке.
А выглядит оно вот так.

info-4all.ru
Что такое бензол? Строение бензола, формула, свойства, применение
Среди огромного арсенала органических веществ можно выделить несколько соединений, открытие и изучение которых сопровождалось многолетними научными спорами. К ним по праву относится бензол. Строение бензола в химии было окончательно принято лишь к началу 20 столетия, тогда как элементный состав вещества определили еще в 1825 году, выделив его из каменноугольной смолы, которую получали как побочный продукт коксования угля.
Бензол вместе с толуолом, антраценом, фенолом, нафталином в настоящее время относят к ароматическим углеводородам. В нашей статье мы рассмотрим, каковы же особенности молекулы этого углеводорода, выясним физические свойства, например, такие как растворимость, температуру кипения и плотность бензола, а также обозначим области применения соединения в промышленности и сельском хозяйстве.
Что такое арены?
Химия органических соединений классифицирует все известные вещества на несколько групп, например, такие как алканы, алкины, спирты, альдегиды и т.д. Главной отличительной чертой каждого класса веществ является наличие определенных типов связей. Молекулы предельных углеводородов содержат только сигма-связь, вещества ряда этилена – двойную, у алкинов связь тройная. К какому же классу относится бензол?
Строение бензола указывает на присутствие в его молекуле ароматического кольца, названного бензольным ядром. Все соединения органической природы, содержащие одно или несколько таких колец в составе своих молекул, относят к классу аренов (ароматических углеводородов). Кроме бензола, который мы сейчас рассматриваем, в эту группу входит большое количество очень важных веществ, каких как толуол, анилин, фенол и другие.
Как решили проблему строения молекулы ароматического углеводорода
Вначале ученые установили качественный и количественный состав соединения, выразив его формулой С6Н6, согласно которой относительная молекулярная масса бензола равна 78. Затем было предложено несколько вариантов структурных формул, но ни одна из них не соответствовала реальным физическим и химическим свойствам бензола, наблюдаемым химиками в лабораторных опытах.
Прошло около сорока лет, прежде чем немецкий исследователь А. Кекуле представил свою версию структурной формулы, которую имеет молекула бензола. В ней присутствовали три двойных связи, указывающие на возможный непредельный характер химических свойств углеводорода. Это вступало в противоречие с действительно существующим характером взаимодействий соединения формулы С6Н6 с другими веществами, например, с бромом, нитратной кислотой, хлором.

Только после выяснения электронной конфигурации молекулы бензола в его структурной формуле появилось обозначение бензольного ядра (кольца), а сама она до сих пор используется в курсе органической химии.
Электронная конфигурация молекулы С6Н6
Какую же пространственную структуру имеет бензол? Строение бензола окончательно было подтверждено благодаря двум реакциям: тримеризации ацетилена с образованием бензола и его восстановления водородом до циклогексана. Оказалось, что атомы углерода, соединяясь между собой, образуют плоский шестиугольник и находятся в состоянии sp2-гибридизации, используя на связи с другими атомами три из четырех своих валентных электронов.
Оставшиеся шесть свободных p-электронов располагаются перпендикулярно плоскости молекулы. Перекрываясь между собой, они формируют общее электронное облако, названное бензольным ядром.
Природа полуторной химической связи
Хорошо известно, что физические и химические свойства соединений зависят, прежде всего, от их внутреннего строения и типов химических связей, возникающих между атомами. Рассмотрев электронную структуру бензола, можно прийти к выводу, что его молекула не имеет ни простых, ни двойных связей, которые можно увидеть в формуле Кекуле. Наоборот, между атомами углерода все химические связи равноценны. Более того, общее π-электронное облако (всех шести атомов С) образует химический тип связи, названный полуторной, или ароматической. Именно этот факт обуславливает специфические свойства бензольного кольца и, как следствие, характер химического взаимодействия ароматических углеводородов с другими веществами.
Физические свойства
Арены, содержащие в составе молекулы небольшое количество атомов углерода, представлены в основном жидкостями. Не является исключением и бензол. Строение бензола, как мы помним, указывает на его молекулярную природу. Как же этот факт отразился на его свойствах?
При понижении температуры жидкость переходит в твердую фазу, и бензол превращается в белую кристаллическую массу. Она легко плавится при температуре 5,5 °С. В обычных условиях вещество представляет собой бесцветную жидкость со своеобразным запахом. Его температура кипения составляет 80,1 °С.
Плотность бензола меняется в зависимости от изменения температуры. Чем температура выше, тем плотность меньше. Приведем несколько примеров. При температуре 10° плотность составляет 0,8884 г/мл, а при 20° - 0,8786 г/мл. Молекулы бензола неполярные, поэтому вещество нерастворимо в воде. Зато само соединение является хорошим органическим растворителем, например, для жиров.
Особенности химических свойств бензола
Экспериментально установлено, что ароматическое бензольное ядро устойчиво, т.е. характеризуется высокой стойкостью к разрыву. Этот факт служит объяснением склонности вещества к протеканию реакций по типу замещения, например, с хлором при обычных условиях, с бромом, с нитратной кислотой в присутствии катализатора. Нужно отметить высокую устойчивость бензола к действию окислителей, таких как перманганат калия и бромная вода. Это еще раз подтверждает факт отсутствия в молекуле арена двойных связей. Жесткое окисление, иначе называемое горением, характерно для всех ароматических углеводородов. Так как процентное содержание углерода в молекуле С6Н6 велико, горение бензола сопровождается коптящим пламенем с образованием частиц сажи. В результате реакции образуется углекислый газ и вода. Интересным представляется вопрос: может ли ароматический углеводород вступать в реакции присоединения? Рассмотрим его далее более подробно.
К чему приводит разрыв бензольного ядра?
Напомним, что в молекулах аренов присутствует полуторная связь, возникшая в результате перекрывания шести р-электронов атомов карбона. Она и лежит в основе бензольного ядра. Чтобы его разрушить и провести реакцию присоединения, необходим ряд специальных условий, например, таких как световое облучение, высокие температура и давление, катализаторы. Смесь бензола и хлора вступает в реакцию присоединения под действием ультрафиолетового излучения. Продуктом такого взаимодействия будет гексахлорциклогексан – токсическое кристаллическое вещество, применяемое в сельском хозяйстве в качестве инсектицида. В молекуле гексахлорана уже нет бензольного ядра, по месту его разрыва произошло присоединение шести атомов хлора.

Области практического применения бензола
В различных отраслях промышленности вещество широко используется как растворитель, а также как сырье для дальнейшего получения лаков, пластических масс, красителей, в качестве добавки к моторному топливу. Еще больший диапазон применения имеют производные бензола и его гомологи. Например, нитробензол С6Н5NO2 является основным реагентом для получения анилина. В результате реакции замещения с хлором в присутствии хлорида алюминия в качестве катализатора получают гексахлорбензол. Его применяют для предпосевной обработки семян, а также используют в деревообрабатывающей промышленности для защиты древесины от вредителей. Нитрованием гомолога бензола (толуола) получают взрывчатое вещество, известное как тротил или тол.
В данной статье мы рассмотрели такие свойства ароматического соединения, как реакции присоединения и замещения, горение бензола, а также определили области его применения в промышленности и сельском хозяйстве.
fb.ru
Ароматические углеводороды. Бензол и его гомологи
Ароматические углеводороды. Бензол и его гомологи
Ароматические углеводороды (арены) - вещества, в молекулах которых содержится одно или несколько бензольных колец - циклических групп атомов углерода с особым характером связей. Гомологический ряд Cnh3n-6.
Понятие «бензольное кольцо» сразу требует расшифровки. Для этого необходимо хотя бы коротко рассмотреть строение молекулы бензола. Первая структура бензола была предложена в 1865 г. немецким ученым А. Кекуле:
К наиболее важным ароматическим углеводородам относятся бензол С6Н6 и его гомологи : толуол С6Н5СНз, ксилол С6Н4(СНз)2 и др.; нафталин C10H8, антрацен С14Н10 и их производные.
Атомы углерода в молекуле бензола образуют правильный плоский шестиугольник, хотя обычно его рисуют вытянутым.
Окончательно строение молекулы бензола подтверждено реакцией образования его из ацетилена. В структурной формуле изображается по три одинарных и три двойных чередующихся углерод-углеродных связей. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны, и они обладают свойствами, не похожими на свойства ни одинарных, ни двойных связей. Эти особенности объясняются электронным строением молекулы бензола.
Электронное строение бензола
Каждый атом углерода в молекуле бензола находится в состоянии sp2-гибридизации. Он связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. В результате образуется плоский шестиугольник: все шесть атомов углерода и все σ-связи С-С и С-Н лежат в одной плоскости. Электронное облако четвертого электрона (р-электрона), не участвующего в гибридизации, имеет форму гантели и ориентировано перпендикулярно к плоскости бензольного кольца. Такие р-электронные облака соседних атомов углерода перекрываются над и под плоскостью кольца.
В результате шесть р-электронов образуют общее электронное облако и единую химическую связь для всех атомов углерода. Две области большой электронной плоскости расположены по обе стороны плоскости σ-связей.
p-Электронное облако обусловливает сокращение расстояния между атомами углерода. В молекуле бензола они одинаковы и равны 0,14 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет простых и двойных связей. Молекула бензола - устойчивый шестичленный цикл из одинаковых СН-групп, лежащих в одной плоскости. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные свойства бензольного ядра. Наиболее точно это отражает структурная формула бензола в виде правильного шестиугольника с окружностью внутри (I). (Окружность символизирует равноценность связей между атомами углерода.) Однако часто пользуются и формулой Кекуле с указанием двойных связей (II):
Бензольное ядро обладает определенной совокупностью свойств, которую принято называть ароматичностью.
Гомологический ряд, изомерия, номенклатура
Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол или дифенил), ко второму — конденсированные (полиядерные) арены (простейший из них — нафталин):
Гомологический ряд бензола имеет общую формулу СnН2n-6. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С6Н5-СН3 - метилбензол или толуол, С6Н4(СН3)2 - диметилбензол или ксилол, С6Н5—С2Н5 - этилбензол и т.д.
Так как в бензоле все углеродные атомы равноценны, то у первого его гомолога - толуола - изомеры отсутствуют. У второго гомолога - диметилбензола - имеются три изомера, отличающиеся взаимным расположением метильных групп (заместителей). Это орто- (сокращенно о-), или 1,2-изомер, в нем заместители находятся у соседних атомов углерода. Если заместители разделены одним атомом углерода, то это мета- (сокращенно м-) или 1,3-изомер, а если они разделены двумя атомами углерода, то это пара- (сокращенно п-) или 1,4-изомер. В названиях заместители обозначаются буквами (о-, м-, п-) или цифрами.
Физические свойства
Первые члены гомологического ряда бензола - бесцветные жидкости со специфическим запахом. Плотность их меньше 1 (легче воды). В воде нерастворимы. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Химические свойства
Ароматичность определяет химические свойства бензола и его гомологов. Шестиэлектронная π-система является более устойчивой, чем обычные двухэлектронные π-связи. Поэтому реакции присоединения менее характерны для ароматических углеводородов, чем для непредельных углеводородов. Наиболее характерными для аренов являются реакции замещения. Таким образом, ароматические углеводороды по своим химическим свойствам занимают промежуточное положение между предельными и непредельными углеводородами.
I. Реакции замещения
Алкилирование бензола происходит также при его взаимодействии с алкенами:
Дегидрированием этилбензола получают стирол (винилбензол):
II. Реакции присоединения
III. Реакции окисления
2С6Н6 + 15O2 → 12СO2 + 6Н2O
Не происходит химической реакции (сходство с алканами).
Свойства гомологов бензола
В гомологах бензола различают ядро и боковую цепь (алкильные радикалы). По химическим свойствам алкильные радикалы подобны алканам; влияние бензольного ядра на них проявляется в том, что в реакциях замещения всегда участвуют атомы водорода у атома углерода, непосредственно связанного с бензольным ядром, а также в более легкой окисляемости С-Н связей.
Влияние электронодонорного алкильного радикала (например, -СН3) на бензольное ядро проявляется в повышении эффективных отрицательных зарядов на атомах углерода в орто- и пара-положениях; в результате облегчается замещение связанных с ними атомов водорода. Поэтому гомологи бензола могут образовывать тризамещенные продукты (а бензол обычно образует монозамещенные производные).
I. Реакции с участием боковой цепи
II. Реакции с участием бензольного ядра
При избытке галогена:
Способы получения бензола
См. «Циклоалканы»
См. «Алканы»
См. «Алкины»
Способы получения гомологов бензола
Кроме одноядерных ароматических углеводородов, к которым относятся бензол и его гомологи, существуют также многоядерные арены; например:
examchemistry.com
Бензольное кольцо - Справочник химика 21
из "Путешествие в мир органической химии"
В 1828 году Велер, получив мочевину в лаборатории, нанес удар витализму и проложил путь к синтезу органических веществ. Все больше становилось соединений, полученных в реакционных сосудах химиков. [c.98] В 1831 году Либих значительно усовершенствовал и упростил элементарный анализ, что очень облегчило исследование состава органических соединений. С этого времени было открыто, синтезировано и подвергнуто анализу огромное число соединений. Причем выяснили, что есть вещества, имеющие одинаковый химический состав, но различные свойства. Другими словами, обнаружилось, что равные количества одних и тех же элементов могут быть связаны друг с другом неодинаково . Все более настоятельно вставал вопрос о структуре, о расположении атомов в молекуле. Поиски ответа привлекли внимайие профессора Гентского университета Августа Кекуле. [c.98] Существовали различные точки зрения. Была выдвинута теория радикалов, много спорили о так называемом учении о типах. Но ни то, ни другое толкование не в состоянии было удовлетворительно объяснить все экспериментальные факты. Противоречия между экспериментальными данными и теорией требовали неотложного решения. [c.98] Для Кекуле было ясно, что дальнейшая работа над теорией радикалов непременно приведет в тупик, что она бессмысленна, бесцельна. Ему казалось гораздо более разумным исходить из самих элементов и искать ответ на вопрос, по каким законам атомы этих элементов соединяются в молекулы. [c.98] Как же обстояло дело с атомностью углерода, содержащегося во всех органических соединениях Со сколькими эквивалентами других элементов он мог соединяться Подобными вопросами Кекуле обстоятельно занимался. На примере гремучей ртути, соединения, которое так успешно исследовал его учитель Либих, он провел серию экспериментов и показал, что углерод четырехвалентен. Рассмотрим простейшие соединения углерода. Бросается в глаза, что масса углерода, которую химики признали наименьшей, равной одному атому, всегда присоединяет четыре атома одноатомного или два атома двухатомного элемента . Таким образом, общая сумма химических единиц элементов, связанных с одним углеродом, равна 4. Эти данные приводят к заключению, что углерод четырехатомен , — писал Кекуле. [c.99] Практически в молекулах почти всех соединений содержится по нескольку углеродных атомов. [c.99] Так выражал Кекуле само собой разумеющееся в наши дни понятие о том, что атомы углерода соединяются между собой, затрачивая при этом часть химического сродства друг. на друга. Из восьми единиц сродства (два раза по четыре) двух атомов углерода две единицы используются для соединения этих атомов между собой и остаются еще шесть, по которым могут быть присоединены атомы других элементов. Если таким образом соединяются больше чем два атома углерода, то с каждым вновь присоединенным атомом основность углеродной группы повышается на две единицы . [c.99] Кекуле был, конечно, далек от того, чтобы рассматривать символы элементов, связанные в определенной последовательности в цепи, как реальное отражение строения молекулы. Он был совершенно уверен в пространственном распОг ложении атомов. Само собой понятно, что положение атомов в пространстве, даже если бы оно было установлено, нельзя изобразить в плоскости бумаги. Для этого по крайней мере необходим рисунок, сделанный с учетом перспективы, или модель . Кекуле привлекали те представления, которые в 1874 году высказали независимо друг от друга Вант-Гофф и Ле-Бель, и которые впоследствии были развиты в тетраэдрическую модель атома углерода, принятую и в наши дни. [c.100] Гораздо больше пришлось поломать голову над строением молекул ароматических соединений. Оказалось, что учение о валентности не применимо к некоторым органическим соединениям, что строение многих из них не укладывается в схему, о которой мы рассказывали. Такими соединениями являлись ароматические соединения. Их называли так потому, что Некоторые из них обладали приятным запахом. Именно тем, что их нельзя было уложить в схему, эти соединения заинтересовали Кекуле. Он установил, что во всех ароматических соединениях содержится группировка из шести атомов углерода, которая сохраняется в некоторых продуктах превращения этих веществ. Эта группировка Се была и у бензола СеНв — простейшего представителя ароматических соединений. Если бы удалось выяснить структуру бензола, то, наверняка, это явилось бы ключом к пониманию строения всех ароматических соединений. [c.100] Мысли о формуле бензола не покидали Кекуле. В егве мозгу проносились пляшущие атомы и длинные их цeп i, крепко связанные между собой. Все это в непрерывном-дИ =-.. жении вертелось и извивалось подобно змеям. Но что этй Одна змея схватила свой собственный хвост. Это может быть, решением Никакой цепи нет. Кольцо из атомов углерода такова формула бензола. [c.101] Однако прежде чем написать формулу бензола, удовлетворяющую всем известным экспериментальным фактам, следовало еще очень многое осмыслить. Как происходит объединение шести атомов углерода в кольцо, все еще было не совсем понятно. В полученной таким образом молекуле углерод должен был быть трехвалентным. Но это противоречило теории об обязательной четырехвалентности углерода, признанной Кекуле. Тогда он пришел к выводу, что остающиеся шесть валентностей шести атомов углерода объединяются в три двойные связи, которые в кольце чередуются с одинарной связью. [c.101] Кекуле принялся исследовать группу ароматических соединений. Уже давно было установлено, что некоторые свойства членов этой группы сильно отличаются от свойств других соединений. Принципы строения формулы бензола Кекуле распространил на всю эту группу. Полученные сведения он изложил в своих Исследованиях об ароматических соединениях . [c.101] Если теперь предположить, что два атома углерода, замыкающие цепь, связаны через одну единицу сродства, мы получим замкнутую цепь (симметричное кольцо), содержащую еще 6 свободных единиц сродства. Если эти 6 единиц сродства насыщены водородом, получается бензол. Водород в бензоле можно полностью или частично заменить хлором, бромом или иодом . [c.102] Далее Кекуле доказывал, что в любом ароматическом соединении, известном до сих пор, содержится по крайней мере одно бензольное кольцо, представляющее собой характерную составную часть, основной конструктивный элемент арои а-тических соединений. [c.102] Предположив, что 6 углеродных атомов бензольного кольца образуют симметричный шестиугольник, легко было прийти к выводу, что все шесть атомов водорода равноценны. Например, не играет роли, у какого атома углерода — первого, второго, третьего или пятого — произошло замещение атома водорода на атом хлора, поскольку все атомы водорода одинаково расположены в пространстве и имеют одинаковые связи. Тот факт, что у однозамещенных производных бензола отсутствует изомерия, вполне может служить доказательством регулярного расположения атомов углерода в шестиугольнике бензола. [c.102] Эту хорошо обоснованную теорию о строении бензольного кольца Кекуле представил на обсуждение специалистов. Практика должна была решить, насколько она верна. [c.102] Формула бензола, сконструированная Кекуле, была принята подавляющим большинством химиков. Оставалось еще много неясного, но работать органикам стало гораздо проще. Теперь можно было рассматривать всю химию ароматических соединений под единым углом зрения, можно было объяснить строение многих соединений, вскрыть аналогии, истолковать различия и, таким образом, создать основу для синтеза природных веществ. О чем бы ни шла речь — о каменноугольных красителях, о лекарственных препаратах, пластмассах или природных соединениях, выясняется, что в основе их структуры всегда лежит формула бензола. [c.102] Кекуле умер в 1896 году в Бонне в возрасте 67 лет. [c.103] Мы рассказали далеко не все о формуле бензола. Ряд особенностей делает целесообразным дальнейшее ее рассмотрение. [c.103] Расшифровывая структуру молекулы бензола, Кекуле расположил атомы углерода в правильный плоский шестиугольник. Каждый атом углерода в нем соединен двумя валентностями с соседними атомами углерода и одной валентностью с атомом водорода (а). Такой способ, несомненно, наиболее прост. Однако кольцо, построенное таким образом, не удовлетворяло бы существующему представлению о четырехвалентности углерода. Поэтому Кекуле считал единственно возможным оставшиеся 6 валентностей шести углеродных атомов соединить в двойные связи, расположенные равномерно в кольце (б). [c.103]Вернуться к основной статье
chem21.info
Бензол особенности строения - Справочник химика 21
Изомерия замещенных бензола. Изомерия в ряду ароматических углеводородов обусловливается или общими причинами или особенностями строения кольца. Прежде всего, можно представить, например, что в одном случае два атома бензольного водорода замещены двумя метильными группами, в другом — один атом водорода замешен этилом получается два изомера СбН4(СНз)г (диметилбензол) и СеНб—С2Н5 (этилбензол) с общей формулой СвНю. Так же легко вывести все возможные изомеры для углеводорода формулы С9Н12 [c.93] Хотя эти формулы более точно отражают некоторые особенности строения бензола, формула Кекуле продолжает широко применяться. Одиако, используя ее, нельзя забывать о ее недостатках. [c.68]Особенности строения и свойств бензола удалось полностью объяснить только после развития современной квантово-механической теории химических связей. По современным представлениям все шесть атомов углерода в молекуле бензола находятся в вр -гибридном состоянии. Каждый атом углерода образует а-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя а-связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник (а-скелет молекулы бензола). [c.333]
Метод энергий связей снова приводит к подозрительному несоответствию при попытке предсказания теплоты образования бензола. Как и в других подобных случаях, это несоответствие позволяет установить важные особенности строения молекулы бензола. Действительно, предположим, что молекула бензола имеет структуру, предложенную для нее известным химиком-органиком прошлого века А. Кекуле. [c.33]
Химические связи в молекуле бензола. Типичным ароматическим углеводородом является бензол СвНе. Химические свойства ароматических соединений обусловлены особенностью строения бензольного [c.257]
Ясно, что формула. Кекуле не отражает всех указанных особенностей строения молекулы бензола, однако из множества предложенных формул она является наиболее удовлетворительной, вследствие чего ею поль-зуются и в настоящее время. [c.247]
Ясно, что формула Кекуле не отражает всех указанных особенностей строения молекулы бензола. [c.250]
Особенности ароматических соединений. Бензол яв-" ся первым представителем ароматических углеводородов, обладает рядом своеобразных свойств, отличающих его от Ценных ранее предельных и непредельных ациклических " леводородов. Ароматический характер бензола определяется строением и проявляется в химических свойствах. [c.215]
С особенностями строения и химического поведения ароматических углеводородов мы познакомимся на простейшем их представителе — бензоле. [c.193]
Стойкость ароматических соединений связывается с особенностями строения бензола. [c.566]
Изомерия замещенных бензола. Изомерия в ряду ароматиче- ских углеводородов обусловливается или общими причинами, или особенностями строения кольца. Прежде всего, можно представить, например, что в одном случае два атома бензольного водо- [c.101]
Стойкость ароматических соединений связывается с особенностями строения бензола. В бензоле имеется шесть сопряженных электронов, которые составляют ароматический секстет , являющийся особой чертой всех веществ, обладающих типично ароматическими свойствами. [c.557]
Какие же особенности строения обусловливают ароматические свойства Работами Робинсона и других исследователей было показано, что для проявления ароматических свойств необходимо наличие в кольце (не обязательно шестичленном) так называемого ароматического секстета электронов — шести сопряженных л-электронов. Для того чтобы могло произойти сопряжение р-электронов, оси их должны быть параллельными, а следовательно, все кольцо должно быть в одной плоскости — копланарно. Копланарной могут быть не всякие молекулы, а такие, валентные углы которых близки к 120 (валентным углам бензола). Таким условиям удовлетворяют, в первую очередь, пяти- и семичленные кольца. [c.130]
Название ароматические сохранилось за ними и до сих пор, но теперь уже как символ большого своеобразия свойств углеводородов ряда бензола, обусловленного наличием я-связей в их молекуле и особенностями строения электронных оболочек. [c.47]
До сих пор не известны значения р и для других реакций, в которых переходное состояние столь мало отличается от промежуточного соединения, что разрыв С — Н-связи во всех случаях является стадией, определяющей. скорость реакции. Однако особенности строения промежуточного соединения в таких реакциях могут приводить к увеличению роли разрыва С — Н-связи и появлению изотопного эффекта. Так, реакции бромирования бромом и азосочетания, естественно, не имеют изотопных эффектов, однако вследствие энергетической близости промежуточного соединения с высокой энергией к дв ум переходным состояниям уже незначительного изменения в балансе двух скоростей реакций -1 и вызываемом структурными факторами, может быть достаточно, чтобы поднять второе переходное состояние выше первого и превратить разрыв С — Н-связи в стадию, которая будет определять скорость реакции. Таким структурным фактором могут быть стерические препятствия, которые, способствуя увеличению /е 1, облегчают переход промежуточного соединения через барьер первого переходного состояния. Стерические препятствия оказывают очень сильное воздействие, поскольку даже реакция бромирования смесью бром — перхлорат серебра (которая должна иметь значительно более низкие значения р, чем некаталитическая реакция) протекает с изотопным эффектом, в том случае когда субстратом является 1,3,5-три-/п/7т-бутилбензол [101]. Меркурирование и сульфирование следует рассматривать как примеры, в которых, несмотря на раннее переходное состояние, структурные особенности промежуточного соединения так влияют на изменение констант к-1 и к2, что появляется изотопный эффект. Значение р, полученное на основании самых последних данных по сульфированию бензола и толуола в 82,9%-ной серной кислоте (т. е. в условиях, в которых изотопный эффект не наблюдался), достигает, вероятно, величины порядка —8 [187]. Значение р для реакций меркурирования составляет только —4,0. Особенности строения промежуточного соединения увеличивают константу к-1 в одном случае и уменьшают константу 2 в другом, так что становится возможным появление изотопного эффекта. С другой стороны, при нитровании промежуточное соединение настолько сильно отличается по энергии от первого переходного состояния, что ни одна из структурных особенностей промежуточного соединения, которая способна приводить к появлению изотопного эффекта в других реакциях, не может в достаточной мере снизить энергию этого переходного состояния, и промежуточное соединение может переходить только в продукты реакции. Алкилирование по Фриделю — Крафтсу должно быть даже более экзотермичной реакцией, чем нитрование, и первичный изотопный эффект не наблюдался в изученных реакциях алкилирования. Но наличие изотопных эффектов постоянно отмечалось в реакции ацилирования, которая имеет заметно более высокое значение р, чем алкилирование. За исключением описанного выше бромирования сильно пространственно затрудненного 1,3,5-три-трет-бутилбензола [c.487]
Ясно, что в полиенах, бензоле и некоторых других соединениях дело обстоит сложнее, чем в н ирном ряду. Введение той или другой атомной группы даже в место, не примыкающее к рассматриваемой связи, может влиять на ее кратность. Чтобы попять особенности строения этих соеди-][ений, необходимо учитывать как порядок химической связи, так и взаимное влияние непосредственно не связанных атомов. В докладе этот вопрос не анализируется и пе ставится. [c.324]
Особенности строения циклогексана, в сочетании с немногочисленностью и относительной простотой основных продуктов радиолиза, сделали его одним из наиболее изученных объектов радиационно-химических исследований. Основное внимание уделяется установлению связей между элементарными физическими и химическими процессами радиолиза и радиационно-химическими выходами продуктов. Дан обзор накопленных экспериментальных результатов, полученных при облучении циклогексана как без добавок, так и в их присутствии, и указаны возможные пути объяснения этих результатов. Радиолиз чистого жидкого циклогексана, влияние температуры и агрегатного состояния на радиолиз связываются с реакциями электронов и ионов в облученном углеводороде. Радиолиз смесей циклогексана с насыщенными углеводородами, циклогексана при наличии галогенсодержащих молекул, растворов циклогексена и бензола в циклогексане разобраны с точки зрения вероятных элементарных реакций (гл. 4). [c.6]
Однако сопоставление скачков потенциала (АЕ) на границах раствор — ртуть и раствор — воздух в случае ароматических соединений приводит к сильным расхождениям как по величине, так в ряде случаев и по знаку АЕ. Так, например, для орто- и паракрезола АЕ на границе ртуть — раствор соответственно равны —0,20 и —0,29 в, тогда как на границе воздух — раствор они имеют значения +0,01 и +0,26 в. Вначале сдвиг т. н. з. в отрицательную сторону в случае адсорбции на ртути ароматических соединений был связан с более плоской ориентацией молекул на поверхности ртути, при которой облегчается взаимодействие отрицательных атомов полярных групп с металлом. Однако в работах Геровича [40, 41] было показано, что такие соединения, как бензол, нафталин, антрацен, фенантрен и хризен, несмотря на их неполярный характер, также смещают т. п. з. в отрицательную сторону, причем адсорбируемость этих соединений при > О возрастает с увеличением числа бензольных колец в молекуле органического вещества. Эти результаты дали основание предположить, что аномальное поведение ароматических соединений на границе ртуть — раствор связано не только с их более плоской ориентацией, но и с особенностями строения бензольного кольца. [c.186]
Особенности строения бензола обусловливают его специфические химические свойства. Б бензоле до известной степени сочетаются свойства предельных и непредельных углеводородов. Наиболее характерными реакциями для бензола являются реакции замещения. Так, бензол легко реагирует с жидким бромом в присутствии катализатора (железа), образуя бромбензол [c.171]
С этой точки зрения линейные и разветвленные полимеры занимают особое положение. Двухмерные и трехмерные полимеры в силу особенности строения вообще не способны растворяться и могут лишь в некотором количестве растворять, впитывать (набухать) тот или иной растворитель (фенолформальдегидные смолы, иониты, резина, шерсть, роговые ткани и др.). Они лишены текучести. Натуральный же каучук (линейный полимер) хорошо набухает в бензоле до полного растворения, но после вулканизации, когда его молекулы связываются некоторым количеством атомов серы и возникает пространственная сетка, набухание становится ограниченным (резина). Чем больше таких пространственных связей, тем меньше набухание. Наконец, при сильной вулканизации и образовании большого числа прочных поперечных связей способность к набуханию полностью утрачивается (эбонит). [c.253]
Отношение углерода к водороду в бензоле равно 1 1, следовательно, этому углеводороду соответствует формула С Н , и если бы он был аналогичен соединениям жирного ряда, то должен был бы обладать сильно ненасыщенным характером. В де1ктвительности же бензол является очень устойчивым соединением, и хотя при более глубоком его иссле,п,овании выявляются также некоторые свойства, присущие ненасыщенным соединениям, однако эти свойства выражены у него в гораздо более слабой- степени, чем у олефинов или у производных ацетилена. Так, например, бензол вполне устойчив к действию перманганата калия на холоду н не присоединяет мгновенно бром, как присоединяет его этилен. Следовательно, бензол несомненно отличается по характеру от ненасыщенных соединений жирного ряда. Попытаемся объяснить это различие на основании особенностей строения бензола. [c.468]
А. с. почти не вступают в реакции присоединения, стойкие к окислителям, легко замещают атомы водорода, соединенные с ароматическим циклом, на другие атомы или группы. А. с. проявляют высокую энергетическую стойкость по сравнению с ненасыщенными соединениями. Ее характеризуют так называемой энергией сопряжения, равной разности между вычисленной энергией образования гипотетической молекулы с фиксированными связями и экспериментально найденной энергией образования ре-алыюй молекулы. Энергия сопряжения для бензола 40 ккал/моль, нафталина 75 ккал/моль, тиофена 31 ккал/моль и др. А. с. характеризуются некоторыми общими особенностями строения, в частности промежуточным между простым и двойным характером связи в цикле и плоскостным строением цикла. [c.31]
С точки зрения метода МОХ указанные ранее свойства бензола определяются строением его электронной оболочки. Шесть л-электронов бензола размещены на трех связывающих глубоко расположенных МО (рис. 8.3). Повышенная стабильность соединений с п-электронным (ароматическим) секстетом давно была известна химикам, однако именно Э. Хюккель дал ему ясное теоретическое объяснение высокая устойчивость циклических сопряженных полиенов (аннуленов) объясняется особенностями строения их тс-элект-ронной оболочки и присуща лишь тем из них, которые имеют полностью замкнутую электронную оболочку, содержащую максимальное число электронов на связывающих МО и не содержащую электронов на МО других типов. [c.265]
Особенности строения мицелл ПАВ обусловливают специфическое растворение в воде различных органических соединений, обычно нерастворимых в воде без добавок ПАВ. Этот процесс называется солюбилиза цией. Механизм солюбилизации различен для разного типа растворяемых соединений. Он обычно осуществляется по одному из трех способов (рис. 155). Солюбилизация неполярных соединений, например бензола, гексана, объясняется их внедрением в углеводородную часть мицеллы. Соединения, содержащие полярную группу, при солюбилизации располагаются в мицелле так, чтобы их углеводородный хвост находился внутри мицеллы, а полярная группа была обращена наружу. Для со-единений, содержащих несколько поляр- / [c.376]
Для того чтобы дисперсные красители были гидрофобны, они не должны содержать групп анионного характера — 50зН и СООН. Другая особенность строения дисперсных красителей — небольшие размеры молекул красители с большими и жесткими планарными молекулами не могут проникнуть в плотные синтетические и ацетатные волокна. Поэтому дисперсные азокрасители чаще содержат одну и реже — две азогруппы в их состав входят производные бензола, а нафталиновые, обычно, не более одного в состав части дисперсных азокрасителей входят также гетероциклы — пиразол, тиазол и некоторые другие. [c.320]
Бензол и его гомологи намного устойчивее термохимически и значительно менее реакционноспособны, чем можно ожидать от молекул с чередующимися простыми и двойными связями. Вообще говоря, бензол на 36 ккал1моль стабильнее, чем если бы он имел три двойные связи циклогексенового типа энергия резонанса сложных ароматических молекул увеличивается примерно пропорционально числу и-электронов, но в то же время высшие члены ряда обычно более реакционноспособны, что подчеркивает различие между химической и физической точками зрения и указывает на необязательность параллельного изменения инертности и резонансной стабилизации. Со времени развития квантовых методов большая энергия резонанса считается характерным признаком ароматичности, и этот термин следует, несомненно, применять к любому циклическому соединению, обладающему заметной энергией резонанса вследствие циклического строения. Однако более широкая задача установления общих особенностей строения, необходимых для появления ароматического характера, не решается простыми теориями энергетики к-электронов. Например, особый интерес представляет класс до сих пор неизвестных молекул типа пенталена (I) и гепталена (И) (см. раздел 1-4). Эти молекулы содержат чередующиеся простые и двойные связи и, согласно обоим методам ВС и МО, должны обладать большими энергиями резонанса и, следовательно, удовлетворять требованиям ароматичности, однако их не удается синтезировать обычными методами синтеза ароматических молекул, и этот неоспоримый, хотя и отрицательный, факт показывает, что эти молекулы ни в каком случае не являются нормальными ароматическими молекулами. Более тщательное рассмотрение объясняет этот факт и показывает, почему простые теории не могут его отразить. И действи- [c.8]
По своему химическому строению метанол отличается, а циклогексен и бензол (особенно последний) близки к химическому строению элементарного звена полимерной молекулы. В соответствии с этим изменяется и а сополимера, увеличиваясь в ряду СН3ОН СвНю СвНв. [c.92]
Для оценки теплоты сгорания органической массы рассчитаны удельные тепло-энергетические характеристики отдельных представителей ароматических гомологических рядов с разным числом бензольных колец. Удельные теплоты сгорания соединений изменяются в пределах 38,7 - 40,6 МДк/кг, уьЕньшаясь с ростом количества конденсированных колец. Если исключить из рассмотрения бензол, то средняя теплота сгорания ароштических соединений с числом колец два -четыре составит 39,6 МДж/кг, а наибольшее отклонение от средней величины - около 2 %. Молярная энтальпия сгорания на один атом углерода является величиной, отражающей особенности строения углеводородов. Так, для соединений с числом колец, равным двум, на один углерод близка к 518 кДж/моль и не зависит от вида боковых цепей. [c.86]
Строение бензола стало более понятным только при едовании современными методами Так, констатируя равенства С-С связей, рентгеноструктурный анализ, енно, не объясняет относительной химической ости бензола при крайней ненасыщенности, его ано-ной стабильности Особенности строения и свойств овятся понятными только при квантово-химическом едовании бензола [c.381]
Спектры поглощения рассматриваемых соединений имеют большое сходство со спектрами алкильных производных бензола аналогичного строения. Циклизация насыщенных заместителей вызывает появление тонких различий в спектрах, имеющих тот же характер и порядок, что и при удлинении или разветвлении алкильных заместителей. Эти особенности состоят в незначительном смещении спектра вдоль оси длин волн, а также изменении его интенсивности и контура, не меняющих, однако, общего характера всей полосы поглощения. Это наглядно видно из сопоставления спектров псевдокумола, циклогексил-о-ксилола и тре/п.бутил-о-ксилола (рис. II ), а также п-ксилола, 1,4-дициклопентилбензола и 1,4-дициклогексилбензо-ла (рис. III). Закономерности, наблюдающиеся в спектрах поглощения углеводородов рассматриваемых типов, аналогичны закономерностям, имеющим место в спектрах алкилированных бензолов (см. стр. 9 [c.13]
В организме яды могут подвергаться разнообразным превращениям Окислению, восстановлению, соединяться с другими веществами и пр. В результате таких превращений чаще образуются менее токсичные вещества, хотя известны и обратные случаи. Так, монофторацетат не ядовит, но в организме из него образуется фтортрикарбоновая кислота (вероятно, фторлимонная), уже в малых концентрациях токсичная. В литературе имеются попытки связать токсические свойства, или по крайней мере степень токсичности, вещества с его составом и строением [1]. Известно, например, что циклические органические соединения более токсичны, чем органические соединения с открытой цепью, имеющие в своем составе те же группы. Чем выше непредельность органического соединения, тем больше его химическая и биологическая активность ацетилен более. ядовит, чем этилен, а этилен — более, чем этан. Галоидозамещенные углеводородов жирного ряда отличаются более высокой токсичностью, чем углеводороды, из которых они образуются, например галоидопроизводные метана и бензола более токсичны, чем метан или бензол. Степень насыщенности также связана с токсичностью. Однако этих наблюдений недостаточно для выводов о зависимости токсичности соединений от его структуры и их можно рассматривать как ориентировочные. Следует иметь в виду, что токсичность вещества часто зависит от особенностей (строение, структура, функциональная деятельность и т. д.) соединений, находящихся внутри клеток организма, с ко- [c.36]
Особо следует остановиться на адсорбции неполярных соединений, поскольку объяснить ее силами кулоновского взаимодействия нельзя. В работах Геровича [72] было показано, что бензол, нафталин, фенантрен и хризен хорошо адсорбируются на ртутя и смещают несмотря на неполярный характер потенциал нулевого заряда в отрицательную сторону, как и анионоактивные вещества. Причем адсорбируемость этих соединений при ф>0 возрастает с увеличением числа бензольных колец в молекуле органического вещества. Поскольку эти результаты ельзя истолковать, исходя из электростатики, поведение ароматических соединений было объяснено особенностями строения бензольного кольца. [c.134]
Приведенные на рис. 2,6 спектры ароматических сульфидов 5—7 с фенильным кольцом, присоединенным к атому серы, имеют интенсивную сложную полосу поглощения с максимумом в области 250—260 нм. Наличие этой полосы ряд авторов [70] связывает с наложением полосы бензоидного перехода типа Вг и полосы, обусловленной сопряжением серы и я-электронной системы бензола. Установлено, что в алкилфенил-сульфидах очень существенны спектральные эффекты, обусловленные изгибом плоскости молекулы за счет особенностей строения алкильных заместителей и их положения в бензольном кольце [79]. Стерические препятствия сопряжению неподеленной пары электронов атома серы и я-электронов бензольного кольца, возникающие за счет орто-заместите-ля, можно обнаружить в молекуле децил-о-толилсульфида, что проявляется в заметном гипсохромном сдвиге ее максимума поглощения 6 относительно максимума поглощения в спектре пропилпаратолилсульфида 7. Интересно сопоставить спектры поглощения дифенилсульфида 8 и ди- фенилоксида [82]. Характер спектра 8 указывает на наличие значительного сопряжения вдоль всей молекулы, что следует из существенного отличия этого спектра от спектра тиоанизола или фенилпропилсульфи-да 5. С другой стороны, спектр дифенилоксида подобен спектру анизола. Отсюда можно заключить, что в отличие от молекулы дифенилоксида, являющейся некопланарной (фенильные кольца в ней расположены во взаимно перпендикулярных плоскостях [82], молекуле дифенилсульфида [c.191]
Введение заместителей в молекулу циклопентапа увеличивает энергетический барьер между этими двумя формами и в зависимо- сти от особенностей строения того или иного производного стабилизирует конформацию конверта или полукресла. Выбор между альтернативными конформациями для дизамещенных циклопента-нов в ряде случаев можно сделать на основании их дипольных моментов. Так, величина дипольного момента 16-а-бром-5-а-апдро-стан-17-она, измеренная в бензоле, составляет 3,85 D и согласуется с рассчитанной (3,82 В) для конвертоподобной конфигурации цик-лопептанового кольца (I) [108], тогда как вычисления для конформации полукресла приводят к значению моментов - 2 В, [c.135]
Учитывая указанные особенности строения бензола, написание его структурной формулы представляет сложк то задачу. В последнее время для обозначения бензола используют формулы, в рсоторых с помощью стрелок, пунктирных линий или окружности, вписанной в шестиугольник, стремятся показать выравненность электронной плотностн мелоду атомами углерода [c.68]
Итак, истинное строение нитрогруппы или любой другой молекулы не мон ет быть правильно изображено двумя обычными структурными формулами. Это относится и к бензолу. Особенности молекулы бензола не могут быть отображеххы структурной формулой Кекуле — ни левой , ни правой , ни средним арифметическим между ними. [c.130]
В последние 10—15 лет был синтезирован ряд новых термостойких органических полимеров, которые по устойчивости к действию повы-щенных температур значительно превосходят ранее известные полимеры. Характерной особенностью строения таких полимеров является то, что их макромолекулы состоят из ароматических колец (типа бензола, дифенила, нафталина и т. д.), соединенных между собой различными гетероциклами или амидной связью. Многие из синтезированных полимеров оказались волокнообразующими и из них по различным способам формования были получены волокна. В таблице 1.1 приведены основные классы волокнообразующих термостойких полимеров и мономеры, используемые для их синтеза. [c.14]
Физические свойства нитросоединений тесно связаны с особенностями строения нитрогруппы. Семиполярная связь создает значительный дипольный момент. Это ясно видно при сопоставлении дипольных моментов различных производных бензола строения eHs—X. Особенно наглядно сильное возрастание дипольного момента при переходе от нитрозосоединений (обычная двойная связь N = 0) к нитросоединениям (семиполярная связь N+-0-) [c.288]
Высокую реакционную опособностъ дурола в упомянутой реакции Б. В. Суворов с сотрудниками [46] объясняет особенностями строения молекулы, в частности, соседством метильных групп в 1, 2 и 4, 5-положениях. Близость расстояний между боковыми группами обусловливает их внутримолекулярное взаимодействие, в результате чего, в этом, случае, имеет место направление реакции, отсутствующее при окислении производных бензола, имеющих изолированные метильиые группы.. Согласно взглядам Б. В. Суворова, каталитическое окисление дурола в пиромеллитовый диангидрид представляет собой сложный гетерогенно-гомогенный процесс,. протекающий по параллельно-последовательному механизму [47]. Первичными стабильными продуктами реакции признаны соединения типа 4,5-диметилфталана (I, схема 1). Формирование диангидрида может проходить по двум параллельным направлениям через стадии диэфира (III), либо лактона (И) и диме-тилфталевого ангидрида (VI). [c.6]
Так, при окислительном аммонолизе этил-, н-пропил- или изопропилпроизводных бензола и пиридина, когда аминное и альдегидное направления в силу особенностей строения заместителей затруднены, реакция идет почти исключительно через стадии ацетилпроизводных и соответствующих карбоновых кислот, причем кислоты накапливаются в катализатах в значительно больших количествах, а нитрилы образуются с меньшим выходом, чем при окислительном аммонолизе метилбензолов или метилпиридинов в сравнимых условиях [71, 128]. [c.144]
chem21.info












