3. Основные классы неорганических веществ: кислоты, соли, основания, оксиды. Кислоты соли оксиды
Химические свойства основных классов неорганических соединений. Оксиды, кислоты, основания, соли
Кислотные оксиды
- Кислотный оксид + вода = кислота (исключение - SiO2) SO3 + h3O = h3SO4 Cl2O7 + h3O = 2HClO4
- Кислотный оксид + щелочь = соль + вода SO2 + 2NaOH = Na2SO3 + h3O P2O5 + 6KOH = 2K3PO4 + 3h3O
- Кислотный оксид + основный оксид = соль CO2 + BaO = BaCO3 SiO2 + K2O = K2SiO3
Основные оксиды
- Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов) CaO + h3O = Ca(OH)2 Na2O + h3O = 2NaOH
- Основный оксид + кислота = соль + вода CuO + 2HCl = CuCl2 + h3O 3K2O + 2h4PO4 = 2K3PO4 + 3h3O
- Основный оксид + кислотный оксид = соль MgO + CO2 = MgCO3 Na2O + N2O5 = 2NaNO3
Амфотерные оксиды
- Амфотерный оксид + кислота = соль + вода Al2O3 + 6HCl = 2AlCl3 + 3h3O ZnO + h3SO4 = ZnSO4 + h3O
- Амфотерный оксид + щелочь = соль (+ вода) ZnO + 2KOH = K2ZnO2 + h3O (Правильнее: ZnO + 2KOH + h3O = K2[Zn(OH)4]) Al2O3 + 2NaOH = 2NaAlO2 + h3O (Правильнее: Al2O3 + 2NaOH + 3h3O = 2Na[Al(OH)4])
- Амфотерный оксид + кислотный оксид = соль ZnO + CO2 = ZnCO3
- Амфотерный оксид + основный оксид = соль (при сплавлении) ZnO + Na2O = Na2ZnO2 Al2O3 + K2O = 2KAlO2 Cr2O3 + CaO = Ca(CrO2)2
Кислоты
- Кислота + основный оксид = соль + вода 2HNO3 + CuO = Cu(NO3)2 + h3O 3h3SO4 + Fe2O3 = Fe2(SO4)3 + 3h3O
- Кислота + амфотерный оксид = соль + вода 3h3SO4 + Cr2O3 = Cr2(SO4)3 + 3h3O 2HBr + ZnO = ZnBr2 + h3O
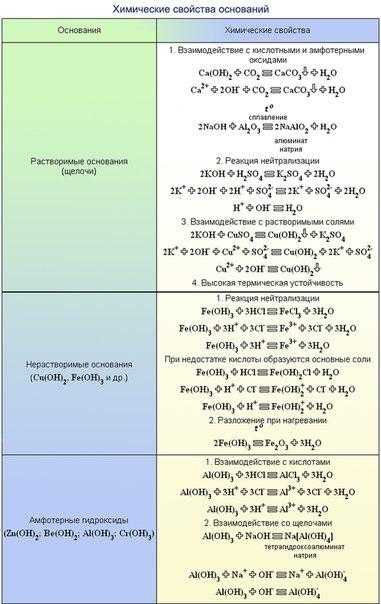
- Кислота + основание = соль + вода h3SiO3 + 2KOH = K2SiO3 + 2h3O 2HBr + Ni(OH)2 = NiBr2 + 2h3O
- Кислота + амфотерный гидроксид = соль + вода 3HCl + Cr(OH)3 = CrCl3 + 3h3O 2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2h3O
- Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты 2HBr + CaCO3 = CaBr2 + h3O + CO2 h3S + K2SiO3 = K2S + h3SiO3
- Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород 2HCl + Zn = ZnCl2 + h3 h3SO4 (разб.) + Fe = FeSO4 + h3 Важно: кислоты-окислители (HNO3, конц. h3SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
- Амфотерный гидроксид + кислота = соль + вода 2Al(OH)3 + 3h3SO4 = Al2(SO4)3 + 6h3O Be(OH)2 + 2HCl = BeCl2 + 2h3O
- Амфотерный гидроксид + щелочь = соль + вода (при сплавлении) Zn(OH)2 + 2NaOH = Na2ZnO2 + 2h3O Al(OH)3 + NaOH = NaAlO2 + 2h3O
- Амфотерный гидроксид + щелочь = соль (в водном растворе) Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] Sn(OH)2 + 2NaOH = Na2[Sn(OH)4] Be(OH)2 + 2NaOH = Na2[Be(OH)4] Al(OH)3 + NaOH = Na[Al(OH)4] Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
- Щелочь + кислотный оксид = соль + вода Ba(OH)2 + N2O5 = Ba(NO3)2 + h3O 2NaOH + CO2 = Na2СO3 + h3O
- Щелочь + кислота = соль + вода 3KOH + h4PO4 = K3PO4 + 3h3O Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2h3O
- Щелочь + амфотерный оксид = соль + вода 2NaOH + ZnO = Na2ZnO2 + h3O (Правильнее: 2NaOH + ZnO + h3O = Na2[Zn(OH)4])
- Щелочь + амфотерный гидроксид = соль (в водном растворе) 2NaOH + Zn(OH)2 = Na2[Zn(OH)4] NaOH + Al(OH)3 = Na[Al(OH)4]
- Щелочь + растворимая соль = нерастворимое основание + соль Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2 3KOH + FeCl3 = Fe(OH)3 + 3KCl
- Щелочь + металл (Al, Zn) + вода = соль + водород 2NaOH + Zn + 2h3O = Na2[Zn(OH)4] + h3 2KOH + 2Al + 6h3O = 2K[Al(OH)4] + 3h3
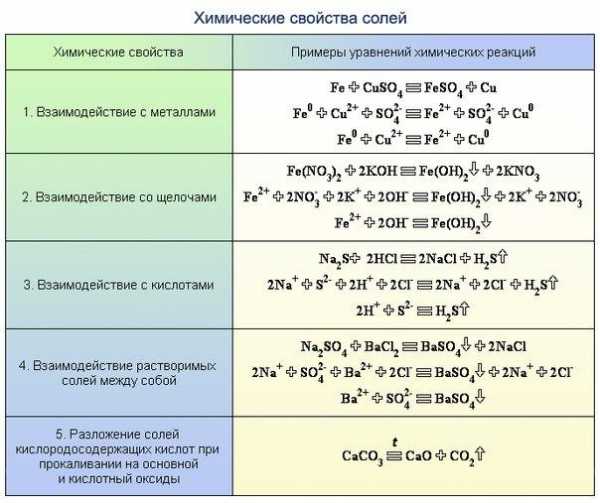
Соли
- Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота Na2SiO3 + 2HNO3 = 2NaNO3 + h3SiO3 BaCO3 + 2HCl = BaCl2 + h3O + CO2 (h3CO3)
- Растворимая соль + растворимая соль = нерастворимая соль + соль Pb(NO3)2 + K2S = PbS + 2KNO3 СaCl2 + Na2CO3 = CaCO3 + 2NaCl
- Растворимая соль + щелочь = соль + нерастворимое основание Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2 2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3
- Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*) Zn + CuSO4 = ZnSO4 + Cu Cu + 2AgNO3 = Cu(NO3)2 + 2Ag Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Возможно, вам также будут интересны другие разделы справочника по химии:
Методы получения основных классов неорганических соединенийНазвания некоторых неорганических кислот и солейwww.repetitor2000.ru
3. Основные классы неорганических веществ: кислоты, соли, основания, оксиды.
КИСЛОТЫ, химические соединения, обычно характеризующиеся диссоциацией в водном растворе с образованием ионов Н+ (точнее — ионов гидроксония Н3О+ ). Присутствие этих ионов обусловливает характерный острый вкус кислот и их способность изменять окраску индикаторов химических. При замещении водорода кислотными металлами образуются соли. Число атомов Н, способных замещаться металлом, называется основностью кислот. Известны одноосновные (HCl), двухосновные (h3SO4), трехосновные (Н3РО4) кислоты. Сильные кислоты в разбавленных водных растворах полностью диссоциированы (HNO3), слабые — лишь в незначительной степени (Н2СО3). По современной теории кислот и оснований, к кислотам относится более широкий круг соединений, в частности и такие, которые не содержат водорода
ОСНОВАНИЯ, химические соединения, обычно характеризующиеся диссоциацией в водном растворе с образованием иона ОН-. Хорошо растворимые в воде основания называются (напр., NaOH) щелочами. Сильные основания полностью диссоциируют в воде, слабые [напр., Mg(OH)2] — частично. По современной теории кислот и оснований к основаниям относится более широкий круг соединений, в частности и такие, которые не образуют ионов ОН- (напр., пиридин).
СОЛИ, продукты замещения атомов водорода кислоты на металл или групп ОН основания на кислотный остаток. При полном замещении образуются средние, или нормальные, соли (NaCl, K2SO4 и др.), при неполном замещении атомов Н — кислые (напр., NaHCO3), неполном замещении групп ОН — основные [напр., (C17h45COO)Al(OH)2].
Различают также двойные соли (напр., KCl.MgCl2) и комплексные. В обычных условиях соли — кристаллы с ионной структурой. Многие соли растворимы в полярных растворителях, особенно в воде; в растворах диссоциируют на катионы и анионы.
Многие минералы — соли, образующие залежи (напр., NaCl, KCl)
Неорганические в-ва:
1)Простые:
А) Ме
Б) неМе
В) инертные газы
2) Сложные:
А) оксиды
Б) основания
В) кислоты
Г) соли
Оксиды - сложные в-ва, состоящие из 2-ух элементов, одним из которых яв-ся кислород:
1)солеобразующие (при взаимодействии с кислотами о основаниями образуют соли):
А) основные (образуют соли при взаимодействии с кислотами или с кислотными оксидами)
Б) кислотные (образуют соли при взаимодействии с основаниями или основными оксидами)
В) амфотерные (образуют соли при взаимодействии и с кислотами и с основаниями)
2)несолеобразующие (при взаимодействии с кислотами и основаниями не образуют соли)
Основания - сложные в-ва, состоящие из атома Ме и одной или нескольких гидроксильных групп:
1)однокислотные(содержат 1 группу ОН): NaOH, KOH;
2)двухкислотные(содержат 2 группы ОН): Ca(OH)2, Ba(OH)2
3)трехкислотные(содержат 3 группы ОН): Fe(OH)3,Cr(OH)3
Основания:
1)растворимые в воде (щелочи): LiOH, NaOH, Ca(OH)2,Ba(OH)2
2)нерастворимые в воде: Cu(OH)2, Fe(OH)2, Fe(OH)3
3) амфотерные (тв в-ва, нерастворимые в воде реагируют с кислотами как основания, а со щелочами как кислоты)
Кислоты - сложнве в-ва, содержащие кислотный остаток и один или несколько атомов водорода, которые могут замещаться атомами Ме:
1)одноосновные (содержат 1 атом H):HCl, HJ
2)двухосновные ( 2 атома Н): h3SO4, h3CO3
3)трех- и более основные (3 и более атомов): h4PO4, h5P2O7
Кислоты:
1)безкислородные HCl, h3C, HCN
2)Кислородсодержащие HNO3, h3SO4, h4PO4
Электрохимический ряд напряжений Ме:
Li, K, Ba, Ca, Na, Mg, Al, Zn, Cr, Fe, Ni, Pl, H, Cu, Ag, Hg, Pt, Au
Соли - сложные в-ва, состоящие из атомов Ме и кислотного остатка:
1)средние (нормальные)NaCl, CaSO4, Al2(SO4)3
2)кислые KHSO4, Ca(h3PO4)2
3)основные Fe(OH)2SO4, CuOHCl, Bi(OH)2NO3
4)двойные KAl(SO4)2, NaKCO3
5) комплексные Na2[Zn(OH)4], K4[Fe(CH)6], [Ag(Nh4)2]Cl
Средние соли образованы при полном замещении атомов водорода в молекуле кислоты атомами Ме или как продукты полного или частичного замещения гидроксогрупп в молекуле основного гидроксида кислотными остатками.
Кислые соли образованы при частичном замещении атомов водорода в молекуле многоосновных кислот кислотными остатками.
Основные соли образованы при частичном замещении гидроксогрупп в молекуле многокислотного гидроксида кислотными остатками.
Двойные соли образованы при замещении атомов водорода в многоосновной кислоте атомами не одного, а двух различных Ме.
studfiles.net
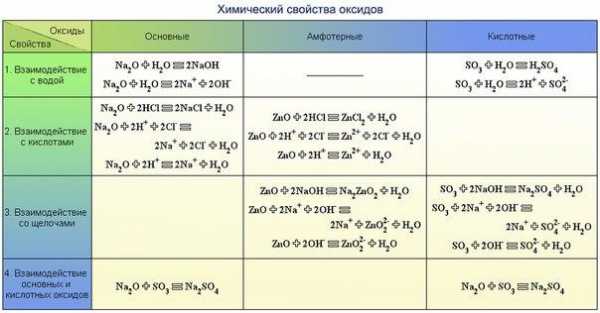
Химические свойства оксидов — урок. Химия, 8–9 класс.
1. Основные оксиды, образованные щелочными и щелочноземельными металлами, взаимодействуют с водой, образуя растворимое в воде основание — щёлочи.
Основный оксид + вода → основание.
Например, при взаимодействии оксида кальция с водой образуется гидроксид кальция:
CaO+h3O→Ca(OH)2.
2. Основные оксиды взаимодействуют с кислотами, образуя соль и воду.
Основный оксид + кислота → соль + вода.
Например, при взаимодействии оксида меди с серной кислотой образуются сульфат меди и вода:
3. Основные оксиды могут взаимодействовать с оксидами, принадлежащими к другим классам, образуя соли.
Основный оксид + кислотный оксид → соль.
Например, при взаимодействии оксида магния с углекислым газом образуется карбонат магния:
MgO+CO2→MgCO3.
Химические свойства кислотных оксидов
1. Кислотные оксиды могут взаимодействовать с водой, образуя кислоты.
Кислотный оксид + вода → кислота.
Например, при взаимодействии оксида серы(\(VI\)) с водой образуется серная кислота:
SO3+h3O→h3SO4.
Обрати внимание!
Оксид кремния SiO2 с водой не реагирует.
2. Кислотные оксиды взаимодействуют со щелочами, образуя соль и воду.
Кислотный оксид + основание → соль + вода.
Например, при взаимодействии оксида серы(\(IV\)) с гидроксидом натрия образуются сульфит натрия и вода:
SO2+2NaOH→Na2SO3+h3O.
3. Кислотные оксиды могут реагировать с основными оксидами, образуя соли.
Кислотный оксид + основный оксид → соль.
Например, при взаимодействии оксида углерода(\(IV\)) с оксидом кальция образуется карбонат кальция:
Химические свойства амфотерных оксидов
1. Амфотерные оксиды при взаимодействии с кислотой или кислотным оксидом проявляют свойства, характерные для основных оксидов. Так же, как основные оксиды, они взаимодействуют с кислотами, образуя соль и воду.
Например, при взаимодействии оксида цинка с соляной кислотой образуется хлорид цинка и вода:
ZnO+2HCl→ZnCl2+h3O.
2. Амфотерные оксиды при взаимодействии со щёлочью или с оксидом щелочного или щелочноземельного металла проявляют кислотные свойства. При сплавлении их со щелочами протекает химическая реакция, в результате которой образуются соль и вода.
Например, при сплавлении оксида цинка с гидроксидом калия образуется цинкат калия и вода:
ZnO+2KOH→K2ZnO2+h3O.
Если же с гидроксидом калия сплавить оксид алюминия, кроме воды образуется алюминат калия: Al2O3+2KOH→2KAlO2+h3O.
www.yaklass.ru
Оксиды кислоты основания соли
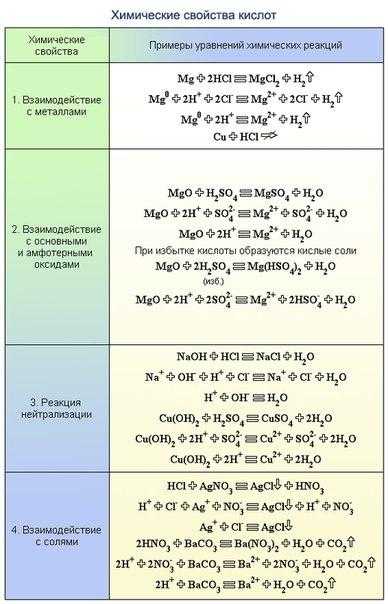
Теория по темам: Оксиды, Кислоты, Основания, Соли ================================ Кислота + основание = соль + вода (Реакция нейтрализации) HCl + NaOH = NaCl + h3O Причем кислоты реагируют как и с растворимыми основаниями (щелочами), так и с нерастворимыми, при условии, что образуется растворимая соль h3SO4 + Cu(OH)2 = CuSO4 + 2h3O Кислота + основный оксид = соль + вода 2HNO3 + CuO = Cu(NO3)2 + h3O (В этом правиле существует исключение: плавиковая кислота реагирует с диоксидом кремния (кислотным оксидом))6HF + SiO2 = h3[SiF6]+2h3O Кислота + металл = соль + водород 2HCl + Zn = ZnCl2 + h3 (газ) На это правило распространяется ограничение: 1) Кислоты реагируют с металлами, стоящими в ряду напряжений металлов до водорода (Исключение составляют концентрированная серная и азотная кислота любой концентрации) 2) При реакции метала с кислотой должна получиться растворимая соль 3) На щелочные металлы правило распространяется частично т.к эта реакция проходит в растворе (щелочные металлы взаимодействуют с водой) Исключения: Cu + 2h3SO4 (конц.) = CuSO4 + SO2 (газ) + 2h3O 4Zn + 5h3SO4 (конц.) = 4ZnSO4 + h3S(газ) + 4h3O 8HNO3 (разб) + 3Cu = 3Cu(NO3)2 + 2NO (газ) + 4h3O Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 (газ) + 2h3O Zn + 4HNO3 (конц.) =(t) Zn(NO3)2 + 2NO2 (газ) + 2h3O 4Zn + 10HNO3 (разб.) =(t) 4Zn(NO3)2 + N2O (газ) + 5h3O 4Zn + 10HNO3 (сильно разб) =(t) 4Zn(NO3)2 + Nh5NO3 + 3h3O 12HNO3 (сильно разб) + 5Fe = 5Fe(NO3)2 + N2 (газ) + 6h3O Кислота + соль = новая кислота + новая соль h3SO4 + BaCl2 = BaSO4 (осадок) + 2HCl Для осуществления этой реакции необходимо, чтобы кислота, получающаяся в итоге, была либо летуча (или нерастворима например кремниевая). Или соль, получающаяся в итоге выпадала в осадок Соль1 + Соль2 = Соль3 + Соль4 Na2CO3 + Ca(NO3)2 = 2NaNO3 + CaCO3 (Следует напомнить, что при составлении таких реакций следует руководствоваться правилом протекания реакций. В данном случае исходные соли должны быть хорошо растворимы, а одна из образующихся должна выпадать в осадок) Основание + кислота = соль + вода (см. выше) Основание + кислотный оксид = соль + вода 2NaOH + CO2 = Na 2CO3 +h3O В эту реакцию вступают только растворимые основания Основание + соль = новое основание + новая соль KOH + CuSO4 = K2SO 4 + Cu(OH)2 (осадок) Правило распространяется только на реакцию с растворимыми основаниями Кислотный оксид + вода = кислота SO3 + h3O = h3SO4 На диоксид кремния (SiO2 ) правило не распространяется т.к. этот оксид водой не гидратируется Кислотный оксид + основный оксид = соль SO2 + Li2O = Li2SO3 Кислотный оксид + основание = соль + вода (см. выше) Основный оксид + вода = основание K2O + h3O = 2KOH Правило распространяется только на те реакции, в результате которых получается растворимое основание (т.е щелочь) Основный оксид + кислота = соль + вода (см. выше) Основный оксид + кислотный оксид = соль (см. выше) Металл + кислота = соль + водород (см. выше) Металл + неметалл = соединение ( соль, оксид, пероксид) 2Na + Cl2 = 2NaCl (соль) 2Mg + O2 = 2MgO (оксид) 2Na + O2 = Na2O2 (пероксид)

studfiles.net
Химические свойства кислотных оксидов | CHEMEGE.RU
Классификация оксидов, способы получения оксидов.
1. Кислотные оксиды взаимодействуют с основными оксидами и основаниями с образованием солей.
При этом действует правило — хотя бы одному из оксидов должен соответствовать сильный гидроксид (кислота или щелочь).
Кислотные оксиды сильных кислот взаимодействуют с любыми основными оксидами и основаниями:
SO3 + CuO = CuSO4
SO3 + Cu(OH)2 = CuSO4 + h3O
SO3 + 2NaOH = Na2SO4 + h3O
SO3 + Na2O = Na2SO4
Кислотные оксиды слабых кислот взаимодействуют только с сильными основаниями (щелочами) и их оксидами. При этом возможно образование кислых и основных солей, в зависимости от соотношения и состава реагентов.
Например, оксид натрия взаимодействует с оксидом углерода (IV), а оксид меди (II), которому соответствует нерастворимое основание Cu(OH)2 — практически не взаимодействует с оксидом углерода (IV):
Na2O + CO2 = Na2CO3
CuO + CO2 ≠
2. Кислотные оксиды взаимодействуют с водой с образованием кислот.
Исключение — оксид кремния, которому соответствует нерастворимая кремниевая кислота. Оксиды, которым соответствуют неустойчивые кислоты, как правило, реагируют с водой обратимо и в очень малой степени.
SO3 + h3O = h3SO4
3. Кислотные оксиды взаимодействуют с амфотерными оксидами и гидроксидами с образованием соли или соли и воды.
Обратите внимание — с амфотерными оксидами и гидроксидами взаимодействуют, как правило, только оксиды сильных или средних кислот!
Например, ангидрид серной кислоты (оксид серы (VI)) взаимодействует с оксидом алюминия и гидроксидом алюминия с образованием соли — сульфата алюминия:
3SO3 + Al2O3 = Al2(SO4)3
3SO3 + 2Al(OH)3 = Al2(SO4)3 + 3h3O
А вот оксид углерода (IV), которому соответствует слабая угольная кислота, с оксидом алюминия и гидроксидом алюминия уже не взаимодействует:
CO2 + Al2O3 ≠
CO2 + Al(OH)3 ≠
(не забудьте повторить классификацию кислот).
4. Кислотные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например, твердый оксид кремния SiO2 вытеснит более летучий углекислый газ из карбоната кальция при сплавлении:
CaCO3 + SiO2 = CaSiO3 + CO2
5. Кислотные оксиды способны проявлять окислительные свойства.
Как правило, оксиды элементов в высшей степени окисления — типичные окислители (SO3, N2O5, CrO3 и др.). Сильные окислительные свойства проявляют и некоторые элементы с промежуточной степенью окисления (NO2 и др.).
6. Восстановительные свойства.
Восстановительные свойства, как правило, проявляют оксиды элементов в промежуточной степени окисления (CO, NO, SO2 и др.). При этом они окисляются, как правило, до высшей степени окисления.
Например, оксид серы (IV) окисляется кислородом до оксида серы (VI):
2SO2 + O2 = 2SO3
Поделиться ссылкой:
chemege.ru
3. Основные классы неорганических веществ: кислоты, соли, основания, оксиды.
КИСЛОТЫ, химические соединения, обычно характеризующиеся диссоциацией в водном растворе с образованием ионов Н+ (точнее — ионов гидроксония Н3О+ ). Присутствие этих ионов обусловливает характерный острый вкус кислот и их способность изменять окраску индикаторов химических. При замещении водорода кислотными металлами образуются соли. Число атомов Н, способных замещаться металлом, называется основностью кислот. Известны одноосновные (HCl), двухосновные (h3SO4), трехосновные (Н3РО4) кислоты. Сильные кислоты в разбавленных водных растворах полностью диссоциированы (HNO3), слабые — лишь в незначительной степени (Н2СО3). По современной теории кислот и оснований, к кислотам относится более широкий круг соединений, в частности и такие, которые не содержат водорода
ОСНОВАНИЯ, химические соединения, обычно характеризующиеся диссоциацией в водном растворе с образованием иона ОН-. Хорошо растворимые в воде основания называются (напр., NaOH) щелочами. Сильные основания полностью диссоциируют в воде, слабые [напр., Mg(OH)2] — частично. По современной теории кислот и оснований к основаниям относится более широкий круг соединений, в частности и такие, которые не образуют ионов ОН- (напр., пиридин).
СОЛИ, продукты замещения атомов водорода кислоты на металл или групп ОН основания на кислотный остаток. При полном замещении образуются средние, или нормальные, соли (NaCl, K2SO4 и др.), при неполном замещении атомов Н — кислые (напр., NaHCO3), неполном замещении групп ОН — основные [напр., (C17h45COO)Al(OH)2].
Различают также двойные соли (напр., KCl.MgCl2) и комплексные. В обычных условиях соли — кристаллы с ионной структурой. Многие соли растворимы в полярных растворителях, особенно в воде; в растворах диссоциируют на катионы и анионы.
Многие минералы — соли, образующие залежи (напр., NaCl, KCl)
Неорганические в-ва:
1)Простые:
А) Ме
Б) неМе
В) инертные газы
2) Сложные:
А) оксиды
Б) основания
В) кислоты
Г) соли
Оксиды - сложные в-ва, состоящие из 2-ух элементов, одним из которых яв-ся кислород:
1)солеобразующие (при взаимодействии с кислотами о основаниями образуют соли):
А) основные (образуют соли при взаимодействии с кислотами или с кислотными оксидами)
Б) кислотные (образуют соли при взаимодействии с основаниями или основными оксидами)
В) амфотерные (образуют соли при взаимодействии и с кислотами и с основаниями)
2)несолеобразующие (при взаимодействии с кислотами и основаниями не образуют соли)
Основания - сложные в-ва, состоящие из атома Ме и одной или нескольких гидроксильных групп:
1)однокислотные(содержат 1 группу ОН): NaOH, KOH;
2)двухкислотные(содержат 2 группы ОН): Ca(OH)2, Ba(OH)2
3)трехкислотные(содержат 3 группы ОН): Fe(OH)3,Cr(OH)3
Основания:
1)растворимые в воде (щелочи): LiOH, NaOH, Ca(OH)2,Ba(OH)2
2)нерастворимые в воде: Cu(OH)2, Fe(OH)2, Fe(OH)3
3) амфотерные (тв в-ва, нерастворимые в воде реагируют с кислотами как основания, а со щелочами как кислоты)
Кислоты - сложнве в-ва, содержащие кислотный остаток и один или несколько атомов водорода, которые могут замещаться атомами Ме:
1)одноосновные (содержат 1 атом H):HCl, HJ
2)двухосновные ( 2 атома Н): h3SO4, h3CO3
3)трех- и более основные (3 и более атомов): h4PO4, h5P2O7
Кислоты:
1)безкислородные HCl, h3C, HCN
2)Кислородсодержащие HNO3, h3SO4, h4PO4
Электрохимический ряд напряжений Ме:
Li, K, Ba, Ca, Na, Mg, Al, Zn, Cr, Fe, Ni, Pl, H, Cu, Ag, Hg, Pt, Au
Соли - сложные в-ва, состоящие из атомов Ме и кислотного остатка:
1)средние (нормальные)NaCl, CaSO4, Al2(SO4)3
2)кислые KHSO4, Ca(h3PO4)2
3)основные Fe(OH)2SO4, CuOHCl, Bi(OH)2NO3
4)двойные KAl(SO4)2, NaKCO3
5) комплексные Na2[Zn(OH)4], K4[Fe(CH)6], [Ag(Nh4)2]Cl
Средние соли образованы при полном замещении атомов водорода в молекуле кислоты атомами Ме или как продукты полного или частичного замещения гидроксогрупп в молекуле основного гидроксида кислотными остатками.
Кислые соли образованы при частичном замещении атомов водорода в молекуле многоосновных кислот кислотными остатками.
Основные соли образованы при частичном замещении гидроксогрупп в молекуле многокислотного гидроксида кислотными остатками.
Двойные соли образованы при замещении атомов водорода в многоосновной кислоте атомами не одного, а двух различных Ме.
studfiles.net
Оксиды. Кислоты. Основания. Амфотерность. Соли
.
1. Оксиды
Оксиды – это сложные вещества, образованные двумя элементами, одним из которых является кислород (O).
Оксиды могут находиться в трех агрегатных состояниях,
а именно: в твердом, жидком и газообразном.
Температура плавления зависит от их строения.
CuO, Fe
O- твердые вещества, немолекулярного строения.Оксиды:
MgO – магния
NiO – никеля
SiO
- кремнияFe
O- железаClO
- хлораCO
- углеродаNO
- азота1.2. Вода
Массовая доля воды в организме человека составляет 65%.
Взрослый человек потребляет ежедневно почти 2 л воды.
Плотность воды наибольшая при 4
градусов – 1 г/см в кубе.При нуле – лёд, а при 100 – водяной пар.
Вода реагирует:
А) с активными металлами, образуя щелочи и водород(H).
2Na + 2H
O = 2NaOH + HИз этой реакции видим, что водород выделился и образовался гидроксид натрия NaOH – щелочь.
Если при добавлении фиолетового лакмуса окраска становится синей – это признак того, что в растворе есть щелочь.
2K + H
O = 2KOH + HCa + 2H
O = Ca(OH) + HБ) с оксидами активных металлов, образуя растворимые основания – щелочи.
CaO + H
O = Ca(OH)Оксиды которым соответствуют основания (независимо от того, реагируют они с водой или нет) называются основными.
Б) еще примеры:
Na
O + HO = 2NaOHBaO + HO = Ba(OH)
В) со многими оксидами неметаллов, образуя кислоты.
P
O + HO = 2HPOа с горячей водой:
P
O + 3HPO = 2HPOCO
+ HO = HCOSO
+ HO = HSOГ) вода разлагается под действие высокой температуры или электрического тока.
2H
O = 2H + OОксиды которым соответствуют кислоты (независимо от того, реагируют они с водой или нет) называются кислотными.
2. Кислоты
В формулах кислот на первом месте всегда стоит водород, а дальше – кислотный остаток. Во время химических реакций он переходит из одного соединения в другое, не изменяясь.
Пример: SO
- кислотный остаток.Его валентность = 2, поскольку в серной кислоте он соединен с двумя атомами водорода, которые способны замещаться атомами цинка (к примеру).
Вывод: валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металла.
Основность кислот – это количество атомов водорода, способных замещаться атомами металла с образованием соли.
Многие кислородосодержащие кислоты можно получить путем взаимодействия кислотных оксидов с водой:
SO
+ HO = HSON
O + HO = 2HNO2.1. Химические свойства кислот
1ое свойство: кислоты действуют на индикаторы.
Вещества, изменяющие свою окраску под действием кислот (или щелочей, называются индикаторами.
Индикаторы: Лакмус, метилоранж, фенолфталеин.
2ое свойство: кислоты реагируют с металлами.
Mg + 2HCl = MgCl
+ HZn + 2HCl = ZnCl
+ HCu + HCl = реакция не происходит!
3е свойство: кислоты реагируют с основными оксидами.
CuO + 2HCl = CuCl
+ HO - - - - Cu (II)Реакции обмена: это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями.
Примечание: Во время взаимодействия азотной кислоты с металлами вместо водорода выделяются другие газы.
2.2. Соляная кислота и хлороводород
Получают хлороводород таким образом:
1) слабое нагревание
NaCl + H
SO = NaHSO + HCl2) сильное нагревание
2NaCl + H
SO = NaSO + 2HClHCl – бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе дымит. При 0 градусов в одном объеме воды растворяется 500 объемов хлороводорода.
Химические свойства соляной кислоты:
1ое свойство: изменяет окраску индикаторов: лакмус в соляной кислоте краснеет, метилоранж – розовеет, фенолфталеин остается бесцветным.
2ое свойство: взаимодействует с металлами:
Mg + 2HCl = MgCl
+ H3е свойство: взаимодействует с основными оксиды:
Fe
O + 6HCl = 2FeCl + 3HOmirznanii.com