Примеры составления ионно-молекулярных уравнений. Примеры ионных уравнений с решением
Составление уравнений реакций ионного обмена — КиберПедия
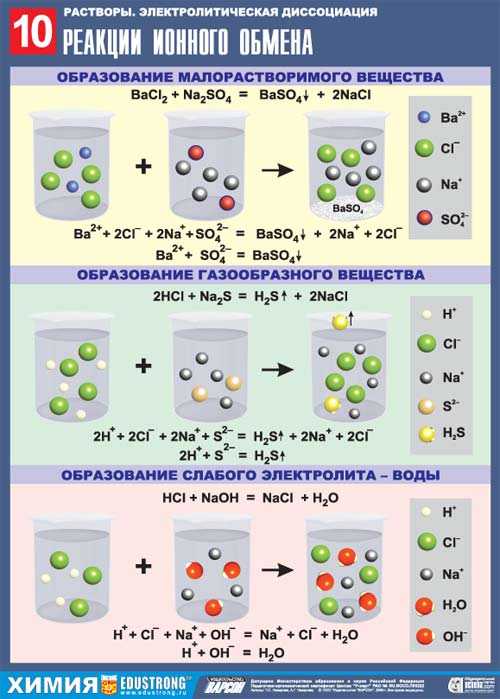
В растворах электролитов направление реакций определяется следующим правилом: ионные реакции протекают в сторону образования малорастворимых веществ, газов, слабых электролитов и комплексных ионов, такие реакции являются практически необратимыми.
Это правило легко объяснимо, т.к. в результате этих реакций один или несколько ионов выводятся из сферы реакции, что, в соответствии с принципом Ла-Шателье, приводит к более полному протеканию химической реакции.
При составлениие ионных реакций обмена, уравнения реакций записывают в 3 строчки:
1) молекулярная форма;
2) полная ионная форма;
3) сокращенно-ионная форма.
В молекулярно-ионных уравнениях растворимые, сильные электролиты пишутся в виде ионов, а слабые электролиты и малорастворимые вещества в виде молекул.
1. Взаимодействие сильных электролитов с образованием осадка:
BaCl2 + h3SO4 = BaSO4 ¯ + 2HCl (молекулярное уравнение)
Ba2++ 2Cl¯ +2H+ + SO42− = BaSO4 ¯+ 2H+ + 2Cl¯ (полное ионное уравнение)
Ba2+ + SO42− = BaSO4 ¯(сокращенное ионное уравнение)
2. Взаимодействие двух сильных электролитов с образованием слабого электролита:
KCN + HCl = KCl + HCN (молекулярное уравнение)
K+ + CN¯ + H+ + Cl¯ = K+ + Cl¯ + HCN (полное ионное уравнение)
CN¯ + H+ = HCN (сокращенное ионное уравнение)
3. Взаимодействие слабого электролита с сильным:
h3S + Pb(NO3)2 = PbS¯ + 2HNO3 (молекулярное уравнение)
h3S + Pb2+ + 2NO3¯ = PbS¯ + 2H+ + 2NO3¯(полное ионное уравнение)
h3S + Pb2+ = PbS¯ + 2H+ (сокращенное ионное уравнение)
4. Взаимодействие осадка с кислотой:
ВaCO3¯+ 2HCl = BaCl2 + h3O + CO2(молекулярное уравнение)
BaCO3¯+2H+ + 2Cl¯ = Ba2+ + 2Cl¯ + h3O +CO2 (полное ионное уравнение)
BaCO3¯ + 2H+ = Ba2+ + h3O + CO2 (сокращенное ионное уравнение)
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. Исходя из значений ПР, укажите наиболее растворимый и наименее растворимый в воде гидроксид:
1) Ni(OH)2; 2) Pb(OH)2; 3) Sn(OH)2; 4) Zn(OH)2; 5) Ca(OH)2.
Решение: Выписываем значения ПР для всех оснований:
Сравнивая значения, видим, что наибольшее значение ПР у Са(ОН)2, значит данный гидроксид наиболее растворим в воде.
Наименьшее значение ПР у Sn(ОН)2, значит данный гидроксид наименее растворим в воде.
Пример 2. Будет ли образовываться осадок СaSO4, если концентрация ионов кальция в растворе – 0,001 моль/л, концентрация сульфат - ионов – 0,003 моль/л.
Решение:
| Дано: | Условие образования осадка: В соответствии с уравнением реакции: Сa2+ + SO42− = CaSO4 c 0,001 моль/л ионами кальция будет реагировать 0,001 моль/л сульфат-ионов: 2,5∙10-5 < 0,001·0,001 2,5∙10-5 < 1·10−6 Осадок будет образовываться. |
Пример 3. Для данных соединений: CoS, CaF2, Ag2S, Ca3(PO4)2 напишите выражение произведения растворимости.
Решение: В насыщенном растворе малорастворимого соединения произведение концентрации его ионов в степени их стехиометрических коэффициентов есть величина постоянная, называемая произведением растворимости – ПР. Составим уравнения диссоциации солей:
СоS ⇄ Co2+ + S2− =>
CaF2 ⇄ Ca2+ + 2F¯ =>
Ag2S ⇄ 2Ag+ + S2− =>
Ca3(P4)2 ⇄ 3Ca2+ + 2PO43− =>
Пример 4. Какая из предложенных реакций обмена идет до конца ?
1) Na2CO3 + 2KCl = 2NaCl + K2CO3
2) MgCO3 + 2HNO3 = Mg(NO3)2 + h3CO3
3) K2CO3 + 2NaOH = 2KOH + Na2CO3
4) Li2CO3 + 2KOH = 2LiOH + K2CO3
5) Na2CO3 + K2SO4 = Na2SO4 + K2CO3
Решение: Реакция протекает необратимо (т.е. до конца), при условии:
- выпадения вещества в осадок,
- образования слабого электролита (слабой кислоты h3S, h3CO3 и т.д., слабого основания - Nh5OH или воды),
- неэлектролита (газа - CO2, SO2 и т.д.)
В продуктах реакции находим нерастворимую соль или основание, воду или слабые электролиты. В данном случае это угольная кислота – h3CO3. Составляем полное ионное и сокращенное ионное уравнения (карбонат магния не растворим в воде):
MgCO3 + 2H+ +2NO3¯ = Mg2+ + 2NO3¯ + СO2 + h3O
MgCO3 + 2H+ = Mg2+ + CO2↑ + h3O
Пример 5. Какое из молекулярных уравнений реакции можно выразить следующим сокращенным ионным уравнением:
Ca2+ + CO32−→ CaCO3 ?
1) Ca3(PO4)2 + 3Na2CO3 = 3CaCO3 + 2Na3PO4
2) Ca3(PO4)2 + 3PbCO3 = 3CaCO3 + Pb3(PO4)2
3) CaSO4 + ZnCO3 = CaCO3 + ZnSO4
4) CaCl2 + CuCO3 = CaCO3 + CuCl2
5) CaCl2 + Na2CO3 = CaCO3 + 2NaCl
Решение: Для получения в растворе ионов Ca2+, необходимо подобрать в исходных веществах растворимую соль кальция. Фосфат и сульфат кальция нерастворимы в воде, поэтому выбираем хлорид кальция. Т.е. варианты ответов № 1,2,3 уже не верные. Для получения в растворе ионов CO32- необходимо подобрать в исходных веществах растворимую соль содержащую карбонат-ионы. Т.к. карбонат меди не растворим, то выбираем карбонат натрия. Правильным ответом является вариант № 5.
Пример 6. Рассчитайте рН 0,1 моль/л раствора NaOH.
Решение: Концентрация ионов OH- в растворе, в соответствии с уравнением диссоциации гидроксида натрия, равна 0,1моль/л:
NaOH → Na+ + OH¯
В соответствии с уравнением:
, концентрация ионов водорода нам не известна.
Из ионного произведения воды найдем концентрацию ионов водорода:
Пример 7. Напишите уравнения диссоциации ортофосфорной кислоты по ступеням и константы диссоциации по каждой ступени.
Решение:
1 ступень диссоциации: h4PO4 ⇄ H+ + h3PO4¯
2 ступень диссоциации: h3PO4¯⇄ H+ + HPO42−
3 ступень диссоциации: HPO42−⇄ H+ + PO43−
Пример 8. Напишите уравнения диссоциации гидроксида меди по ступеням и константы диссоциации по каждой ступени.
Решение:
1 ступень диссоциации: Cu(OH)2 ⇄ CuOH+ + OH¯
2 ступень диссоциации: CuOH+ ⇄ Cu2+ + OH¯
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Написать уравнения ступенчатой диссоциации и выражения констант диссоциации по каждой ступени для ортофосфорной кислоты, гидроксида цинка.
2. Для данных солей CuS, NiS, ZnS, PbS, FeS выписать значения ПР и выбрать наиболее растворимую и наиболее нерастворимую соль.
3. Для данных соединений– PbI2, CaCO3, Ag2SO4 написать выражение произведения растворимости.
4. Концентрация раствора HCl равна 0,01 моль/л, вычислить рН раствора и концентрацию ионов ОН¯.
5. Какие из реакций протекают до конца, для них напишите уравнения реакций в молекулярном и ионном виде:
- хлорид кобальта(II) и гидроксид калия
- хлорид меди(II) и сероводородная кислота
- серная кислота и гидроксид натрия
- сульфат натрия и хлорид никеля(II)
- гидроксид цинка и гидроксид натрия
6. Для данного сокращенно – ионного уравнения подберите 4 молекулярные реакци Zn2+ + S2−= ZnS¯
4 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование:штативы, пробирки, набор реактивов в капельницах и бюксах.
Опыт 1. Ионные реакции обмена с образованием осадков.
а) Налейте в три пробирки по 5-6 капель фосфата натрия и добавьте в первую пробирку - 5-6 капель нитрата кобальта, во вторую - 5-6 капель сульфата никеля, в третью пробирку - 5-6 капель сульфата меди. Составьте уравнения реакций в молекулярном и ионном виде.
б) Исходя из ионного уравнения, составьте молекулярное уравнение и проведите опыт:
Pb2+ + 2I¯ = PbI2¯
Ba2+ + Cr2O72- =BaCr2O7¯
Опыт 2. Ионные реакции обмена с образованием слабого электролита.
а) Положите в пробирку несколько кристаллов ацетата натрия и добавьте разбавленную серную кислоту. Напишите уравнения реакции в молекулярном и ионном виде.
б) Налейте в пробирку несколько капель хлорида аммония и добавьте гидроксид калия, определите выделяющийся газ по запаху (при отсутствии запаха пробирку можно слегка подогреть). Напишите уравнение реакции в молекулярном и ионном виде.
в) Внесите в 2 пробирки по 1 шпателю карбоната кальция и добавьте в первую немного дистиллированной воды, во вторую 5-6 капель соляной кислоты. В какой пробирке происходит растворение осадка? Напишите уравнение реакции в молекулярном и ионном виде.
Опыт 3. Смещение ионного равновесия.
а) Налейте в две пробирки по 6-8 капель гидроксида аммония, добавьте 2 капли фенолфталеина. Затем в одну из пробирок добавьте 1 шпатель хлорида аммония, отметьте изменение интенсивности окраски. Объясните, как смещается равновесие в растворе при добавлении хлорида аммония.
б) Налейте в две пробирки по 6-8 капель уксусной кислоты, добавьте 2 капли метилового оранжевого, в одну из пробирок добавьте 1 шпатель ацетата натрия. Сравните интенсивность окраски в пробирках. Отметьте, как смещается равновесие в растворе при добавлении соли.
Опыт 4. Выпадение осадков малорастворимых веществ в зависимости от их произведения растворимости.
Внесите в две пробирки 5-6 капель сульфата натрия, в первую добавьте 5-6 капель хлорида кальция. Во вторую 5-6 капель хлорида бария. Объясните образование осадков, на основании ПР, образующихся солей. Напишите уравнение реакции в молекулярном и ионном виде.
Лабораторная работа № 6
ГИДРОЛИЗ СОЛЕЙ
Цель работы:составление уравнений гидролиза одной соли, совместного гидролиза двух солей, определение рН раствора. Смещение равновесия при гидролизе солей
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Гидролизом солейназываются обменные химические реакции ионов солей с водой, сопровождающиеся, как правило, изменением рН среды.
Гидролиз солей может протекать тогда, когда в результате взаимодействия ионов соли и воды образуются малодиссоциированные вещества. Сущность гидролиза состоит в том, что катион соли (слабое основание) либо её анион (слабая кислота) связывают соответственно ионы OH¯ или H+ с образованием слабого электролита (соответственно основания или кислоты).
Гидролизу подвергаются соли образованные:
1. слабым основанием и сильной кислотой (гидролиз по катиону),
2. сильным основанием и слабой кислотой (гидролиз по аниону),
3. слабым основанием и слабой кислотой.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
Уравнения реакций гидролиза пишутся аналогично ионным уравнениям: слабые электролиты (в том числе и вода), малорастворимые вещества и газообразные продукты гидролиза пишутся в виде молекул, сильные электролиты записываются в виде ионов. Реакции солей, образованные многоосновными кислотами и многокислотными основаниями пишутся по ступеням, в соответствии с их ступенчатой диссоциацией. Следует помнить, что гидролиз соли по второй и третьей ступени протекает в очень незначительной степени.
Уравнения гидролиза
1) Гидролиз соли, образованной сильным основанием и слабой кислотой.
KCN + h3O ⇄ HCN + KOH молекулярное уравнение
K+ + CN¯ + h3O ⇄ HCN + K+ + OH¯полное ионно-молекулярное уравнение
CN¯ + h3O ⇄HCN + OH¯ сокращенное ионно-молекулярное уравнение
Ступенчатый гидролиз:
I ступень:
K2CO3 + h3O ⇄ KHCO3 + KOH
2K+ + CO32¾ + h3O ⇄ K+ + HCO3¯ + K+ + OH¯
CO32¾ + h3O ⇄ HCO3¯ + OH¯
II ступень:
KHCO3 + h3O ⇄ h3CO3 + KOH
K+ + HCO3¯ + h3O ⇄ h3CO3 + K+ + OH¯
HCO3¯ + h3O ⇄ h3CO3 + OH¯
Соль сильного основания и слабой кислоты гидролизуется с увеличением концентрации гидроксид-ионов в растворе, при этом рН раствора становится больше 7.
2) Гидролиз соли, образованной слабым основанием и сильной кислотой.
Nh5Cl + h3O ⇄ Nh5OH + HCl молекулярное уравнение
Nh5+ + Cl¯ + h3O ⇄ Nh5OH + H+ + Cl¯ полное ионно-молекулярное уравнение
Nh5+ + h3O ⇄ Nh5OH + H+ сокращенное ионно-молекулярное уравнение
Ступенчатый гидролиз:
I ступень:
CuCl2 + h3O ⇄ CuOHCl + HCl
Cu2+ + 2Cl¯ + h3O ⇄ CuOH+ + Cl¯ + H+ + Cl¯
Cu2+ + h3O ⇄ CuOH+ + H+
II ступень:
CuOHCl + h3O ⇄ Cu(OH)2 + HCl
CuOH+ + Cl¯ + h3O ⇄ Cu(OH)2 + H+ + Cl¯
CuOH+ + h3O ⇄ Cu(OH)2 + H+
Соль слабого основания и сильной кислоты гидролизуется с увеличением концентрации ионов водорода в растворе, при этом рН раствора становится меньше 7.
3) Гидролиз соли, образованной слабым основанием и слабой кислотой.
Nh5CN + h3O ⇄ HCN + Nh5OH
В реакции гидролиза участвуют и катион, и анион соли, связывающие соответственно гидроксид-ионы и ионы водорода. Гидролиз протекает практически до конца. Поэтому реакция среды в результате гидролиза определяется относительной силой образующейся слабой кислоты и слабого основания, и часто бывает нейтральной. Для определения реакции среды в данном случае следует сравнить константы диссоциации полученной кислоты и основания. Так, для приведенного примера: Кд (Nh5OH) = 1,8×10-5, Kд (HCN) = 7,1×10-10, циановодородная кислота является более слабым электролитом, поэтому реакция среды будет щелочной.
Если рассмотреть гидролиз ацетата аммония:
Ch4COONh5 + h3O ⇄Ch4COOH + Nh5OH
то реакция среды будет нейтральная, т.к. Кд(Ch4COOH)=1,8×10-5
Kд(Nh5OH) = 1,8×10-5.
4) Гидролиз соли, образованной сильным основанием и сильной кислотой.
Гидролиз соли образованной сильным основанием и сильной кислотой не протекает.
5) Совместный гидролиз двух солей
Гидролиз некоторых солей, образованных очень слабыми кислотами и основаниями является необратимым, например гидролиз сульфидов и карбонатов Al3+, Cr3+, Fe3+.
Al2S3 + 6h3O = 2Al(OH)3 +3h3S
Эти соединения нельзя получить в водном растворе (в таблице растворимости стоит прочерк). При взаимодействии солей этих металлов с растворами сульфидов и карбонатов в осадок выпадают не сульфиды и карбонаты, а гидроксиды алюминия, хрома (III), железа (III).
2AlCl3 + 3Na2S + 6h3O = 2Al(OH)3¯ + 3h3S + 6NaCl
2Al3+ + 6Cl¯+ 6Na+ + 3S2¾ + 6h3O = 2Al(OH)3 ¯+ 3h3S + 6Na+ + 6Cl¯
2Al3+ + 3S2¾ + 6h3O = 2Al(OH)3¯ + 3h3S
Константа гидролиза
С количественной точки зрения гидролиз можно охарактеризовать константой гидролиза.
1) Гидролиз соли образованной сильным основанием и слабой кислотой:
Ch4COO¯ + h3O ⇄ Ch4COOH + OH¯
(константа гидролиза)
но [OH¯] = Kw/[H+] (из ионного произведения воды), тогда
выражение
где Ккисл – константа диссоциации слабой кислоты
Аналогично для других случаев получим:
2) Гидролиз соли образованной слабым основанием и сильной кислотой
(Косн – константа диссоциации слабого основания)
3) Гидролиз соли образованной слабым основанием и слабой кислотой
В соответствии с принципом Ла-Шателье гидролитическое равновесие может смещаться под влиянием различных факторов. Разбавление раствора соли может рассматриваться как увеличение концентрации воды, что приводит к усилению гидролиза.
Повышение температуры влияет на гидролиз главным образом вследствие резкой температурной зависимости степени диссоциации воды. Поэтому при нагревании увеличивается диссоциация воды и следовательно вероятность связывания ионов водорода и гидроксид-ионов в малодиссоциирующее соединение. Гидролиз усиливается.
Чтобы уменьшить гидролиз следует добавить кислоту или основание в зависимости от того, какой гидролиз протекает — по катиону или аниону.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование:штативы, пробирки, спиртовки, держатели, набор реактивов в капельницах и бюксах.
Опыт 1. Определение реакции среды в растворах солей
В первую пробирку внесите 5-6 капель соляной кислоты, во вторую пробирку внесите 5-6 капель воды, в третью пробирку внесите 5-6 гидроксида калия. Во все пробирки добавьте по 1-2 капли тимолового синего. Заполните таблицу 6.1.
Таблица 6.1
Окраска индикатора в зависимости от среды
| Вещество | Среда | рН | Окраска индикатора |
| HCl | |||
| h3O | |||
| KOH |
Внесите в пробирки по 1/2 шпателя солей, указанных в таблице, добавьте к ним 1 мл воды. Внесите во все пробирки 1-2 капли индикатора тимолового синего. По окраске индикатора определите реакцию среды, значение рН определите как, рН>7, pH<7, pH=7. Также значения рН можно определить по окраске универсального индикатора и рН-метром. Заполните таблицу 6.2.
Напишите уравнения гидролиза для каждой соли в молекулярном и ионно-молекулярном виде, укажите тип гидролиза.
Таблица 6.2
Реакция среды в растворах солей
| Формула соли | Окраска индикатора | Реакция среды | рН |
| SnCl2 Li2CO3 NaCl AlCl3 KNO2 Pb(Ch4COO)2 |
Опыт 2. Совместный гидролиз двух солей
Налейте в пробирки по 5-6 капель хлорида алюминия и хлорида хрома, добавьте в пробирки несколько капель карбоната натрия, до выпадения осадка.Напишите уравнения совместного гидролиза в молекулярном и ионно-молекулярном виде.
Опыт 3. Влияние температуры на степень гидролиза
К раствору ацетата натрия добавьте 1 каплю фенолфталеина, отметьте окраску раствора. Нагрейте пробирку с раствором до кипения, как изменится интенсивность окраски? Объясните полученный результат. Пробирку охладите в холодной воде. Что происходит?
Опыт 4. Смещение равновесия реакции гидролиза соли при разбавлении раствора
Налейте в колбу 50 мл дистиллированной воды и внесите 1-2 капли раствора сульфата меди. Через некоторое время наблюдайте появление осадка. Объясните, почему при разбавлении раствора усиливается гидролиз.
Лабораторная работа № 7
cyberpedia.su
| Погода в Ногинске Живой календарь Праздники | 1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты. 2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы. 3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение. 4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение. 5. Помните!  Р - растворимое вещество; Р - растворимое вещество; М - малорастворимое вещество; ТР - таблица растворимости. Алгоритм составления реакций ионного обмена (РИО)в молекулярном, полном и кратком ионном виде  Примеры составления реакций ионного обмена 1. Если в результате реакции выделяется малодиссоциирующее (мд) вещество – вода.  В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением. В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.2. Если в результате реакции выделяется нерастворимое в воде вещество.  В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды. В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.3. Если в результате реакции выделяется газообразное вещество.   ВЫПОЛНИТЕ ЗАДАНИЯ ПО ТЕМЕ "РЕАКЦИИ ИОННОГО ОБМЕНА" Задание №1.Определите, может ли осуществляться взаимодействие между растворами следующих веществ, записать реакциив молекулярном,полном, кратком ионном виде:гидроксид калия и хлорид аммония. Решение- Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР): KOH + Nh5Cl = KCl + Nh5OH так как Nh5OH неустойчивое вещество и разлагается на воду и газ Nh4 уравнение РИО примет окончательный вид KOH (p) + Nh5Cl (p) = KCl (p) + Nh4 ↑+ h3O -Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона): K+ + OH- + Nh5+ + Cl- = K+ + Cl- + Nh4 ↑+ h3O - Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции: OH - + Nh5+ = Nh4 ↑+ h3O- Делаем вывод:Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (Nh4 ↑) и малодиссоциирующее вещество вода (h3O). Задание №2 Дана схема: 2H + + CO32- = h3O + CO2↑Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения. Решение - Используя ТР подбираем реагенты - растворимые в воде вещества, содержащие ионы 2H +и CO32-.Например, кислота - H 3PO4 (p) и соль -K2CO3 (p).- Составляем молекулярное уравнение РИО: 2H 3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3h3CO3 (p)так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO 2 ↑ и воду h3O, уравнение примет окончательный вид:2H 3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3CO2 ↑ + 3h3O- Составляем полное ионное уравнение РИО: 6H + +2PO43- + 6K+ + 3CO32- -> 6K++ 2PO43-+ 3CO2 ↑ + 3h3O-Составляем краткое ионное уравнение РИО: 6H + +3CO32- = 3CO2 ↑ + 3h3OСокращаем коэффициенты на три и получаем: 2H + +CO32- = CO2 ↑ + h3O- Делаем вывод: В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно. Задание №3Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде. 1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР) 3Na 2O (нэ) + 2h4PO4 (р) -> 2Na3PO4 (р) + 3h3O (мд)где нэ - неэлектролит, на ионы не диссоциирует,мд - малодиссоциирующее вещество, на ионы не раскладываем, вода - признак необратимости реакции 2. Составляем полное ионное уравнение: 3Na 2O + 6H+ + 2PO43- -> 6Na+ + 2PO43- + 3h3O3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение: 3Na 2O + 6H+ -> 6Na+ + 3h3OСокращаем коэффициенты на три и получаем:Na2O + 2H+ -> 2Na+ + h3OДанная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ Задание №1 Посмотрите следующий эксперимент Взаимодействие карбоната натрия и серной кислоты Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде. Задание №2Закончите уравнения реакций в молекулярном, полном и кратком ионном виде: ZnF 2 + Ca(OH)2 ->K2S + h4PO4 ->При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях! Задание №3 Посмотрите следующий эксперимент Осаждение сульфата бария Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде. Задание №4 Закончите уравнения реакций в молекулярном, полном и кратком ионном виде: Hg(NO 3)2 + Na2S ->K2SO3 + HCl ->При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!Реакции ионного обмена, идущие с выделением газаРеакции ионного обмена, идущие с образованием ярко-окрашенных солейРеакция нейтрализации ТРЕНАЖЁР "РЕАКЦИИ ИОННОГО ОБМЕНА" ТРЕНАЖЁР "РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ" ПАМЯТКА "НЕОБРАТИМЫЕ РЕАКЦИИ" | Новости сайта Поздравляем победителей и лауреатов Всероссийских дистанционных олимпиад по химии и биологии Полезные ссылки Архив записей |
himiknoginsk.ucoz.ru
Реакции ионного обмена
Написанием ионных уравнений подчеркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами.
С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода:
1. Образующиеся вещества - сильные электролиты, хорошорастворимые в воде и полностью диссоциирующие на ионы.
2. Одно (или несколько) из образующихся веществ - газ, осадок или слабый электролит (хорошо растворимый в воде).
В ионной форме эти уравнения запишутся следующим образом:
В данном случае алюминий не является электролитом, а молекула воды записывается в не диссоциированной форме потому, что является очень слабым электролитом. Неполярные молекулы водорода практически нерастворимы в воде и удаляются из сферы реакции. Одинаковые ионы в обеих частях уравнений можно сократить, и тогда эти уравнения преобразуются в одно сокращенное ионное уравнение взаимодействия алюминия с щелочами:
Очевидно, что при взаимодействии алюминия с любой щелочью реакция будет описываться уравнением. Следовательно, ионное уравнение, в отличие от молекулярного, относится не к одной какой-нибудь реакции между конкретными веществами, а к целой группе аналогичных реакций. В этом его большая практическая ценность и значение, например благодаря этому широко используются качественные реакции на различные ионы.
С учетом вышеизложенного можно сформулировать правило, которым удобно руководствоваться при изучении процессов, протекающих в растворах электролитов.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями , а уравнения этих реакций - ионными уравнениями . Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер.
При составлен ии ио нных уравнений реакций следует руководствоваться тем,что вещества малодиссоциированные , малорастворимые (выпадающиев осадок) и газообразные записываются в молекулярной форме. Знак ↓ , стоящий при формуле вещества,обозначает, что это вещество уходит из сферы реакции в виде осадка, знак ↑ обозначает, что вещество удаляется изсферы реакции в виде газа. Сильные электролиты, как полностью диссоциированные,записывают в виде ионов. Сумма электрических зарядов левой части уравнениядолжна быть равна сумме электрических зарядов правой части.
Для закрепления этих положений рассмотрим два примера.
Пример 1. Напишите уравненияреакций между растворами хлорида железа (III) и гидроксида натрия в молекулярной и ионной формах.
Разобьем решение задачи на четыре этапа.
1. Запишем уравнение реакции в молекулярной форме:
FeCl + 3NaOH = Fe(OH)3 + 3NaCl
2. Перепишем это уравнение, изобразив хорошо диссоциирующие вещества в виде молекул:
FeЗ+ + 3Cl- + 3N а++ 3ОН- = Fе(ОН)3↓ +3N а++ 3Cl-
Это ионное уравнение реакции.
3. Исключим из обеих частей ионного уравнения одинаковые ионы, т.е. ионы, не участвующие в реакции (они подчеркнуты):
Fe3++ 3Cl-+ 3Na-+ 3ОН- = Fе(ОН)3↓ + 3Na++ 3Cl-.
4. Запишем уравнение реакции в окончательном виде:
Fe3++ 3ОН- = Fe(OH)3↓
Это сокращенное ионное уравнение реакции. Как видно из этого уравнения, сущность реакции сводится к взаимодействию ионов Fe3+ и ОН-, в результате чего образуется осадок Fе(ОН)3. При этом вовсе не имеет значения, в состав каких электролитов входили эти ионы до их взаимодействия.
Пример 2. Напишите уравнения реакций между растворами хлорида калия и нитрата натрия.Так как продукты взаимодействия хорошо растворимы в воде и не уходят из сферы реакции, то данная реакция обратима.Как и в примере 1, записываем по этапам:
KCl + NaNO3 = KNO3 + NaCl
K++ Cl-+ Na++ NO-3 = K++ NO-3+ Na++ Cl-
Уравнения для следующих этапов написать нельзя, так как с точки зрения теории электролитической диссоциации реакция не происходит. Однако если выпаривать этот раствор, то будут возникать новые химические связи между ионами и получится смесь четырех солей: КСl, NаNО3, NaСl, КNO 3.
Ионными уравнениями могут быть изображены любые реакции, протекающие в растворах между электролитами. Если при таких реакциях не происходит изменения зарядов ионов (не изменяется степень окисления), то они называются ионообменными.
examchemistry.com
Ионные уравнения реакций | Kursak.NET
Тема: Ионные уравнения реакций
План лекции:
- Решение ионных уравнений.
В растворах электролитов реакции происходят между гидратированными ионами, поэтому их называют ионными реакциями. В направлении их важное значение имеют природа и прочность химической связи в продуктах реакции. Обычно обмен в растворах электролитов приводит к образованию соединения с более прочной химической связью. Так, при взаимодействии растворов солей хлорида бария ВаСl2 и сульфата калия K2SO4 в смеси окажутся четыре вида гидратированных ионов Ва2+(Н2О)n, Сl- (h3O)m, K+(h3O)p, SO2-4(h3O)q, между которыми произойдет реакция по уравнению:
BaCl2+K2SO4=BaSO4+2КСl
Сульфат бария выпадет в виде осадка, в кристаллах которого химическая связь между ионами Ва 2+ и SO2-4 более прочная, чем связь с гидратирующими их молекулами воды. Связь же ионов К+ и Сl- лишь незначительно превышает сумму энергий их гидратации, поэтому столкновение этих ионов не приведет к образованию осадка.
Следовательно, можно сделать следующий вывод. Реакции обмена происходят при взаимодействии таких ионов, энергия связи между которыми в продукте реакции намного больше, чем сумма энергий их гидратации.
Реакции ионного обмена описываются ионными уравнения-ми. Труднорастворимые, летучие и малодиссоциированные соеди-нения пишут в молекулярной форме. Если при взаимодействии растворов электролитов не образуется ни одного из указанных видов соединения, это означает, что практически реакции не протекают.
Образование труднорастворимых соединений
Например, взаимодействие между карбонатом натрия и хлоридом бария в виде молекулярного уравнения запишется так:
Na2CO3+ ВаСl2 = BaCO3+2NaCl или в виде:
2Na++СO2-3+Ва2+ +2Сl- = BaCO3+ 2Na++2Сl -
Прореагировали только ионы Ва2+ и СО-2, состояние остальных ионов не изменилось, поэтому краткое ионное уравнение примет вид:
CO 2-3+Ba 2+ =BaCO3
Образование летучих веществ
Молекулярное уравнение взаимодействия карбоната кальция и соляной кислоты запишется так:
СаСO3+2НСl=СаСl2+Н2О+CO2
Один из продуктов реакции — диоксид углерода СО2 — выделился из сферы реакции в виде газа. Развернутое ионное уравнение имеет вид:
СаСО3+2Н++2Сl - = Са 2+ +2Сl -+Н2O+CO2
Результат реакции описывается следующим кратким ионным уравнением:
СаСO3+2Н+=Са 2+ +Н2О+CO2
Образование малодиссоцированного соединения
Примером такой реакции служит любая реакция нейтрализации, в результате чего образуется вода — малодиссоциированное соединение:
NaOH+НСl=NaCl+Н2О
Na++ОН-+Н++Cl- = Na++Сl -+Н2О
ОН-+Н+= Н2O
Из краткого ионного уравнения следует, что процесс выразился во взаимодействии ионов Н+ и ОН-.
Все три вида реакций идут необратимо, до конца.
Если слить растворы, например, хлорида натрия и нитрата кальция, то, как показывает ионное уравнение, никакой реакции не произойдет, так как не образуется ни осадка, ни газа, ни малодиссоциирующего соединения:
Na++Сl-+К++NO-3 + Na+ + NO-3+К+ + Сl-
Пример 1. Составьте молекулярное и ионное уравнение реакции взаимодействия нитрата серебра с хлоридом калия.
Решение:
Составим молекулярное уравнение реакции:
AgNO3+KCl = AgCl + KNO3
По таблице растворимости устанавливаем, что AgNO3, КСl, KNO3 — растворимые соединения, AgCl — нерастворимое вещество.
Составляем ионное уравнение реакции с учетом растворимости соединений:
Ag+ + NO-3 + K+ + Сl- = AgCl + К+ + NO-3
Исключаем из правой и левой частей уравнения одинаковые ионы и получим краткое ионное уравнение:
Ag+ + Cl- = AgCl
Краткое ионное уравнение раскрывает сущность происходящего химического превращения. Видно, что фактически приняли участие в реакции лишь ионы Ag+ и Сl-. Остальные ионы остались без изменения.
Пример 2. Составьте молекулярное и ионное уравнение реакции между: а) хлоридом железа (III) и гидроксидом калия; б) сульфатом калия и иодидом цинка.
Решение:
а) Составляем молекулярное уравнение реакции между FeCl3 и КОН:
FeCl3+3KOH =Fe (OH)3 + 3KCl
По таблице растворимости устанавливаем, что из полученных соединений нерастворим только гидроксид железа Fe(OH)3. Составляем ионное уравнение реакции:
Fe 3+ +3Cl -+3K+ +3OH- =Fe (OH)3+ 3K++3Сl-
В ионном уравнении показано, что коэффициенты 3, стоящие в молекулярном уравнении, в равной степени относятся к ионам. Это общее правило составления ионных уравнений. Изобразим уравнение реакции в краткой ионной форме:
Fe 3+ +3OH- = Fe(OH)3
Это уравнение показывает, что в реакции принимали участие лишь ионы Fe3+ и ОН-.
б) Составим молекулярное уравнение для второй реакции:
K2SO4+ZnI2 = 2KI+ZnSO4
Из таблицы растворимости следует, что исходные и полученные соединения растворимы, поэтому реакция обратима, не доходит до конца. Действительно, здесь не образуется ни осадка, ни газообразного соединения, ни малодиссоциированного соединения. Составим полное ионное уравнение реакции:
2К++SO2-4+Zn2+ +2I- + 2К+ + 2I- +Zn 2+ +SO2-4
Пример 3. По ионному уравнению: Cu2+ +S2- -= CuS составить молекулярное уравнение реакции.
Решение:
Ионное уравнение показывает, что в левой части уравнения Должны быть молекулы соединений, имеющих в своем составе ионы Cu 2+ и S2-. Эти вещества должны быть растворимы в воде.
По таблице растворимости выберем два растворимых соединения, в состав которых входят катион Cu2+ и анион S2-. Составим молекулярное уравнение реакции между данными соединениями:
CuSO4+Na2S CuS+Na2SO4
kursak.net
Реакции ионного обмена » HimEge.ru
В разбавленных растворах электролитов (кислот, оснований, солей) химические реакции протекают обычно при участии ионов. При этом все элементы реагентов могут сохранять свои степени окисления (обменные реакции) или изменять их (окислительно – восстановительных реакции).В соответствии с правилом Бертолле, ионные реакции протекают практически необратимо, если образуются твердые малорастворимые вещества (они выпадают в осадок), легколетучие вещества (они выделяются в воде газов) или растворимые вещества — слабые электролиты (в том числе и вода). Ионные реакции изображаются системой уравнений – молекулярным, полным и кратким ионным. Ниже полные ионные уравнения опущены.При написании уравнений ионных реакций надо обязательно руководствоваться таблицей растворимости. Примеры реакций с выпадением осадков:a) Ba(OH)2 + h3SO4 = BaSO4↓ + 2h3OBa2+ + SO42- = BaSO4↓б) AgNO3 + KI = AgI↓ + KNO3Ag+ + I— = AgI↓в) MgCl2 + 2KOH = Mg(OH)2↓ + 2KCl Mg2+ + 2OH— = Mg(OH)2↓г) 3Zn(Ch4COO)2 + 2Na3PO4 = Zn3(PO4)2↓ + 6Na(Ch4COO)3Zn2+ + 2PO43- = Zn3(PO4)2↓Обратите внимание, AgCO3, BaCO3 и CaCO3 ПРАКТИЧЕСКИ НЕРАСТВОРИМЫЕ В ВОДЕ И ВЫПАДАЮТ В ОСАДОК КАК ТАКОВЫЕ, НАПРИМЕР:Ba(NO3)2 + K2CO3 = BaCO3↓ + 2KNO3Ba2+ + CO32- = BaCO3↓ Соли остальных катионов, такие как MgCO3, CuCO3, FeCO3, ZnCO3 и другие, хотя и нерастворимые в воде, но не осаждаются из водного раствора при проведении ионных реакций (т.е. их нельзя получить этим способом).Например карбонат железа (II) FeCO3, полученный «сухим путем» или взятый в виде минерала сидерит, при внесении в воду осаждается без видимого взаимодействия. Однако при попытке его получения по обменной реакции в растворе между FeSO4 и K2CO3 выпадает осадок основной соли (приведен условный состав, на практике состав более сложный) и выделяется углекислый газ:2FeSO4 + h3O + 2Na2CO3 = 2Na2SO4 + Fe2CO3(OH)2↓ + CO2↑2Fe2+ + h3O + 2CO32- = Fe2CO3(OH)2↓ + CO2↑Аналогично FeCO3, сульфид хрома (3) Cr2S3 (нерастворимый в воде) не осаждается из раствора:
2CrCl3 + 6h3O + 3Na2S = 6NaCl + 2Cr(OH)3↓ + 3h3S↑2Cr3+ + 6h3O + 3S2- = 2Cr(OH)3↓ + 3h3S↑Некоторые соли разлагаются водой – сульфид алюминия Al2S3 (а также BeS) и ацетат хрома(III) Cr(Ch4COO)3:а) Al2S3 + 6h3O = 2Al(OH)3↓ + 3h3S↑б) Cr(Ch4COO)3 + 2h3O= Cr(Ch4COO)(OH)2↓ + 2Ch4COOHСледовательно, эти соли нельзя получить по обменной реакции в растворе:а) 2AlCl3 + 6h3O +3K2S = 6KCl + 2Al(OH)3↓ +3h3S↑2Al3+ + 6h3O + 3S2- = 2Al(OH)3↓ + 3h3S↑б) CrCl3 + 2h3O + 3Na(Ch4COO) =3NaCl + Cr(Ch4COO)(OH)2↓ + 2Ch4COOHCr3+ + 2h3O + 3Ch4COO— =Cr(Ch4COO)(OH)2↓ + Ch4COOH
Примеры реакций с выделением газа:а) BaS + 2HCl = BaCl2 + h3S↑S2- + 2H+ = h3S↑б) Na2CO3 + h3SO4 = Na2SO4 + CO2↑ + h3OCO32- + 2H+ = CO2↑+ h3Oв) CaCO3(T) + 2HNO3 = Ca(NO3)2 + CO2↑ + h3OCaCO3(T) + 2H+ = Ca2+ + CO2↑ + h3O Примеры реакций с образованием слабых электролитов:а) 3NaOH + h4PO4 = Na3PO4 + 3h3O3OH— + h4PO4 = PO43- + 3h3Oб) Mg(Ch4COO)2 + h3SO4 = MgSO4 + 2Ch4COOHCh4COO— + H+ = Ch4COOHв) Nh5F + HBr = Nh5Br + HFF— + H+ = HFЕсли реагенты и продукты обменной реакции не являются сильными электролитам, ионный вид уравнения отсутствует, например:Mg(OH)2(T) + 2HF = MgF2↓ + 2h3O
himege.ru
Примеры составления ионно-молекулярных уравнений
Пример 1. Написать ионно-молекулярное уравнение реакции:
Fe(OH)2 + h3SO4 FeSO4 +2h3O
Fe(OH)2 – практически нерастворимое соединение (см. таблицу растворимости), а потому записывается в недиссоциированной (молекулярной) форме: Fe(OH)2.
h3SO4 – хорошо растворимое соединение, являющееся одновременно сильным электролитом (см. список кислот – сильных электролитов, приведён выше), а потому записывается в диссоциированной форме: 2H+ + SO42-.
FeSO4 – хорошо растворимое соединение (см. таблицу растворимости), являющееся одновременно сильным электролитом (т. к. является солью), а потому записывается в диссоциированной форме: Fe2+ + SO42-.
Вода h3O является слабым электролитом, а потому записывается в недиссоциированной форме: 2h3O.
Итого ионно-молекулярное уравнение записывается следующим образом:
Fe(OH)2 + 2H+ + SO42- Fe2+ + SO42- + 2h3O
или, после сокращения одинаковых частиц в левой и правой частях уравнения (SO42-),
Fe(OH)2 + 2H+ Fe2+ + 2h3O.
Пример 2. Написать ионно-молекулярное уравнение реакции:
FeCl3 + 3Nh5OH Fe(OH)3↓+ 3Nh5Cl
FeCl3 – хорошо растворимое соединение, являющееся одновременно сильным электролитом (поскольку является солью), а потому записывается в диссоциированной форме: Fe3+ + 3Cl-.
Nh5OH – также растворимое соединение, однако являющееся слабым электролитом (не входит в список сильных оснований, см. выше), а потому записывается в молекулярной форме: 3Nh5OH.
Fe(OH)3 – практически нерастворимое соединение и, следовательно, записывается в молекулярной форме: Fe(OH)3.
Nh5Cl – хорошо растворимое соединение, являющееся одновременно сильным электролитом (т. к. является солью), а потому записывается в диссоциированной форме: 3Nh5+ + 3Cl-.
Итого ионно-молекулярное уравнение записывается следующим образом:
Fe3+ + 3Cl- + 3Nh5OH Fe(OH)3↓ + 3Nh5+ + 3Cl-
или, после сокращения одинаковых ионов (Cl-),
Fe3+ + 3Nh5OH Fe(OH)3↓ + 3Nh5+.
Пример 3. Написать ионно-молекулярное уравнение реакции:
KI + AgI K[AgI2].
KI – хорошо растворимое соединение, являющееся одновременно сильным электролитом (т. к. является солью), а потому записывается в диссоциированной форме: K+ + I-.
AgI – практически нерастворимое соединение, а потому записывается в недиссоциированной (молекулярной) форме: AgI.
K[AgI2] – комплексное соединение, о чём свидетельствует наличие квадратных скобок в формуле соединения. Само соединение является солью, хорошо растворимой в воде (знак осадка не помечен), а потому оно должно диссоциировать на ионы K+ и [AgI2]-. При этом образующийся ион [AgI2]- является комплексным (устойчивым), т. е. практически не подвергается дальнейшей диссоциации. Таким образом, соединение записывается в виде: K+ + [AgI2] -.
Итого ионно-молекулярное уравнение записывается следующим образом:
K+ + I- + AgI = K+ + [AgI2] -
или, после сокращения одинаковых частиц в левой и правой частях уравнения (K+),
AgI + I- [AgI2]-.
Выполнение работы
Опыт 1. Образование малорастворимых оснований. В одну пробирку налить 3−5 капель раствора соли железа (III), в другую – столько же раствора соли меди (II), в третью – раствора соли никеля (II). В каждую пробирку добавить по несколько капель раствора щелочи до выпадения осадков. Осадки сохранить до следующего опыта.
К какому классу относятся полученные осадки гидроксидов металлов? Являются ли эти гидроксиды сильными основаниями?
Опыт 2. Растворение малорастворимых оснований. К полученным в предыдущем опыте осадкам добавить по несколько капель раствора соляной кислоты концентрацией 15 % до их полного растворения.
Какое новое малодиссоциированное соединение образуется при растворении оснований в кислоте?
Опыт 3. Образование малорастворимых солей.
A. В две пробирки налить по 3−5 капель раствора нитрата свинца (II) и прибавить в одну пробирку несколько капель йодида калия, в другую – хлорида бария.
Что наблюдается в каждой пробирке?
Б. В одну пробирку налить 3−5 капель раствора сульфата натрия, в другую – столько же раствора сульфата хрома (III). В каждую пробирку добавить несколько капель раствора хлорида бария до выпадения осадков.
Какое вещество образуется в качестве осадка? Будет ли протекать аналогичная реакция хлорида бария, например, с сульфатом железа (III)?
Опыт 4. Изучение свойств амфотерных гидроксидов.
А. В две пробирки внести по 3 капли раствора соли цинка и несколько капельразбавленногораствора едкого натра (из штатива с реактивами) до образования осадка гидроксида цинка. Растворить полученные осадки: в одной пробирке – в растворе соляной кислоты, в другой – в избыткеконцентрированногораствора едкого натра (из вытяжного шкафа).
Б. В две пробирки внести по 3 капли раствора соли алюминия и несколько капель разбавленногораствора едкого натра (из штатива с реактивами) до образования осадка гидроксида алюминия. Растворить полученные осадки: в одной пробирке – в растворе соляной кислоты, в другой – в избыткеконцентрированногораствора едкого натра (из вытяжного шкафа).
В. В две пробирки внести по 3 капли раствора соли хрома (III) и несколько капельразбавленногораствора едкого натра (из штатива с реактивами) до образования осадка гидроксида хрома (III). Растворить полученные осадки: в одной пробирке – в растворе соляной кислоты, в другой – в избыткеконцентрированногораствора едкого натра (из вытяжного шкафа).
Опыт 5. Образование малодиссоциированных соединений. В пробирку внести 3−5 капель раствора хлорида аммония и добавить несколько капель раствора едкого натра. Обратите внимание на запах, объясните его появление на основе уравнения реакции.
Опыт 6. Образование комплексов. В пробирку налить 3−5 капель раствора сульфата меди (II), затем по каплям добавить разбавленный(из штатива с реактивами!) раствор аммиака до образования осадка сульфата гидроксомеди (II) согласно реакции:
2CuSO4 + 2Nh5OH = (CuOH)2SO4↓ + (Nh5)2SO4
Добавить к осадку избыток концентрированногораствора аммиака (из вытяжного шкафа!). Обратить внимание на растворение осадка согласно реакции:
(CuOH)2SO4 + (Nh5)2SO4 + 6Nh5OH = 2[Cu(Nh4)4]SO4 + 8h3O
Какую окраску имеет образующийся растворимый амминокомплекс меди?
Опыт 7. Образование газов.
A. Налить в пробирку 3−5 капель раствора карбоната натрия и несколько капель серной кислоты. Что наблюдается?
Б. Налить в пробирку 3−5 капель раствора сульфида натрия и 1 каплю серной кислоты. Обратить внимание на запах выделяющегося газа.
studfiles.net
Внеклассный урок - Примеры составления уравнений реакции ионного обмена
Примеры составления уравнений реакции ионного обмена
НЕОБРАТИМЫЕ РЕАКЦИИ
Реакции с образованием малорастворимых веществ (осадков).
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами хлорида железа(III) и гидроксида натрия.
1. Запишем молекулярное уравнение и подберем коэффициенты:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
2. Найдем вещество, которое вызывает протекание реакции. Это Fe(OH)3. Ставим знак осадка ↓:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
3. Укажем силу основания и растворимость солей:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
растворимая сильное осадок растворимая
соль основание соль
4. Запишем полное ионно-молекулярное уравнение (в виде ионов представляем растворимые соли и сильное основание):
Fe3+ + 3Cl – + 3Na+ + 3OH – = Fe(OH)3↓ + 3Na+ + 3Cl –
5. Подчеркнем формулы, не участвующие в реакции (это формулы одинаковых ионов в обеих частях уравнения):
Fe3+ + 3Cl – + 3Na+ + 3OH – = Fe(OH)3↓ + 3Na+ + 3Cl –
6. Исключим подчеркнутые формулы и получим сокращенное ионно-молекулярное уравнение:
Fe3+ + 3OH – = Fe(OH)3↓
Сокращенное ионно-молекулярное показывает, что сущность реакции сводится к взаимодействию ионов Fe3+ и OH –, в результате чего образуется осадок гидроксида железа(III) Fe(OH)3.
Реакции с образованием слабодиссоциирующих веществ (слабых электролитов).
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами азотной кислоты и гидроксида калия.
Молекулярное уравнение:
HNO3 + KOH = KNO3 + h3O
сильная сильное растворимая слабый
кислота основание соль электролит
Полное молекулярно-ионное уравнение:
H+ + NO3– + K+ + OH – = K+ NO3– + h3O
Сокращенное ионно-молекулярное уравнение:
H+ + OH – = h3O
Реакции с образованием газообразных веществ.
Составим молекулярное и ионно-молекулярные уравнения реакции между растворами сульфида натрия и серной кислоты.
Молекулярное уравнение:
Na2S + h3SO4 = Na2SO4 + h3S↑
растворимая сильная растворимая газ
соль кислота соль
Полное молекулярно-ионное уравнение:
2Na+ + S2– + 2H+ + SO42– = 2Na+ + SO42– + h3S↑
Сокращенное ионно-молекулярное уравнение:
2H+ + S2– = h3S↑
ОБРАТИМЫЕ РЕАКЦИИ
Разберем процессы, протекающие при сливании растворов нитрата калия и хлорида натрия.
Молекулярное уравнение:
KNO3 + NaCl = KCl + NaNO3
растворимая растворимая растворимая растворимая
соль соль соль соль
Полное молекулярно-ионное уравнение:
K+ + NO3– + Na+ + Cl – ⇄ K+ + Cl – + Na+ + NO3–
В данном случае сокращенное ионно-молекулярное уравнение написать нельзя: согласно теории электролитической диссоциации, реакция не протекает. Если такой раствор выпарить, то получим смесь четырех солей: KNO3, NaCl, KCl, NaNO3.
raal100.narod.ru