Вычисление молярной массы эквивалента, молярной и относительной атомной массы одновалентного металла. Равна молярная масса эквивалента металла равна
Определение молярной массы эквивалента металла — Мегаобучалка
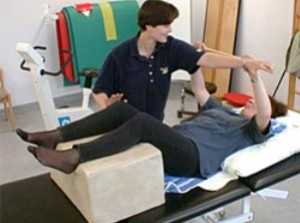
Для экспериментального определения молярной массы эквивалента металла используют прибор, состоящий из бюретки, соединенной с воронкой резиновой трубкой. Через систему пробок и трубок к бюретке присоединяют пробирку. Система укрепляется на штативе и заливается подкрашенной водой. Следует помнить, что водород - очень летучий газ. Поэтому необходимо проверить герметичность установки, для чего при закрытых пробках и присоединенной пробирке надо опустить кольцо с воронкой. Если прибор герметичен, то уровень воды в бюретке, немного понизившись, останется постоянным. Если уровни жидкости в бюретке и воронке, как в сообщающихся сосудах, выравниваются, то герметичность нарушена, и следует обратиться к преподавателю. В пробирку налейте 3-4 мл раствора серной кислоты (разбавление 1:4). Полоской фильтровальной бумаги снимите со стенок пробирки капли кислоты. Удерживая пробирку наклонно (следить, чтобы не выливалась кислота), поместите на сухую стенку пробирки кусочек металла, взвешенный с точностью до 0,0001 г. (Необходимо следить, чтобы металл не соприкасался с кислотой). Присоедините пробирку к прибору, удерживая ее в наклонном положении. Отметьте уровень воды в бюретке /V1 с точностью до 0,1 мл. Придерживая пробирку, стряхните металл в раствор кислоты.
Выделяющийся водород будет собираться в бюретке. При этом вода из бюретки будет собираться в воронке. По окончании реакции дайте системе остыть и опустите кольцо с воронкой до нового уровня жидкости. Отметьте новый уровень жидкости V2. Разность уровней жидкости в бюретке после опыта и до опыта равна объему выделившегося водорода.
Vh3 = V2 - V1.
Отметьте условия проведения опыта: давление (р) и температуру (Т).
По табл. 2.1 определите давление насыщенного водяного пара (h) при температуре проведения опыта. Экспериментальные данные внесите в табл. 2.2.
Таблица 1
Давление насыщенного пара /h/, мм. рт. ст.
| T°С | h, мм рт.ст. | h, мм рт.ст. | |
| 13,63 | 18,65 | ||
| 14,43 | 19,83 | ||
| 15,48 | 21,07 | ||
| 16,48 | 22,38 | ||
| 17,54 | 23,76 |
Таблица 2
Экспериментальные наблюдения.
| Масса Метал-ла m, г | р, мм рт.ст. | t, °C | Влажность h, мм рт.ст. | Уровень жидкости до опыта V1, мл | Уровень жидкости после опыта V, мл | Объем выделившегося водорода Vh3, мл |
Для определения молярной массы эквивалента металла следует привести полученный объем водорода Vh3 к нормальным условиям Vh3°, используя уравнение объединенного газового закона:
p° Vh3°/T° = (p – h) Vh3.
Отсюда находят
Vh3° = (p – h) Vh3 T°/ p°T
И наконец, используя закон эквивалентов, получают:
ЭМ = m ×11200 / Vh3°.
Вычислите атомную массу металла, если валентность его равна 2.
Определите по таблице Д.И.Менделеева металл.
Вычислите теоретическое значение молярной массы эквивалента металла.
w,% = ôЭт - Ээô/ Эт,
где Эт – рассчитанная эквивалента металла;
Ээ - экспериментальная молярная масса эквивалента металла.
Типовые задачи
1.Докажите амфотерные свойства оксида хрома(III) и гидроксида цинка, приведите уравнения соответствующих реакций.
2.Приведите формулы всех солей, которые могут образоваться при взаимодействии гидроксида алюминия и соляной кислоты.
3.Составьте формулы сульфата алюминия, дигидрофосфата кальция, гидроксокарбоната меди(II). Приведите их графические формулы.
4.Вычислите эквиваленты и молярные массы эквивалентов Ag2O, CaHPO4, (CuOH)2CO3, h4BO3.
5.Составьте формулы оксидов и гидроксидов следующих элементов:
S+6, K+, Mn+7, Sn+2, P+5, Si+4. Определите, какие из них обладают основными, кислотными или амфотерными свойствами. Ответ аргументируйте уравнениями соответствующих реакций.
6.Составьте формулы оксидов, соответствующие следующим гидроксидам: Mn(OH)4, NaOH, h4PO4, HPO3. Составьте графические формулы всех соединений.
7.Определите плотность вещества, если 30 см3 его имеют массу 45 г.
8.Сколько сульфида железа должно получиться, если для проведения рекции взяли 8 г серы и 28 граммов железа?
9.Определите простейшую формулу поташа, если массовый состав этого вещества: калия - 56,6%, углерода - 8,7%, кислорода - 34,8%.
10.При сжигании 1,55 г фосфора получено 3,53 г фосфорного ангидрида. Определите количественный состав фосфорного ангидрида.
11.Вычислите эквивалент и молярную массу эквивалентов ортофосфорной кислоты в реакциях обмена с едким натром, в результате которых образуются нормальная и кислые соли.
12.Из 1,4 г кальция получили 2,52 г его сульфида. Определите молярную массу эквивалента металла.
13.Плотность газа по воздуху 1,52. Определите относительную молекулярную массу газа.
14.Вычислите молекулярную массу газа, если при 25оС и 800 мм рт. ст. 350 мл его имеют массу 0,78 г. Определите его относительную плотность по воздуху.
15.Какой объем при нормальных условиях занимают 1020 молекул газа.
16.Составьте полную электронную формулу элемента, расположенного в 6-ом периоде, 7-й группе, главной подгруппе.
17.Газообразный гидрид элемента "Э" имеет формулу ЭН2. Определите формулу его высшего оксида и его молекулярную массу, если плотность гидрида по воздуху равна 1,172
18. Объясните, почему сера и хлор проявляют максимальную степень окисления, равную номеру группы, а кислород и фтор таковой не проявляют.
19. Какие из перечисленных молекул будут неполярными: h3S, HF, CCl4, Nh4, BCl3. Дайте мотивированный ответ.
20.Учитывая sp3-гибридизацию углерода, укажите, в какой из молекул дипольный момент наибольший: а) Ch5, б) Ch4Cl, в) Ch3Cl2, г) CHCl3,
д) CCl4?
21. Укажите, какие молекулы, из перечисленных ниже, имеют угловую форму:
h3O, BeCl2, CO2, h3S?
Примеры решения типовых задач
1. Составьте формулы оксидов и гидроксидов следующих элементов: Cl+7, Al+3, Cr+6, Sr+2.
Решение:
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. Кислород во всех соединениях имеет валентность, равную 2. Формула оксида определяется правилом: произведение валентности кислорода на индекс в формуле, указывающий число атомов кислорода в молекуле, равно такому же произведению другого атома в молекуле. Одновременно произведение валентностей элементов равно произведению индексов этих элементов в формуле.
Учитывая вышесказанное, имеем, например, для семивалентного хлора:
формула оксида хлора (VII) Cl2O7.
Аналогично получим: Al2O3, CrO3, SrO.
Гидроксиды (гидраты оксидов) – формально можно рассматривать как продукты присоединения воды к молекуле оксида.
Основным оксидам в качестве гидратов соответствуют основания. В формуле основания на первое место записывают металл, за ним записывают гидроксогруппы. Число гидроксогрупп равно валентности металла
SrO + h3O Þ Sr(OH)2
Кислотным оксидам в качестве гидратов соответствуют кислоты (продукты присоединения молекулы воды к кислотным оксидам). В формуле кислоты на первое место записывают водород, за ним центральный атом и на последнем месте кислород.
Cl2O7 + h3O Þ h3Cl2O8 Þ 2HClO4.
CrO3 + h3O Þ h3CrO4
Амфотерным оксидам соответствуют амфотерные гидроксиды (также могут быть представлены как продукты присоединения воды к молекуле амфотерного оксида).
Al2O3 + 3h3O Þ 2Al(OH)3.
2. Докажите амфотерные свойства оксида олова(II) и гидроксида бериллия, приведите уравнения соответствующих реакций.
Решение:
Чтобы доказать амфотерность оксида или гидроксида, следует составить уравнения реакций взаимодействия данного вещества с кислотой и со щелочью.
SnO + 2HCl Þ SnCl2 + h3O
SnO + 2NaOH Þ Na2SnO2 + h3O.
Be(OH)2 + 2HCl Þ BeCl2 + 2h3O
Be(OH)2 + 2NaOH Þ Na2BeO2 + 2h3O
3. Приведите формулы всех солей, которые могут образоваться при взаимодействии гидроксида кальция и серной кислоты. Составьте уравнения соответствующих реакций. Назовите продукты реакций.
Решение:
Различают соли средние – продукт полного замещения гидроксогрупп и ионов водорода в молекулах оснований и кислот:
Сa(OH)2 + h3SO4 Þ CaSO4 + 2h3O
CaSO4 – сульфат кальция;
Кислые соли – продукт неполного замещения ионов водорода в молекуле кислоты (могут быть образованы неодноосновными кислотами):
Сa(OH)2 + 2h3SO4 Þ Ca(НSO4)2 + 2h3O
Ca(НSO4)2 – гидросульфат кальция;
Основные соли – продукт неполного замещения ионов гидроксила в молекуле основания (могут быть образованы неоднокислотными основаниями):
2Сa(OH)2 + h3SO4 Þ (CaОН)2SO4 + 2h3O
(CaОН)2SO4 – гидроксосульфат кальция.
4. Составьте графическую формулу Ca(NO3)2.
Решение:
В графической формуле указывается порядок соединения атомов в молекуле, где каждая связь обозначается черточкой. В графической формуле не учитываются валентные углы между связями. Двойные связи обозначаются двойной черточкой, а тройные – тройной. В неорганических кислородсодержащих соединениях атомы различных элементов соединяются между собой, преимущественно, через кислородные мостики.
O O
ç÷ ç÷
N-O-Ca-O-N
ç÷ ç÷
O O
5. Определите простейшую формулу вещества, содержащего 40 % мас. меди, 20% мас. серы, 40 % мас. кислорода.
Решение:
Обозначим общую формулу вещества СuxSyOz. Индексы в формуле соединения относятся как количества вещества каждого элемента. Из процентного состава вещества известно, что 100 г вещества содержат 40 г меди, 20 г серы и 40 г кислорода. Найдем количество вещества каждого элемента, возьмем их отношение и преобразуем в отношение целых чисел, для чего разделим каждое число в отношении на наименьшее:
x : y : z = n(Cu) : n(S) : n(O) = m(Cu)/ M(Cu) : m(S)/ M(S) : m(O)/ M(O) =
= (40/64) : (20/32) : (40/16) = 0,625 : 0,625 : 2,5 = 1 : 1 : 4
Cледовательно, простейшая формула соединения CuSO4.
6. Определите количественный состав марганца в оксидах марганца (IV) и марганца(VII).
Решение:
Молекулярная масса марганца равна 55 г/моль, оксида марганца (IV) MnO2 – 87 г/моль, оксида марганца (VII) Mn2O7 – 222 г/моль.
1 моль MnO2 содержит 1 моль атомов марганца Mn.
Следовательно:
87 г MnO2 содержат 55 г Mn, а
100 г MnO2 содержат х г Mn.
Решая пропорцию, имеем:
х = (100×55)/87 = 63,2 г.
Массовая доля марганца в оксиде марганца (IV) составляет 63,2%.
Аналогично для оксида марганца (VII).
1 моль Mn2O7 содержит 2 моль атомов марганца Mn.
Следовательно:
222 г Mn2O7 содержат 110 г Mn, а
100 г Mn2O7 содержат y г Mn.
Решая пропорцию, имеем:
y = (100×100)/222 = 49,5 г.
Массовая доля марганца в оксиде марганца (VII) составляет 49,5%.
7. Сколько граммов хлорида магния получится, если для реакции взяли 48 г магния и 105 г хлора?
Решение:
Составим уравнение реакции:
Mg + Cl2 Þ MgCl2.
По уравнению реакции на 1 моль магния приходится 1 моль хлора.
Определим количество вещества каждого компонента, введенных в реакцию.
n(Mg) = m(Mg)/M(Mg) = 48 /24 = 2 моль.
n(Cl2) = m(Cl2)/M(Cl2) = 105/ 70 = 1,5 моль.
Хлор находится в недостатке. Расчеты ведем по недостатку.
По уравнению реакции на 1 моль хлора приходится 1 моль хлорида магния. Следовательно, в результате реакции получено 1,5 моль хлорида магния. Тогда масса хлорида магния составляет:
m(MgCl2) = n(MgCl2) × M(MgCl2) = 1,5 × 94 = 141 г.
8. Рассчитайте эквиваленты и молекулярные массы эквивалентов соединений: MnO2, h4PO4, Ca(h3PO4)2. Назовите вещества.
Решение:
Оксид марганца (IV).
МЭ(MnO2) = М(MnO2)/n(O)×B (O) = (55+16×2)/2×2 = 21,75,г/моль
где n(O) – число атомов кислорода в молекуле;
B (O) – валентность кислорода.
Э(MnO2)=1/4 MnO2
Ортофосфорная кислота.
МЭ(h4PO4) = М(h4PO4) / n(Н) = (3+31+16×4)/3 = 32,7 г/моль
где n(Н) – число атомов водорода в молекуле кислоты.
Э(h4PO4)=1/3 h4PO4
Дигидрофосфат кальция.
МЭ(Ca(h3PO4)2) = М(Ca(h3PO4)2)/n(М)×B(М) = (40+2+31×2+16×2×4)/2×1 = 116 г/моль
Э(Ca(h3PO4)2) =1/2 Э(Ca(h3PO4)2)
где n(М) – число атомов металла в молекуле;
B (М) – валентность металла.
9. Окислением 1,4 г кадмия получили 1,6 г его оксида. Определите молярную массу эквивалента металла.
Решение:
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород. Согласно условию 1,6 г оксида кадмия содержит 1,4 г металла. Следовательно, остальное составляет кислород – 0,2 г. Молярная масса эквивалента кислорода известна и равна 8 г/моль. Из закона эквивалентов - массы реагирующих веществ относятся, как молярные массы их эквивалентов– следует:
MЭ(Cd) = m (Cd)×mЭ (O) / m (O) = 1,4×8/0,2 = 56 г/моль.
Относительная плотность газа по водороду равна 35. Определите молярную массу газа и рассчитайте массу 5 л этого газа.
Решение:
Относительная плотность одного газа по другому равна отношению их молекулярных или молярных масс. D(газа/Н2) = М( газа) / М(Н2)
М (газа) = D(газа/Н2)× М(Н2) = 35 × 2 = 70 г/моль.
Моль любого газа при нормальных условиях занимает обьем 22,4 л. Следовательно, 5 л газа при тех же условиях имеют:
m( газа)= V (газа)М(газа)/VМ(газа)=5л´70(г/моль)/22,4 л/моль =15,6 г
10. 1000 л газа при 745 мм рт. ст. и 15°С имеют массу 1,825 кг. Определите его молекулярную массу.
Решение:
Применим уравнение состояния идеального газа Менделеева - Клапейрона
pV = (m/M) RT.
Тогда:
M=mRT/(pV)=1825г× 62400мм×мл/моль×К×288К/(745мм×106мл)=44 г/моль.
megaobuchalka.ru
Вычисление молярной массы эквивалента одновалентного металла
Задание 9.В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалента металла и его оксида. Чему равна молярная и относительная атомная масса этого металла?Решение:Находим массу кислорода, содержащегося в оксиде металла:
2,48 – 1,84 = 0,64 г.
Следует иметь в виду: а) молярная масса эквивалента оксида металла равна сумме молярных масс эквивалентов металла и кислорода:б) молярная масса эквивалента кислорода равна 8 г/моль.
Согласно закону эквивалентов массы (объёмы) реагирующих веществ m1 и m2 пропорциональны их молярным массам (объёмам):
Следовательно, молярную массу эквивалента металла можно вычислить из выражения:
Тогда молярную массу эквивалента оксида находим из соотношения:
Можно вычислить и так:
MЭ(МеО) = MЭ(Ме) + MЭ(О) = 23 + 8 = 31 г/моль.
Молярная масса металла определяется из соотношения МЭ = А/В, где МЭ – молярная масса эквивалента металла; А – молярная масса металла; В – стехиометрическая валентность элемента; А = МЭ . В =23 . 1 = 23 г/моль.
Так как относительная атомная масса в а. е. м. численно равна относительной молярной массе, выраженнойв г/моль, то искомая масса металла равна 23 а. е. м..
Ответ: МЭ(МеО) = 31 г/моль; МЭ(Ме) = 23 г/моль; М(Ме) = 23 г/моль; Ar(Ме) = 23.
buzani.ru
лабораторная эквивалент
Лабораторная работа № 1
Определение молярной массы эквивалента неизвестного металла
Закон эквивалентов: элементы соединяются друг с другом или замещают друг друга в химических реакциях в эквивалентных количествах:
Химическим эквивалентом элемента называется такое его количество, которое соединяется с 1 моль атомов водорода или замещает такое же количество водорода в соединениях. Масса одного моля эквивалента элемента или сложного вещества называется молярной массой эквивалента (Мэ) или эквивалентной массой (г/моль)
Молярная масса эквивалента элемента связана с его атомной массой (А) и валентностью соотношением:
Например, в оксидах N2O, NO2, N2O5 эквивалентная масса кислорода равна Мэ(О) = 16/2 = 8 г/моль, а эквивалентные массы азота соответственно равны: 14/1 = 14 г/моль, 14/4 = 3,5 г/моль, 14/5 = 2,8 г/моль.
Молярные массы эквивалентов сложных веществ вычисляют по формулам:
Если же приведены уравнения реакций, в которые вступают эти соединения, то в этом случае эквивалентная масса равна:
- кислоты равна ее молярной массе, деленной на число атомов водорода, участвующих в реакции, т.е. замещенных на катионы;
- основания равна его молярной массе, деленной на число гидроксильных групп, участвующих в реакции, т.е. замещаемых на кислотные остатки;
- соли равна ее молярной массе, деленной на число эквивалентов вещества реагирующих с 1 моль этой соли.
Примеры:
NaOH + 3h4PO4 = Na3PO4 + 3h3O, МЭ(h4PO4) = M/3;
KOH + h4PO4 = Kh3PO4 + h3O, МЭ(h4PO4) = M/1;
Al(OH)3 + 2HNO3 = AlOH(NO3)2 + 2h3O, МЭ(Al(OH)3) = M/2;
Na2CO3 + HCl = NaHCO3 + NaCl, МЭ(Na2CO3) = M/1;
Na2CO3 + 2HCl = CO2 + 2NaCl + h3O, МЭ(Na2CO3) = M/2.
В общем случае эквивалентная масса сложного вещества равна сумме эквивалентных масс его составных частей. Например, МЭ (MgO) = МЭ (Мg) + МЭ (О) = 24/2 + 16/2 = 20 г/моль.
Для газообразных веществ используется также понятие эквивалентного объема (Vэ), который находят по формуле:
Например, молярный эквивалентный объем газообразного кислорода равен:
Vэ(О2)=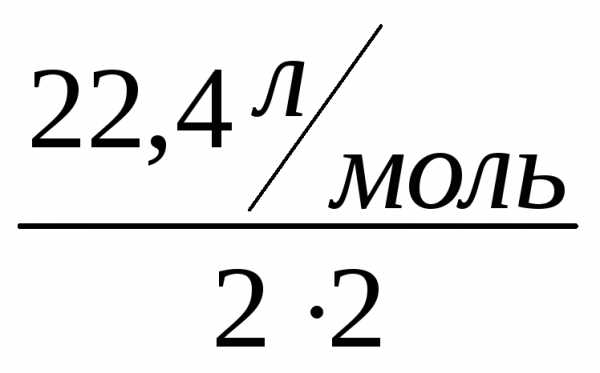 =5,6 л/моль,
=5,6 л/моль,
а эквивалентный объем водорода Vэ(Н2)=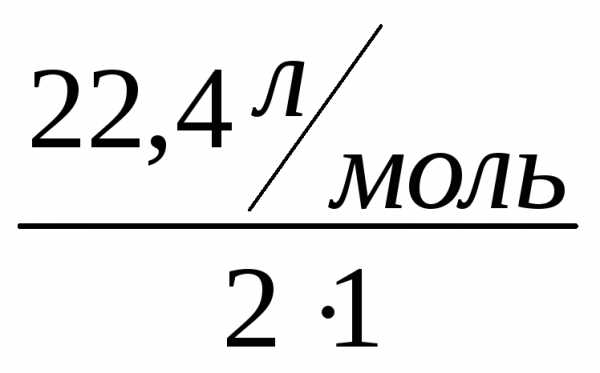 =11,2 л/моль.
=11,2 л/моль.
Практическая часть. Определение природы двухвалентного металла
Метод основан на реакции растворения металла в избытке кислоты и измерении объема выделившегося водорода. По объему водорода, применяя закон эквивалентов, вычисляют молярную массу эквивалента металла. Для проведения опыта в настоящей работе используется прибор, состоящий из бюретки и уравнительного сосуда, сообщающихся друг с другом посредством резиновой трубки. К верхнему концу бюретки с помощью трубки и пробки присоединяют двухколенную пробирку с исследуемым металлом. Уравнительный сосуд и бюретка наполнены водой.
Для проведения опыта в одно колено пробирки наливают через воронку 2-3 мл 2 н соляной кислоты. Капли кислоты не должны попадать на стенки второго колена пробирки. Навеску металла помещают во второе колено пробирки. Перемещая уравнительную склянку в вертикальном направлении, устанавливают уровень воды в бюретке вблизи нулевого деления, но не выше нуля. Пробирку с кислотой и металлом плотно присоединяют к прибору и проверяют систему на герметичность. Для этого опускают уравнительный сосуд так, чтобы уровень воды в нем был ниже уровня воды в бюретке, и в таком положении укрепляют его. При опускании уравнительного сосуда уровень воды в бюретке несколько понизится. Если через 1-2 минуты дальнейшего понижения не будет, прибор можно считать герметичным.
После испытания прибора на герметичность записывают показание бюретки. Затем наклоняют пробирку и металл попадает в кислоту. Тотчас начинается выделение водорода, и вода вытесняется из бюретки в уравнительный сосуд. По окончании реакции следует подождать 5-10 минут, чтобы газ в бюретке и пробирке принял температуру окружающего воздуха и записать новое показание бюретки. Экспериментальные данные записывают по форме:
| Масса металла m,г | |
| Показание бюретки до проведения реакции V1, мл | |
| Показание бюретки после проведения реакции V2, мл | |
| Объем выделившегося водорода V(Н2) = V2 – V1, мл | |
| Температура опыта t,oC | |
| Температура опыта T=t+273, K | |
| Температура при нормальных условиях Т0, К | 273 |
| Универсальная газовая постоянная R, кДж/(моль.К) | 8,31 |
| Давление при нормальных условиях Р0, кПа | 101,325 |
| Давление насыщенного пара воды РН2О при температуре опыта (находят по таблице), Па | |
| Атмосферное давление р, Па | |
| Парциальное давление водорода РН2 = Р – РН2О, Па |
Расчет молярной массы металла по экспериментальным данным
1 способ. по формуле объединенного закона Бойля-Мариотта и Гей-Люссака приводят объем выделившегося водорода к нормальным условиям:
 или
или
Далее по закону эквивалентов вычисляют значение молярной массы эквивалента металла. Так как реакция протекает с участием газообразного вещества, то используют следующую форму записи закона эквивалентов:
или
Зная валентность металла, находят молярную массу металла:
По таблице Д.И. Менделеева определяют природу металла, находят табличное (теоретическое) значение его молярной массы и вычисляют относительную погрешность эксперимента:
2 способ. По уравнению Менделеева-Клайперона находят массу выделившегося водорода:
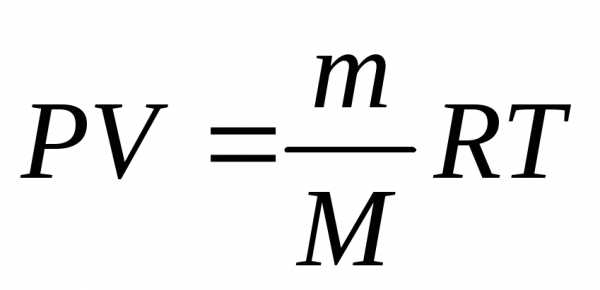
 или
или
По закону эквивалентов вычисляют значение молярной массы эквивалента металла:
или
Дальнейшие вычисления проводят как в способе 1.
Таблица. Давление насыщенного водяного пара в зависимости от температуры
| t,oC | P(Н2О), кПа | t,oC | P(Н2О), кПа |
| 15 | 1,71 | 20 | 2,34 |
| 16 | 1,82 | 21 | 2,49 |
| 17 | 1,94 | 22 | 2,64 |
| 18 | 2,06 | 23 | 2,81 |
| 19 | 2,20 | 24 | 2,98 |
Примеры вычислений с использованием закона эквивалентов
Пример 1. При сжигании 2,28 г металла было получено 3,78 г его оксида. Определить молярную массу эквивалента металла.
Решение
Сначала находим массу кислорода, пошедшего на окисление металла: m(O2)=3,78 - 2,28 = 1,5 г. Далее по закону эквивалентов находим молярную массу эквивалента металла:
, 
Пример 2. Вычислить молярную массу эквивалента металла, если установлено химическим анализом, что сульфид металла содержит 67,15% металла (по массе), а эквивалент серы равен 16.
Решение
67,15 массовой части металла соединяются с 32,85 части массы серы, а эквивалент металла соединяется с эквивалентом серы (закон эквивалентов). Отсюда
Пример 3. При взаимодействии 5 г металла с кислотой выделилось 2,8 л водорода (н.у.). Вычислить молярную массу эквивалента металла.
Решение
Так как реакция протекает с участием газообразного вещества, то используют следующую формулу:
Пример 4. Определить молярную массу эквивалента серной кислоты в следующих химических реакциях:
NaOH + h3SO4 = NaHSO4 + h3O (1)
PbCl2 + h3SO4 = PbSO4 + 2HCl (2)
Решение
В реакции (1) эквивалент NaOH численно равен его молярной массе, следовательно, по закону эквивалентов эквивалент NaOH взаимодействует с эквивалентом h3SO4 и эквивалент h3SO4 равен его молярной массе (98 г/моль).
В реакции (2) эквивалент PbCl2 равен М/2, следовательно, и эквивалент серной кислоты будет равен М/2 = 49 г/моль.
Задачи
1,96 г металла вытесняют из раствора кислоты 0,672 л водорода (н.у.). Вычислить молярную массу эквивалента металла.
Вычислить молярную массу эквивалента элемента, 1,2 г которого вытесняют из раствора кислоты при 20оС и 101,3 кПа 442 мл водорода.
Определить молярную массу эквивалента хлорида никеля, если 1,621 г хлорида взаимодействует без остатка с 1 г гидроксида натрия, молярная масса эквивалента которого равна 40.
На нейтрализацию 1 г кислоты израсходовано 0,313 г гидроксида натрия. Вычислить молярную массу эквивалента кислоты.
На восстановление 6,33 г оксида металла израсходовано 0,636 л водорода (н.у.) Определить молярную массу эквивалента металла.
Вычислить молярную массу эквивалента карбоната калия в следующих реакциях:
а) K2CO3 + HI → KHCO3 + KI; в)K2CO3 + 2HI → h3CO3 + 2KI
Какое количество водорода выделится в результате взаимодействия 9 г алюминия с избытком соляной кислоты?
Какая масса оксида получится при окислении 9 г алюминия?
Молярная масса эквивалента оксида равна 28 г/моль. Вычислите молярную массу эквивалента металла.
Вычислите эквивалент фосфорной кислоты при реакциях обмена, в результате которых образуются кислые и нормальные соли.
Исходя из молекулярных масс HNO3, h3SO4, HCl, Na2B4O7*10h3O, KOH, Ba(OH)2, BaSO4, FeSO4*7h3O, Na2CO3*10h3O вычислите их молярные массы эквивалентов.
Для нейтрализации щавелевой кислоты гидроксидом калия на 1,244 г кислоты потребовался 1 г КОН, молярная масса эквивалента которого 56 г/моль. Вычислить молярную массу эквивалента кислоты.
4
studfiles.net
Работа 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА МЕТАЛЛА ОБЪЕМНЫМ МЕТОДОМ
окислитель:
MnO−4 + 5e + 8H+→Mn2+ + 4h3O Z = 5;
Мэкв.окисл= | M |
| 119 | = 23,8 г/моль. | |
| = |
|
| ||
Z | 5 | ||||
Экспериментально эквивалент простого вещества может быть определен по количеству замещаемого водорода либо присоединяемого кислорода, или другого элемента, эквивалент которого известен. Эквивалент можно определить электрохимическим путем на основании закона Фарадея, согласно которому при прохождении заряда 96 484 Кл через раствор электролита на электродах превращается один эквивалент вещества.
В данной работе использован способ определения эквивалента активного металла, основанный на измерении объема водорода, выделяющегося при растворении металла в соляной кислоте:
Me + nHCl → MeCln + n/2h3
Согласно закону эквивалентов, один эквивалент металла вытесняет один эквивалент водорода, имеющий молярную массу эквивалента 1 г/моль.
Используя закон Авогадро, можно определить объем, который занимает один моль эквивалентов водорода при определенных физических условиях. При нормальных физических условиях (н.у.,
р = 1,013·105 Па, или р = 760 мм рт. ст., Т = 273 K) 1 моль водорода, имеющий массу 2 г/моль, занимает объем V = 22,4 л, тогда 1 моль эквивалентов водорода, имеющий массу 1 г/моль, должен занимать объем Vэкв h3 = 11,2 л.
Таким способом можно рассчитать объем, занимаемый одним эквивалентом любого газа. Например, для O2 эквивалентный объем равен Vэкв h3 = 5,6 л (н.у.), поскольку молярная масса эквивален-
та кислорода равна 8 г/моль и составляет 1/4 его молярного объема; для хлороводорода 1 моль эквивалентов занимает объем Vэкв HCl = 22,4 л (н.у.), так как молярная масса его эквивалента равна молярной массе (Z = 1).
studfiles.net
Молярная масса - эквивалент - Большая Энциклопедия Нефти и Газа, статья, страница 2
Молярная масса - эквивалент
Cтраница 2
Подобно молярной массе эквивалентов элемента, молярная масса эквивалентов сложного вещества может иметь несколько значений, если вещество способно вступать в реакции различного типа. [16]
Почему молярная масса эквивалента одного и того же вещества может иметь разные значения. [17]
Определение молярных масс эквивалентов основано на знании соотношений масс, в которых вещества без остатка вступают в реакции друг с другом. [18]
Вычисление молярных масс эквивалентов окислителей и восстановителей имеет свои особенности. Если в кислотно-основной реакции эквивалентом называют количество вещества, отвечающее одному иону водорода, то в окислительно-восстановительной - одному электрону. Известно, что при окислительно-восстановительных реакциях электроны переходят от одних атомов ( или ионов) к другим. Именно перераспределением электронов определяются массовые соотношения реагирующих веществ и коэффициенты в уравнениях этих реакций. Поэтому, вычисляя молярные массы эквивалентов окислителей и восстановителей, исходят из числа электронов, приобретаемых или теряемых в реакции одной молекулой вещества. При этом учитывают, что атом водорода может отдавать, а ион Н - приобретать только один электрон ( гл. [19]
Найдите молярную массу эквивалента двух металлов по следующим экспериментальным данным: навеска первого металла массой 2 0000 г и навеска второго массой 1 0582 г образуют оксиды массой, соответственно равной 2 5036 и 2 0000 г. Ответ: 31 8 и 9 0 г / моль. [20]
Определить молярную массу эквивалента металла, 2 г которого вытесняют из раствора медной соли 1 132 г меди. [21]
Определите молярную массу эквивалента металла, если его соединение с иодом содержит 94 8 % иода. [22]
Определить молярную массу эквивалента металла, зная, что его сульфид содержит 52 мае. [23]
Чему равна молярная масса эквивалента металла, если его навеска массой 20 г вытесняет из кислоты водород объемом 7 5 л при 18 С и давлении 1 013 - Ю6 Па. [24]
Как связана молярная масса эквивалента кислот с их основностью. Для каких кислот она может иметь только одно значение. [25]
Очевидно, молярная масса эквивалента щавелевой кислоты Н2С2О4 - 2Н2О, которой мы воспользуемся как стандартным веществом, равна / 2 молярной массы, т.е. 126 07: 2 63 04 г / моль. [26]
Чему равна молярная масса эквивалента тиосульфата натрия в реакции взаимодействия его с иодом. [27]
Чему р авна молярная масса эквивалента серной кислоты в реакции получения простого суперфосфата, которая приведена в этой главе. [28]
Числовые значения молярной массы эквивалента равны числовым значениям прежде применявшихся грамм-эквивалента, или эквивалентной массы. [29]
Числовые значения молярной массы эквивалента равны числовым значениям прежде применявшихся грамм-эквивалента, или эквивалентной массы. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Вычисление молярной массы эквивалента одновалентного металла
Задание 9.В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалента металла и его оксида. Чему равна молярная и относительная атомная масса этого металла?Решение:Находим массу кислорода, содержащегося в оксиде металла:
2,48 – 1,84 = 0,64 г.
Следует иметь в виду: а) молярная масса эквивалента оксида металла равна сумме молярных масс эквивалентов металла и кислорода:б) молярная масса эквивалента кислорода равна 8 г/моль.
Согласно закону эквивалентов массы (объёмы) реагирующих веществ m1 и m2 пропорциональны их молярным массам (объёмам):
Следовательно, молярную массу эквивалента металла можно вычислить из выражения:
Тогда молярную массу эквивалента оксида находим из соотношения:
Можно вычислить и так:
MЭ(МеО) = MЭ(Ме) + MЭ(О) = 23 + 8 = 31 г/моль.
Молярная масса металла определяется из соотношения МЭ = А/В, где МЭ – молярная масса эквивалента металла; А – молярная масса металла; В – стехиометрическая валентность элемента; А = МЭ . В =23 . 1 = 23 г/моль.
Так как относительная атомная масса в а. е. м. численно равна относительной молярной массе, выраженнойв г/моль, то искомая масса металла равна 23 а. е. м..
Ответ: МЭ(МеО) = 31 г/моль; МЭ(Ме) = 23 г/моль; М(Ме) = 23 г/моль; Ar(Ме) = 23.
buzani.ru
Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента
⇐ ПредыдущаяСтр 2 из 10Следующая ⇒Одним из основных законов химии является закон эквивалентов, открытый в конце 18 века: массы элементов, соединяющихся друг с другом, пропорциональны их эквивалентам:
где mA, mВ – массы взаимодействующих веществ А и В;
ЭА и ЭВ – эквиваленты этих веществ.
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях ионного обмена равноценна одному атому или одному иону водорода, а в окислительно-восстановительных реакциях одному электрону.
Массу одного моля эквивалента элемента называют молярной массой эквивалента MЭ(X). Значение эквивалента веществ зависит от того, в какой конкретной реакции участвует это вещество.
Молярная масса эквивалента химического элемента (MЭ(X)), а также простых или сложных веществ рассчитывается по формуле
где M(X) – молярная масса; вал – суммарная валентность.
Для простых веществ суммарная валентность определяется произведением валентности атома химического элемента и числа атомов. Так, молярная масса эквивалента алюминия составляет MЭ(AI)=27/3=9 г∙моль-1. Молярные массы эквивалента кислорода и водорода следует запомнить, они равны соответственно MЭ(О)=16/2=8г∙моль-1, МЭ(Н)=1/1=1 г моль-1.
Молярные массы эквивалента сложных веществ вычисляются по их химическим формулам с учетом происходящих химических реакций.
К сложным веществам относятся оксиды, гидроксиды, соли.
Суммарная валентность оксидов равна произведению валентности кислорода (2) на количество атомов кислорода в молекуле. Суммарная валентность гидроксидов определяется их кислотностью, которая равняется числу замещенных гидроксильных групп. Суммарная валентность кислотравняется основности данных соединений, которая определятся числом замещенных атомов водорода. Суммарная валентность соли равняется произведению валентности катиона и количества катионов в молекуле, или валентности аниона и количества анионов в молекуле.
Молярная масса эквивалентов сложных веществ может быть определена как сумма молярных масс эквивалентов элементов или условных частиц, образующих данное вещество.
Мэ(оксиды)=Мэ(О)+Мэ(элемента)=8+Мэ(элемента), т.к. Мэ кислорода величина постоянная, равна 8 г∙моль-1.
Мэ(кислота)=Мэ(Н)+Мэ(кислотного остатка)=1+Мэ(кислотного остатка), т.к. Мэ водорода величина постоянная, 1 г∙моль-1
Мэ(гидроксиды)=Мэ(OH-)+Мэ(металла)=17+Мэ(металла), т.к. Мэ “OH” групп величина постоянная, равна 17 г∙моль-1.
Мэ(соли)=Мэ(катиона)+Мэ(кислотного остатка).
Пример 1. Выразите в молях: а) 6,02∙1021молекул CO2; б) 1,20∙1024 атомов кислорода; в) 2,00∙1023 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02 ∙1023). Отсюда:
а) 6,02∙1021, т.е.0,01 моль; б) 1,20∙1024,т.е. 2 моль; в) 2,00∙1023м,т.е.1/3 моль.
Так как молекулярные массы СО2 и h3O и атомная масса кислорода соответственно равны 44; 18 и 16 а.е.м., то их мольные (молярные) массы равны: а) 44 г/моль; б) 18 г/моль; в) 16 г/моль.
Пример 2. Определите эквивалент (Э) и эквивалентную массу МЭ (Х) азота, серы и хлора в соединениях NHз ,h3S и HCl.
Решение. Масса вещества и количество вещества – понятия неидентичные. Масса выражается в килограммах (граммах), а количество вещества – в молях.
В данных соединениях с 1 моль атомов водорода соединяется 1/3 моль азота,1/2 моль серы и 1 моль хлора. Отсюда Э(N) =1/3 моль, Э(S) =1/2 моль, Э(Cl) =1 моль. Исходя из мольных масс этих элементов определяем их эквивалентные массы:
МЭ (N) =1/3∙14= 4,67 г/моль;
МЭ (S) =1/2∙32= 16 г/моль;
МЭ (Cl) =1∙35,45= 35,45 г/моль.
Пример 3.На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода(н.у.). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла? Нормальные условия по Международной системе единиц (СИ): давление 1,013∙105Па (760 мм рт. ст.=1 атм), температура 273 К или 00 С.
Решение. Согласно закону эквивалентов массы (объемы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объемам):
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (см3, л, м3).
Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или, соответственно, эквивалентным объёмом этого вещества. Мольный объём любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объём водорода VmЭ (Н2) = 22,4/2=11,2 л, а эквивалентный объём кислорода равен 5,6 л.
В формуле (2) отношение mН2/mЭ(Н2) заменяем равным ему отношением VН2/VmЭ(Н2), где VН2- объём водорода, VmЭ(MeO) - эквивалентный объём водорода:
Из уравнения (3) находим эквивалентную массу оксида металла mЭ (МеО):
Согласно закону эквивалентов mЭ (МеО) = mЭ (Ме) + mЭ (О2), отсюда
mЭ (Ме) = mЭ (МеО) - mЭ (О2) =35,45- 8 = 27,45 г/моль.
Мольная масса металла определяется из соотношения mЭ = А/В ,
где mЭ - эквивалентная масса, А- мольная масса металла, В- стехиометрическая валентность элемента; А= mЭ ∙ В =27,45∙2 = 54,9 г/моль. Так как атомная масса в а.е.м. численно равна мольной (молярной) массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
Пример 4. Вычислите эквиваленты и эквивалентные массы h3SО4 и Аl(OH)3 в реакциях, выраженных уравнениями:
h3SО4 + КОН= КHSО4 + h3O (1)
h3SО4 + Мg= MgSО4 + h3 (2)
Al(ОH)3 + НCl= Al(ОH)2 Cl+ h3O (3)
Al(ОH)3 + 3НNO3 = Al(NО3)3 + 3h3O (4)
Решение. Эквивалент (эквивалентная масса) сложного вещества, как и эквивалент (эквивалентная масса) элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество. Эквивалентная масса кислоты (основность) равна мольной массе (М), деленной на число атомов водорода, замещенных в данной реакции на металл (на число вступающих в реакцию гидроксильных групп). Следовательно, эквивалентная масса h3SО4 в реакции (1) Мh3SО4=98 г/моль, а в реакции (2) Мh3SО4/2=49 г/моль. Эквивалентная масса Al(OH) 3 в реакции (3) МAl(ОH)3 = 78 г/моль а в реакции (4) МAl(ОH)3/3 =26 г/моль.
Пример 5. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 см3 кислорода (н.у.)?
Решение. Так как молярная масса О2 (32 г/моль) при н.у. занимает объем 22,4 м, то объем молярной массы эквивалента кислорода (8 г/моль) будет равен 22,4/4 = 5,6 = 5600 см3. По закон эквивалентов
или ,
откуда тМе= 12,16 ∙ 310/5600 = 0,673 г.
Пример 6.Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите молярную массу эквивалента металла (тЭ(Ме) ).
Решение. При решении задачи следует иметь в виду: а) молярная масса эквивалента гидроксида равна сумме молярных масс эквивалентов металла и гидроксильной группы; б) молярная масса эквивалента соли равна сумме молярных масс эквивалентов металла и кислотного остатка. Вообще молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
Учитывая сказанное, подставляем соответствующие данные в уравнение (1) примера 3:
mЭ(Ме) = 15 г/моль
Пример7. В какой массе Са(ОН)2 содержится столько же эквивалентных масс, сколько в 312 г А1(ОН)3?
Решение. Молярная масса эквивалента А1(ОН)3 равна 1/3 его молярной массы, т.е. 78/3 = 26 г/моль. Следовательно в 312 г А1(ОН)3 содержится 312/26 =12 эквивалентов. Молярная масса эквивалента Са(ОН)2 равна ½ его молярной массы, т.е. 37 г/моль. Отсюда 12 эквивалентов составляют 37 г/моль ∙ 12 моль = 444 г.
Пример 8.Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение. Моль любого вещества содержит постоянную Авогадро NAструктурных единиц (в нашем примере молекул). Молярная масса h3SO4 равна 98,0 г/моль. Следовательно, масса одной молекулы 98/(6,02∙1023) = 1,63∙10-22г.
Читайте также:
lektsia.com