Таблица Менделеева. История и суть таблицы Менделеева. Таблица менделеева что означают цифры
Таблица Менделеева для чайников – HIMI4KA
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
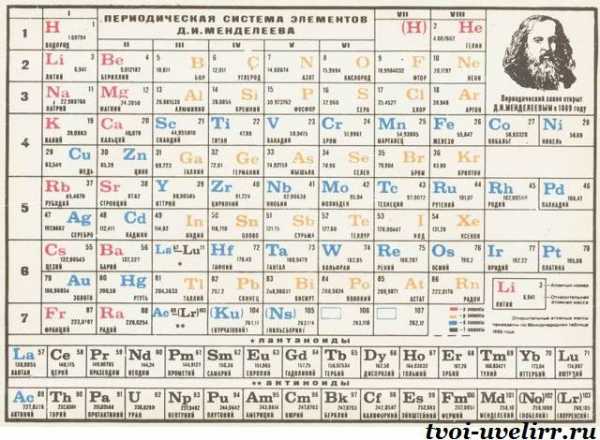
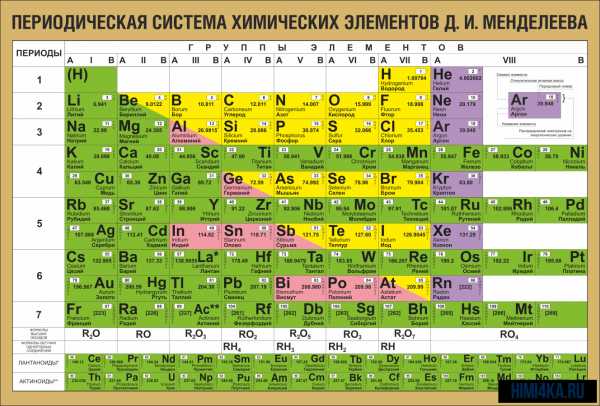 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. МенделееваНа первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
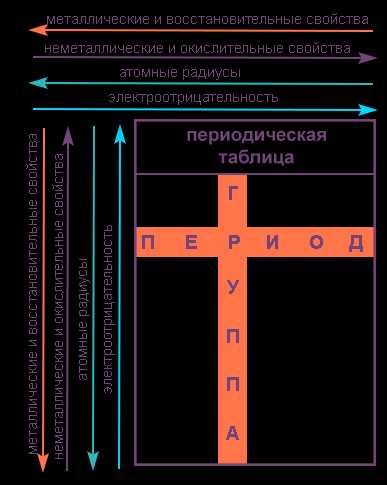
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности Rh5, Rh4, Rh3, RH.
Соединения Rh5 имеют нейтральный характер; Rh4 — слабоосновный; Rh3 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
himi4ka.ru
Таблица Менделеева, химические элементы
Таблица Менделеева — общепринятое графическое выражение Периодического закона, открытого Д.И. Менделеевым в 1869 г. Первоначальный вариант таблицы был разработан Менделеевым в 1869—1871 годах. За время существования было предложено более сотни вариантов её изображения, однако наиболее общепринятый вариант представляет собой двумерную таблицу в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Мы постарались описать основные химические элементы Таблицы Менделеева, для подробной информации о них переходите по соответствующей ссылке в таблице. Обращаем ваше внимание, что целью нашего сайта Занимательная химия не является описание химических элементов с научной точки зрения, мы больше сконцентрировались на интересных фактах, которые будут интересны даже детям, не углубляясь в непонятные термины и цифры. Однако, для каждого элемента приводится краткое описание химических свойств в простой и доступной форме.
| ГРУППЫ ЭЛЕМЕНТОВ | |||||||||
| I | II | III | IV | V | VI | VII | VIII | ||
| 1 Hводород | 2 Heгелий | ||||||||
| 3 Liлитий | 4 Beбериллий | 5 Bбор | 6 Суглерод | 7 Nазот | 8 Oкислород | 9 Fфтор | 10Neнеон | ||
| 11 Naнатрий | 12 Mgмагний | 13 Alалюминий | 14 Siкремний | 15 Pфосфор | 16 Sсера | 17 Clхлор | 18Arаргон | ||
| 19 Kкалий | 20 Caкальций | 21 Scскандий | 22 Tiтитан | 23 Vванадий | 24 Crхром | 25 Mnмарганец | 26 Feжелезо | 27 Coкобальт | 28 Niникель |
| 29 Cuмедь | 30 Znцинк | 31 Gaгаллий | 32 Geгерманий | 33 Asмышьяк | 34 Seселен | 35 Brбром | 36 Krкриптон | ||
| 37 Rbрубидий | 38 Srстронций | 39 Yиттрий | 40 Zrцирконий | 41 Nbниобий | 42 Moмолибден | 43 Tcтехнеций | 44 Ruрутений | 45 Rhродий | 46 Pdпалладий |
| 47 Agсеребро | 48 Cdкадмий | 49 Inиндий | 50 Snолово | 51 Sbсурьма | 52 Teтеллур | 53 Iиод | 54Xeксенон | ||
| 55 Csцезий | 56 Baбарий | 57 Laлантан × | 72 Hfгафний | 73 Taтантал | 74 Wвольфрам | 75 Reрений | 76 Osосмий | 77 Irиридий | 78 Ptплатина |
| 79 Auзолото | 80 Hgртуть | 81 Tlталлий | 82 Pbсвинец | 83 Biвисмут | 84 Poполоний | 85 Atастат | 86Rnрадон | ||
| 87 Frфранций | 88 Raрадий | 89 Acактиний ×× | 104 Rfрезерфордий | 105 Dbдубний | 106 Sgсиборгий | 107 Bhборий | 108 Hsхассий | 109 Mtмейтнерий | 110 Dsдармштадтий |
| 111 Rgрентгений | 112 Сnкоперниций | 113 Nhнихоний | 114Flфлеровий | 115Mcмосковий | 116Lvливерморий | 117 Tnтеннесин | 118Ogоганессон | ||
| 57 Laлантан | 58 Ceцерий | 59 Prпразеодим | 60 Ndнеодим | 61 Pmпрометий | 62 Smсамарий | 63 Euевропий | 64 Gdгадолиний | 65 Tbтербий | 66 Dyдиспрозий | 67 Hoгольмий | 68 Erэрбий | 69 Tmтулий | 70 Ybиттербий | 71 Luлютеций |
| 89 Acактиний | 90 Thторий | 91 Paпротактиний | 92 Uуран | 93 Npнептуний | 94 Puплутоний | 95 Amамериций | 96 Cmкюрий | 97 Bkберклий | 98 Cfкалифорний | 99 Esэйнштейний | 100 Fmфермий | 101 Mdменделевий | 102 Noнобелий | 103 Lrлоуренсий |
Таблица Менделеева и её значение
Открытие Периодического закона стало важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях. Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях была создана стройная таблица Менделеева, на основе которой стало возможным обобщать, делать выводы и предвидеть открытие новых химических элементов.

Список химических элементов Таблицы Менделеева
Список химических элементов упорядочен в порядке возрастания атомных номеров, приводятся обозначения элемента в Таблице Менделеева, латинское и русское названия.
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113 | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115 | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117 | Ts | Tennessine | Теннесин |
| 118 | Og | Oganesson | Оганессон |
Таблица Менделеева в хорошем качестве
Предлагаем вам скачать несколько вариантов таблицы Менделеева в хорошем качестве, которые можно распечатать на принтере большого формата, как в черно-белом так и в цветном вариантах.
www.alto-lab.ru
| пе ри од ы | Р Я Д Ы | группы химических элементов | |||||||||||||||||||||||||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||||||||||||||||||||||||
| I | 1 |
|
| ||||||||||||||||||||||||||||||
| II | 2 |
|
|
|
|
|
|
|
| ||||||||||||||||||||||||
| III | 3 |
|
|
|
|
|
|
|
| ||||||||||||||||||||||||
| IV | 4 |
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||||||
| IV | 5 |
|
|
|
|
|
|
|
| ||||||||||||||||||||||||
| V | 6 |
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||||||
| V | 7 |
|
|
|
|
|
|
|
| ||||||||||||||||||||||||
| VI | 8 |
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||||||
| VI | 9 |
|
|
|
|
|
|
|
| ||||||||||||||||||||||||
| VII | 10 |
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||||||
| VII | 11 |
|
|
|
|
|
|
|
| ||||||||||||||||||||||||
| 8 | 12 |
|
| ||||||||||||||||||||||||||||||
| высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |||||||||||||||||||||||||
| летучие водоро дные соедине ния | Rh5 | Rh4 | h3R | RH | |||||||||||||||||||||||||||||
infotables.ru
Таблица Менделеева. История и суть таблицы Менделеева
Он опирался на труды Роберта Бойле и Антуана Лавузье. Первый ученый ратовал за поиск неразложимых химических элементов. 15 из таковых Бойле перечислил еще в 1668-ом году.
Лавузье прибавил к ним еще 13, но спустя век. Поиски растянулись, поскольку не было стройной теории связи между элементами. Наконец, в «игру» вступил Дмитрий Менделеев. Он решил, что есть связь между атомной массой веществ и их местом в системе.
Эта теория позволила ученому открыть десятки элементов, не обнаруживая их на практике, а природе. Это было возложено на плечи потомков. Но, сейчас не о них. Посвятим статью великому русскому ученому и его таблице.
История создания таблицы Менделеева
Таблица Менделеева началась с книги «Соотношение свойств с атомным весом элементов». Труд выпущен в 1870-ых. Тогда же русский ученый выступил перед химическим обществом страны и разослал первый вариант таблицы коллегам из-за рубежа.
До Менделеева разными учеными были открыты 63 элемента. Наш соотечественник начал со сравнения их свойств. В первую очередь, работал с калием и хлором. Потом, взялся за группу металлов щелочной группы.
Химик обзавелся специальным столом и карточками элементов, чтобы раскладывать их, как пасьянс, ища нужные совпадения и комбинации. В итоге, пришло прозрение: — свойства компонентов зависят от массы их атомов. Так, элементы таблицы Менделеева выстроились в ряды.
Находкой маэстро химии стало решение оставить в этих рядах пустоты. Периодичность перепада между атомными массами заставила ученого предположить, что человечеству известны еще не все элементы. Промежутки в весе между некоторыми «соседями» были слишком велики.

Поэтому, периодическая таблица Менделеева стала похожа на шахматное поле, с обилием «белых» клеток. Время показало, что они, действительно, ждали своих «постояльцев». Ими, к примеру, стали инертные газы. Гелий, неон, аргон, криптон, радиоакт и ксенон открыты лишь в 30-ых годах 20-го века.
Теперь о мифах. Распространено мнение, что химическая таблица Менделеева явилась ему во сне. Это происки университетских педагогов, точнее, одного из них – Александра Иностранцева. Это русский геолог, читавший лекции в Петербургском университете горного дела.
Иностранцев был знаком с Менделеевым, бывал у него в гостях. Однажды, изможденный поисками Дмитрий заснул прямо при Александе. Тот дождался, пока химик проснется и увидел, как Менделеев хватается за листок и записывает окончательный вариант таблицы.
По сути, ученый просто не успел сделать это до того, как его захватил Морфей. Однако, Иностранцеву хотелось позабавить своих студентов. На основе виденного геолог придумал байку, которую благодарные слушатели быстро распространили в массы.
Особенности таблицы Менделеева
С момента первой версии 1969-го года порядковая таблица Менделеева не раз дорабатывалась. Так, с открытием в 1930-ых благородных газов удалось вывести новую зависимость элементов, — от их порядковых номеров, а не массы, как заявлял автор системы.
Понятие «атомный вес» заменили на «атомный номер». Удалось изучить число протонов в ядрах атомов. Эта цифра и есть порядковый номер элемента.
Ученые 20-го века изучили и электронное строение атомов. Оно тоже влияет на периодичность элементов и отражено в поздних редакциях таблицы Менделеева. Фото списка демонстрирует, что вещества в нем расставлены по мере роста атомного веса.
Первооснову менять не стали. Масса увеличивается слева направо. При этом, таблица не едина, а поделена на 7 периоды. Отсюда и название списка. Период – горизонтальный ряд. Его начало – типичные металлы, конец – элементы с неметаллическими свойствами. Убывание постепенное.
Есть большие и малые периоды. Первые находятся в начале таблицы, их 3. Открывает список период из 2-х элементов. Следом идут две колонки, в которых по 8 наименований. Оставшиеся 4 периода большие. Наиболее протяжен 6-ой, в нем 32 элемента. В 4-ом и 5-ом их по 18, а в 7-ом – 24.
Можно сосчитать, сколько элементов в таблице Менделеева. Всего 112 наименований. Именно наименований. Клеток же 118, а есть вариации списка и со 126-ю полями. Все еще остаются пустые клетки для неоткрытых элементов, не имеющих имен.
Не все периоды умещаются в одну строку. Большие периоды состоят из 2-х рядов. Количество металлов в них перевешивает. Поэтому, им полностью посвящены нижние строки. Постепенное убывание от металлов к инертным веществам соблюдается в верхних рядах.
Картинки таблицы Менделеева поделены и вертикально. Это группы в таблице Менделеева, их 8. Вертикально скомпонованы элементы, схожие по химическим свойствам. Они поделены на главную и побочную подгруппы. Последние начинаются только с 4-го периода. В главные подгруппы входят и элементы малых периодов.
Суть таблицы Менделеева
Названия элементов в таблице Менделеева – это 112 позиций. Суть их компоновки в единый список – систематизация первоэлементов. Над этим начали биться еще в античные времена.
Одним из первых понять, из чего составлено все сущее попытался Аристотель. Он взял за основу свойства веществ – холод и тепло. Эмпидокл выделил 4-ре первоосновы по стихиям: воду, землю, огонь и воздух.
Металлы в таблице Менделеева, как и другие элементы, — те самые первоосновы, но с современной точки зрения. Российскому химику удалось открыть большинство составляющих нашего мира и предположить существование еще неизвестных первоэлементов.

Получается, что произношение таблицы Менделеева – озвучивание некой модели нашей реальности, раскладывание ее на составляющие. Однако, выучить их не так-то просто. Попробуем облегчить задачу, описав пару эффективных методов.
Как выучить таблицу Менделеева
Начнем с современного метода. Компьютерщиками разработан ряд флеш-игр, помогающих запомнить список Менделеева. Участникам проекта предлагают находить элементы по разным опциям, например, названию, атомной массе, буквенному обозначению.
Игрок имеет право выбрать поле деятельности – лишь часть таблицы, или ее всю. В нашей воле, так же, исключить имена элементов, другие параметры. Это усложняет поиск. Для продвинутых предусмотрен и таймер, то есть тренировка ведется на скорость.
Игровые условия делают изучение номеров элементов в таблице Менднлеева не нудным, а занятным. Просыпается азарт, и систематизировать знания в голове становится проще. Те же, кто не приемлет компьютерных флеш-проектов, предлагают более традиционный способ заучивания списка.
Его делят на 8 групп, или 18 (в соответствии с редакцией 1989-го года). Для удобства запоминания, лучше создать несколько отдельных таблиц, а не работать по цельному варианту. Помогают и зрительные образы, подобранные к каждому из элементов. Опираться следует на собственные ассоциации.
Так, железо в мозгу может соотноситься, к примеру, с гвоздем, а ртуть – с градусником. Название элемента незнакомо? Пользуемся методом наводящих ассоциаций. Иридий, например, составим из начал слов «ириска» и «динамик».
Характеристика таблицы Менделеева не учиться в один присест. Рекомендованы занятия по 10-20 минут в день. Начинать рекомендована с запоминания лишь основных характеристик: названия элемента, его обозначения, атомной массы и порядкового номера.
Школьники предпочитают вешать таблицу Менделеева над рабочим столом, или на стене, на которую часто смотрят. Метод хорош для людей с преобладанием зрительной памяти. Данные из списка невольно запоминаются даже без зубрежки.
Это учитывают и педагоги. Как правило, они не заставляют заучивать список, разрешают смотреть в него даже на контрольных. Постоянное заглядывание в таблицу равнозначно эффекту распечатки на стене, или написанию шпаргалок до экзаменов.
Приступая к изучению, вспомним, что и Менделеев не сразу запомнил свой список. Однажды, когда ученого спросили, как он открыл таблицу, последовал ответ: — «Я над ней, может, 20 лет думал, а вы считаете: сидел и, вдруг, готово». Периодическая система – кропотливый труд, который не осилить в сжатые сроки.
Наука не терпит спешки, ведь она приводит к заблуждениям и досадным ошибкам. Так, одновременно с Менделеевым таблицу составил и Лотар Мейер. Однако, немец немного недоработал список и не был убедителен при доказательстве своей точки зрения. Поэтому, общественность признала труд русского ученого, а не его коллеги-химика из Германии.
tvoi-uvelirr.ru
Устройство таблицы Менделеева | WhoYOUgle
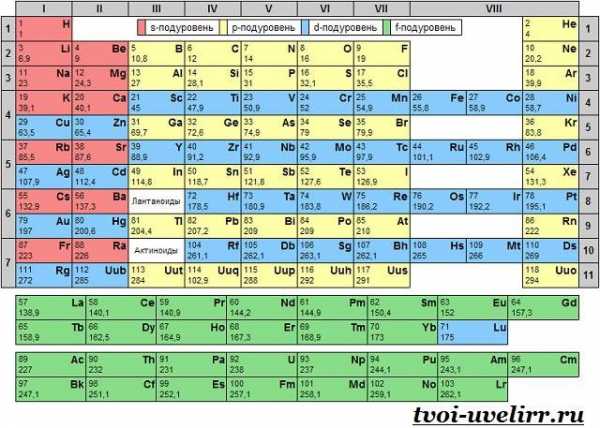
Таблица Менделеева — визуализация переодической системы свойств химических элементов, открытая Д. И. Менделеевым.
Период и группа
Расположенный в каждой ячейке таблицы элемент оказывается на пересечении строки и столбца, номера которых являются, соответственно, периодом и группой.
Период и группа химического элемента
Начиная с четвертого, периоды состоят из двух рядов (строк), но это не должно смущать — это традиционный прием, позволяющий сделать таблицу не слишком широкой.
Химический элемент принадлежит либо основной, либо побочной группе. Принадлежность элемента основной группе в первую очередь означает, что он обладает свойствами, присущими группе в целом (например, все инертные газы находятся в восьмой группе, а щелочные металлы — в первой).
Цвет ячейки показывает принадлежность элемента определенному семейству (например, металлов или полупроводников). Расшифровка цветов приведена под таблицей.
Два больших семейства — лантаноиды и актиноиды — вынесены за пределы основной таблицы.
Химический элемент
Ячейка таблицы содержит символ элемента, его название, порядковый номер и относительную атомную массу.
Основные параметры элемента
Дробное значение атомной массы говорит о том, что в природе встречаются изотопы элементов; если атомная масса указана в квадратных скобках, она означает массу наиболее долгоживущего изотопа.
Символ элемента расположен слева, если элемент принадлежит основной группе, и справа, если побочной.
Основная и побочная группы
Распределение электронов
Увеличенная ячейка таблицы, показанная на странице химического элемента, содержит дополнительную информацию о распределении электронов по орбиталям и название по-латыни (одно-, двух- или трехбуквенный символ, обозначающий элемент, образован именно от латинского названия).
Детализированная карточка химического элемента
С ростом номера элемента электроны в атоме занимают более высокие уровни: общее число электронов на каждом уровне показано в столбике чисел под атомным номером. Нижнее число соответствует первому уровню.
Чем выше уровень, тем больше разнообразие орбиталей, по которым «вращаются» электроны атомной оболочки. Например, на первом уровне возможна только орбита s-типа, на втором — s- и p-типов.
Электронная конфигурация показана в сокращенном виде и по клику разворачивается в полную запись. Сокращенная запись говорит о том, что нижние уровни полностью заняты, причем совпадают с оболочкой одного из предыдущих элементов в таблице. Совпадающая часть условно записана символом элемента восьмой группы, помещенным в квадратные скобки (именно у элементов этой группы полностью заполняется очередной уровень). Цифры перед буквами обозначают номера уровней, верхние индексы — число электронов на орбитали.
Сокращенная и расширенная электронная конфигурация
Наконец, на отдельном рисунке показано условное распределение атомов по орбитам. Обратите внимание, что реальные орбитали имеют другую форму (не говоря уже о волновых функциях).
Условная визуализация электронных уровней
whoyougle.ru
Что означают вертикальные группы в таблице менделева? Еще что означаю периоды? и для чего нужна таблица менделеева?
если вы это поймете, химия станет любимым предметом, это ключ к предмету..
нужно чтобы узнать какой порядковый номер вещества, кол-во электронов и. т. п
скажу уникальная табличка. от места занимаемого в нем элементом можно сказать про этот элемент почти все: физические и химические свойства.
Таблица Менделеева отражает структуру электронной оболочки атомов, которая и определяет их химические свойства. В каждом вертикальном столбце элементы имеют равное число внешних электронов. В каждом периоде у следующего элемента прибавляется один электрон во внешней оболочке. Есть ещё d - и f - элементы, но это уже высший пилотаж..: -))
Химические свойства близки. Что перво-наперво и заметил Менделеев, и что послужило толчком к открытию таблицы. Это в основном валентность (а значит, число валентных электронов, а значит (хотя не всегда) - число электронов на внешней орбите) . Конкретно. Например, все элементы 1 группы являются крайне активными щелочными металлами с валентностью 1 (им энергетически выгоднее отдать единственный валентный электрон) . Или, к примеру, все элементы 7 группы являются очень активными неметаллами, стремящимися к образованию кислот, являются весьма электроотрицательными, проявляют в основном валентность 1 (т. к. им энергетически выгоднее взять 1 электрон для заполнения электронной оболочки - 8 электронов) . В общем, каждая группа содержит сходные по химическим и физическим свойствам элементы. А период содержит последовательность элементов, которые изменяют свои свойства от первой группы к последней. После чего "счёт" переходит снова к первой группе, но уже следующего периода.
touch.otvet.mail.ru
Как правильно читать таблицу Менделеева??? Смотрим внутри!
<a rel="nofollow" href="http://ru.wikipedia.org/wiki/Периодическая_система_химических_элементов" target="_blank">http://ru.wikipedia.org/wiki/Периодическая_система_химических_элементов</a>
Ну, заранее не думаю что тебе это нужно, все должно быть со временем, но попробую объяснить... Есть металлы и неметаллы, металл с металлом не реагирует, как и неметалл с неметаллом. К примеру Li-литий, он же номер 3, не будет реагировать с Mg-марганцом, т. к они оба металла. сверху где римские цифры это валентность, валентность это как бы сколько атомов этого вещества можно присоединить к себе других. А короче вот на примере Н2-водород+О2-кислород=Н2О, т. к Н-валетность 1, а О-2 и мы ищем общий знаменатель, то есть к примеру Н2О, Н2-это означает что у него 2 атома водорода, а когда он просто Н, то один, так как у него валентность 1 а у О, валентность 2, то нужно их сделать равными, то есть что бы небыло остатков и с той и с той стороны, след, для водорода нужно 2 атома, то есть Н2, а у кислорода и так валентность 2,ему не нужно, ну как бы там все это долго растягивать, поэтому половину первого курса здесь описано.... <img src="//otvet.imgsmail.ru/download/8b1b1369bb590b1de7cac5543f59c7b3_i-24.jpg">
оно тебе надо летом? ты же все равно будешь гамать в Майнкрафт, БФ4 или во что вы там играете
H - если просто, а не в соединении с чем-то, то читается как "водород", а если в соединении, то "аш" например h30 - читается " аш два о" (кислород в соединении читается как "о") двойка нижний индекс, пишется она внизу маленькой циферкой <img src="//otvet.imgsmail.ru/download/273a01bc4cdde76ccb142e7623384821_i-2.jpg"> вообще, есть такие вещества, которые в чистом виде пишутся только с индексами: h3, 02 - это водород, кислород, а также I2 - йод Br2 - бром F2 - фтор Cl2 - хлор (ещё N2) так эти вещества и в различных соединениях читаются, например: HCl - аш хлор, он же хлороводород многие вещества читаются так, как написано в таблице, но не все Углерод С читается как "цэ", например: С02 - угарный газ "цэ о два" Сера S читается "эс": S02 сернистый газ, " эс о два" Азот N - "эн", HNO3 - азотная кислота, "аш эн о три" Фосфор P - "пэ", P2O5 - "пэ два о пять" - оксид фосфора а также железо - ферум медь - купрум серебро - аргентум золото - аурум олово - станум свинец - плюмбум а вот нижняя часть таблицы (начиная с 5ого периода) тебе особенно не понадобиться, мы почти не используем её на уроках с: ну, надеюсь чем-то помогла.
touch.otvet.mail.ru