Содержание
Основные термодинамические процессы.
Как упоминалось в предыдущей статье, термодинамическим процессом называют изменение состояния системы, в результате которого хотя бы один из ее параметров (температура, объем или давление) изменяет свое значение. Впрочем, если учесть, что все параметры термодинамической системы неразрывно взаимосвязаны, то изменение любого из них неизбежно влечет изменение хотя бы одного (в идеале) или нескольких (в реальности) параметров. В общем случае можно сказать, что термодинамический процесс связан с нарушением равновесия системы, и если система находится в равновесном состоянии, то никаких термодинамических процессов в ней протекать не может.
Равновесное состояние системы — понятие абстрактное, поскольку невозможно изолировать что-либо материальное от окружающего мира, поэтому в любой реальной системе неизбежно протекают разнообразные термодинамические процессы. При этом в некоторых системах могут иметь место настолько медленные, почти незаметные изменения, что связанные с ними процессы можно условно считать состоящими из последовательности равновесных состояний системы. Такие процессы называют равновесными или квазистатическими.
Такие процессы называют равновесными или квазистатическими.
Еще один возможный сценарий последовательных изменений в системе, после которых она возвращается к исходному состоянию, называют круговым процессом или циклом. Понятия равновесного и кругового процесса лежат в основе многих теоретических выводов и прикладных приемов термодинамики.
Изучение термодинамического процесса заключается в определении работы, совершенной в данном процессе, изменения внутренней энергии, количества теплоты, а также в установлении связи между отдельными величинами, характеризующими состояние газа.
Из всех возможных термодинамических процессов наибольший интерес представляют изохорный, изобарный, изотермический, адиабатный и политропный процессы.
***
Изохорный процесс
Изохорным называют термодинамический процесс, протекающий при постоянном объеме. Такой процесс может совершаться при нагревании газа, помещенного в закрытый сосуд. Газ в результате подвода теплоты нагревается, и его давление возрастает.
Изменение параметров газа в изохорном процессе описывает закон Шарля: p1/T1 = p2/T2, или в общем случае:
p/T = const.
Давление газа на стенки сосуда прямо пропорционально абсолютной температуре газа.
Так как в изохорном процессе изменение объема dV равно нулю, то можно сделать вывод, что вся подведенная к газу теплота расходуется на изменение внутренней энергии газа (никакая работа не совершается).
***
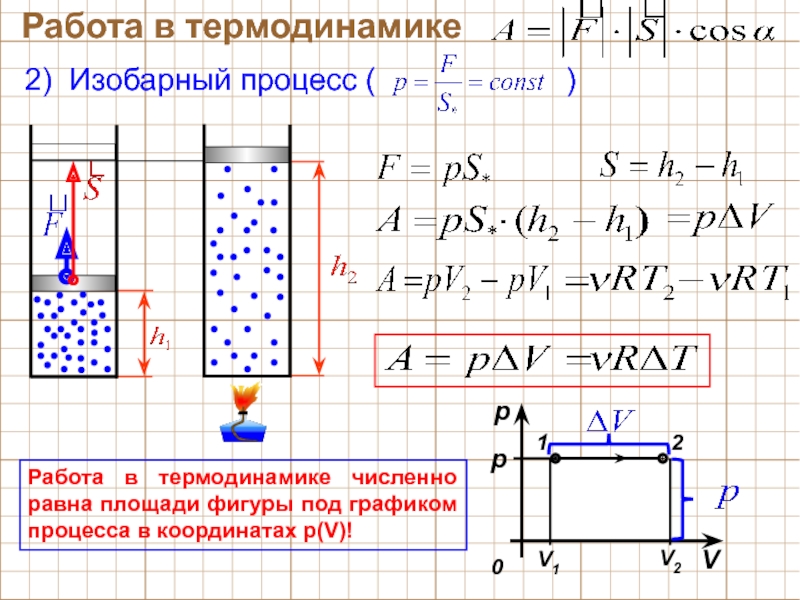
Изобарный процесс
Изобарным называют термодинамический процесс, протекающий при постоянном давлении. Такой процесс можно осуществить, поместив газ в плотный цилиндр с подвижным поршнем, на который действует постоянная внешняя сила при отводе и подводе теплоты.
При изменении температуры газа поршень перемещается в ту или иную сторону; при этом объем газа изменяется в соответствии с законом Гей-Люссака:
V/T = const.
Это означает, что в изобарном процессе объем занимаемый газом, прямо пропорционален температуре.
Можно сделать вывод, что изменение температуры в этом процессе неизбежно приведет к изменению внутренней энергии газа, а изменение объема связано с выполнением работы, т. е. при изобарном процессе часть тепловой энергии тратится на изменение внутренней энергии газа, а другая часть – на выполнение газом работы по преодолению действия внешних сил. При этом соотношение между затратами теплоты на увеличение внутренней энергии и на выполнение работы зависит от теплоемкости газа.
***
Изотермический процесс
Изотермическим называют термодинамический процесс, протекающий при неизменной температуре.
Практически осуществить изотермический процесс с газом очень трудно. Ведь необходимо соблюсти условие, чтобы в процессе сжатия или расширения газ успевал обмениваться температурой с окружающей средой, поддерживая собственную температуру постоянной.
Изотермический процесс описывается законом Бойля-Мариотта: pV = const, т. е. при постоянной температуре величина давления газа обратно пропорциональна его объему.
Очевидно, что при изотермическом процессе внутренняя энергия газа не изменяется, поскольку его температура постоянна.
Чтобы выполнялось условие постоянства температуры газа, от него необходимо отводить теплоту, эквивалентную работе, затраченной на сжатие:
dq = dA = pdv.
Используя уравнение состояния газа, проделав ряд преобразований и подстановок, можно сделать вывод, что работа газа при изотермическом процессе определяется выражением:
A = RT ln(p1/p2).
***
Адиабатный процесс
Адиабатным называют термодинамический процесс, протекающий без теплообмена рабочего тела с окружающей средой. Подобно изотермическому, осуществить на практике адиабатный процесс очень сложно. Такой процесс может протекать с рабочим телом, помещенным в сосуд, например, цилиндр с поршнем, окруженный высококачественным теплоизолирующим материалом.
Но какой бы качественный теплоизолятор мы не применяли в данном случае, некоторым, пусть даже ничтожно малым, количеством теплоты рабочее тело и окружающая среда неизбежно будут обмениваться.
Поэтому на практике можно создать лишь приближенную модель адиабатного процесса. Тем не менее, многие термодинамические процессы, осуществляемые в теплотехнике, протекают настолько быстро, что рабочее тело и среда не успевают обмениваться теплотой, поэтому с некоторой степенью погрешности такие процессы можно рассматривать как адиабатные.
Для вывода уравнения, связывающего давление и объем 1 кг газа в адиабатном процессе, запишем уравнение первого закона термодинамики:
dq = du + pdv.
Поскольку для адиабатного процесса теплопередача dq равна нулю, а изменение внутренней энергии есть функция теплопроводности от температуры: du = cvdT, то можно записать:
cvdT + pdv = 0 (3).
Продифференцировав уравнение Клапейрона pv = RT, получим:
pdv + vdp = RdT.
Выразим отсюда dT и подставим в уравнение (3). После перегруппировки и преобразований получим:
pdvcv/(R + 1) + cvvdp/R = 0.
С учетом уравнения Майера R = cp – cv последнее выражение можно переписать в виде:
pdv(cv + cp — cv)/(cp – cv) + cvvdp/(cp – cv) = 0,
или
cppdv + cvvdp = 0 (4).
Разделив полученное выражение на cv и обозначив отношение cp/cv буквой k, после интегрирования уравнения (4) получим (при k = const):
ln vk + ln p = const или ln pvk = const или pvk = const.
Полученное уравнение является уравнением адиабатного процесса, в котором k – показатель адиабаты.
Если предположить, что объемная теплоемкость cv является величиной постоянной, т. е. cv = const, то работу адиабатного процесса можно представить в виде формулы (приводится без вывода):
l = cv(T1 – T2) или l = (p1v1 – p2v2)/(k-1).
***
Политропный процесс
В отличие от рассмотренных выше термодинамических процессов, когда какой-либо из параметров газа оставался неизменным, политропный процесс характеризуется возможностью изменения любого из основных параметров газа. Все рассмотренные выше термодинамические процессы являются частными случаями политропных процессов.
Общее уравнение политропного процесса имеет вид pvn = const, где n – показатель политропы — постоянная для данного процесса величина, которая может принимать значения от — ∞ до + ∞.
Очевидно, что придавая показателю политропы определенные значения, можно получить тот или иной термодинамический процесс – изохорный, изобарный, изотермический или адиабатный.
Так, если принять n = 0, получим p = const – изобарный процесс, если принять n = 1, получим изотермический процесс, описываемый зависимостью pv = const; при n = k процесс является адиабатным, а при n равном — ∞ или + ∞. мы получим изохорный процесс.
Так как уравнение политропы по своему содержанию аналогично уравнению адиабатного процесса, то формулы, устанавливающие связь между параметрами политропного процесса будут аналогичны таковым для адиабатного процесса с той лишь разницей, что показатель адиабаты k нужно заменить на показатель политропы n.
Тогда:
p2/p1 = (v1/v2)n; Tnp(n-1) = const; Tnv(n-1) = const.
Работа газа при политропном процессе может быть определена по формуле:
l = (p1v1 – p2v2)/(k-1).
Теплоемкость при политропном процессе (приводится без вывода):
cn = cv(n – k)/(n – 1).
***
Понятие энтальпии и энтропии
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине «Основы гидравлики и теплотехники»
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
- для специальности СПО «Механизация сельского хозяйства»
- для специальности СПО «Техническое обслуживание и ремонт автомобильного транспорта»
Скачать календарно-тематический план
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
- для специальности СПО «Механизация сельского хозяйства»
- для специальности СПО «Техническое обслуживание и ремонт автомобильного транспорта»
Главная страница
- Страничка абитуриента
Дистанционное образование
- Группа ТО-81
- Группа М-81
- Группа ТО-71
Специальности
- Ветеринария
- Механизация сельского хозяйства
- Коммерция
- Техническое обслуживание и ремонт автотранспорта
Учебные дисциплины
- Инженерная графика
- МДК.
 01.01. «Устройство автомобилей»
01.01. «Устройство автомобилей» - Карта раздела
- Общее устройство автомобиля
- Автомобильный двигатель
- Трансмиссия автомобиля
- Рулевое управление
- Тормозная система
- Подвеска
- Колеса
- Кузов
- Электрооборудование автомобиля
- Основы теории автомобиля
- Основы технической диагностики
- Основы гидравлики и теплотехники
- Метрология и стандартизация
- Сельскохозяйственные машины
- Основы агрономии
- Перевозка опасных грузов
- Материаловедение
- Менеджмент
- Техническая механика
- Советы дипломнику
Олимпиады и тесты
- «Инженерная графика»
- «Техническая механика»
- «Двигатель и его системы»
- «Шасси автомобиля»
- «Электрооборудование автомобиля»
1) Термодинамическим процессом называется переход системы из одного состояния в другое.
Физическая
термодинамика
Лекция
9.
Термодинамические
равновесные и неравновесные состояния
и термодинамические процессы. Внутренняя
энергия и температура термодинамической
системы. Адиабатически изолированная
термодинамическая система. Первое
начало термодинамики. Уравнение
Клапейрона – Менделеева состояния
идеального газа и изопроцессы. Основные
положения молекулярно – кинетической
теории: зависимость давления от
кинетической энергии молекулы, основное
уравнение молекулярно – кинетической
теории, средняя квадратичная скорость
молекул идеального газа
Равновесным
состоянием
называется состояние системы, не
изменяющееся с течением времени и при
постоянных внешних условиях и сохраняется
произвольно долгое время. Параметры
состояния системы разделяются на внешние
и внутренние.
Внешними параметрами системы называются
физические величины, которые зависят
от положения в пространстве и различных
свойств тел, являющихся внешними по
отношению к данной системе. Внутренними
Внутренними
параметрами системы
называются физические величины, зависящие
как от положения внешних по отношению
к системе тел, так и от координат и
скоростей частиц, образующих данную
систему. Равновесный
процесс
является обратимым и круговым или
циклическим, если в ходе термодинамического
процесса система возвращается в исходное
состояние.
При
необратимом круговом или циклическом
процессе после его завершения окружающие
тела не возвращаются в предыдущее
состояние, т.е. внешние параметры
термодинамической системы изменяются.
Полная
энергия такой системы, очевидно, состоит
из механической энергии системы как
целого, внутренней энергии совокупности
взаимодействующих между собой и
хаотически движущихся частиц и энергии
ядерного взаимодействия нуклонов атомов
системы.
С
точки зрения термодинамики под внутренней
энергией тела понимают сумму кинетической
энергии хаотического движения составляющих
ее частиц и потенциальной энергии их
взаимодействия.
Температура
— T
системы,
находящейся в состоянии термодинамического
равновесия, зависит от параметров
давления
— p
(p
= dFn/dS),
удельного объема —
v0
(v0
=
1/ρ)
и является
функцией внутренней энергии системы.
Эта функция имеет монотонную зависимость
от внутренней энергии, т.е. возрастает
с увеличением внутренней энергии.
3)
Адиабатическая
термодинамическая система
—
изолированная
термодинамическая система, в которой
отсутствует теплообмен с внешней средой.
Изменение
внутренней энергии такой системы равно
производимой над ней работе. Всякий
процесс в адиабатически изолированной
системе называется адиабатическим
процессом.
4)
Первое начало термодинамики для
адиабатически изолированной системы:
работа A12,
совершенная
адиабатически изолированной
термодинамической системой при переходе
из первого состояния с внутренней
энергией U1
во второе
состояние с внутренней энергией U2,
равна разности внутренних энергий в
указанных состояниях:
A12
=
U1
—
U2
Первое
начало термодинамики: количество теплоты
Q,
подводимое к системе, идет на изменение
ее внутренней энергии ΔU
и на совершение
этой системой работы A
над внешними телами:
Q
=
ΔU
+ A
5)
Для произвольной массы газа состояние
газа описывается уравнением
Менделеева—Клапейрона:
,
где
—
давление,
—
объем,
—
массa,
—
молярная масса,
—
универсальная газовая постоянная.
Уравнение Менделеева—Клапейрона
показывает, что возможно одновременное
изменение трех параметров, характеризующих
состояние идеального газа.
Изопроцессом
называют
процесс, происходящий с данной массой
газа при одном постоянном параметре —
температуре, давлении или объеме. Из
уравнения состояния как частные случаи
получаются законы для изопроцессов.
Изотермическим
называют
процесс, протекающий при постоянной
температуре:
.
Он описывается законом Бойля—Мариотта:
.
Изохорным
называют
процесс, протекающий при постоянном
объеме:
.
Для него справедлив закон Шарля:
.
Изобарным
называют
процесс, протекающий при постоянном
давлении. Уравнение этого процесса
имеет вид
при
и называется законом Гей-Люссака.
6)
Основное уравнение МКТ идеального газа:
давление
идеального газа пропорционально
произведению концентрации молекул на
среднюю кинетическую энергию
поступательного движения молекулы.
7)
Среднеквадратичная скорость молекул:
R
– универсальная газовая постоянная.
Давление
идеального газа на стенки сосуда: p=nkT,
k –
постоянная Больцмана.
8)
Средняя кинетическая энергия
поступательного движения молекул:
Лекция
10.
Закон
равномерного распределения энергии по
степеням свободы молекул. Эффективное
сечение взаимодействий, длина свободного
пробега и средняя частота соударений
молекул газа. Экспериментальное
подтверждение молекулярно – кинетической
теории – опыты Штерна и Дюнуайе.
Теплоемкость идеального газа при
постоянном объеме или давлении.
Соотношение Майера. Закон Дюлонга и
Пти. Адиабатический процесс: показатель
адиабаты, уравнение Пуассона.Политропические
процессы: уравнение, показатель политропы
и молярная теплоемкость при изобарическом,
адиабатическом и изотермическом
процессах.
1)
Закон Больцмана о равномерном распределении
энергии по степеням свободы молекул: для
системы,
находящейся в состоянии термодинамического
равновесия, на каждую поступательную
и вращательную степени свободы приходится
в среднем кинетическая энергия, равная
kT/2,
а
на каждую колебательную степень свободы
—
в
среднем энергия, равная
kT.
2)
Средняя энергия молекулы:
где
i
—
сумма
числа поступательных, числа вращательных
и удвоенного
числа
колебательных степеней свободы
молекулы:
i = iпост+
iвращ+
2 iколеб
Эффективное
сечение —
величина, характеризующая вероятность
взаимодействия микрочастиц при их
столкновении;
= d2
=4r2
Длина
свободного пробега молекулы
— это расстояние (обозначаемое λ),
которое частица пролетает за время
свободного пробега от одного столкновения
до следующего.
,
где σ
— эффективное
сечение молекулы,
n — концентрация
молекул.
среднее
число столкновений,
где n
— концентрация молекул, πd2
— средняя скорость молекулы или путь,
пройденным ею за 1 с.
Термодинамические процессы | Определение и типы
Термодинамический процесс определяется как переход от одного равновесного макросостояния к другому макросостоянию. начальное и конечное состояния являются определяющими элементами процесса.
начальное и конечное состояния являются определяющими элементами процесса.
Во время такого процесса система выходит из начального состояния i , описываемого давлением p i , объемом V i и температурой T i , проходит через различные квазистатических состояния до конечного состояния f , описываемого давлением p f , объемом V f и температурой Т ф . В этом процессе энергия может передаваться из системы или в систему и может осуществляться системой или на ней. Одним из примеров термодинамического процесса является повышение давления газа при сохранении постоянной температуры. В следующем разделе примеры термодинамических процессов имеют первостепенное значение в разработке тепловых двигателей.
Типы термодинамических процессов
Обратимый процесс
В термодинамике обратимый процесс определяется как процесс, который можно обратить вспять путем вызывания бесконечно малых изменений некоторого свойства системы.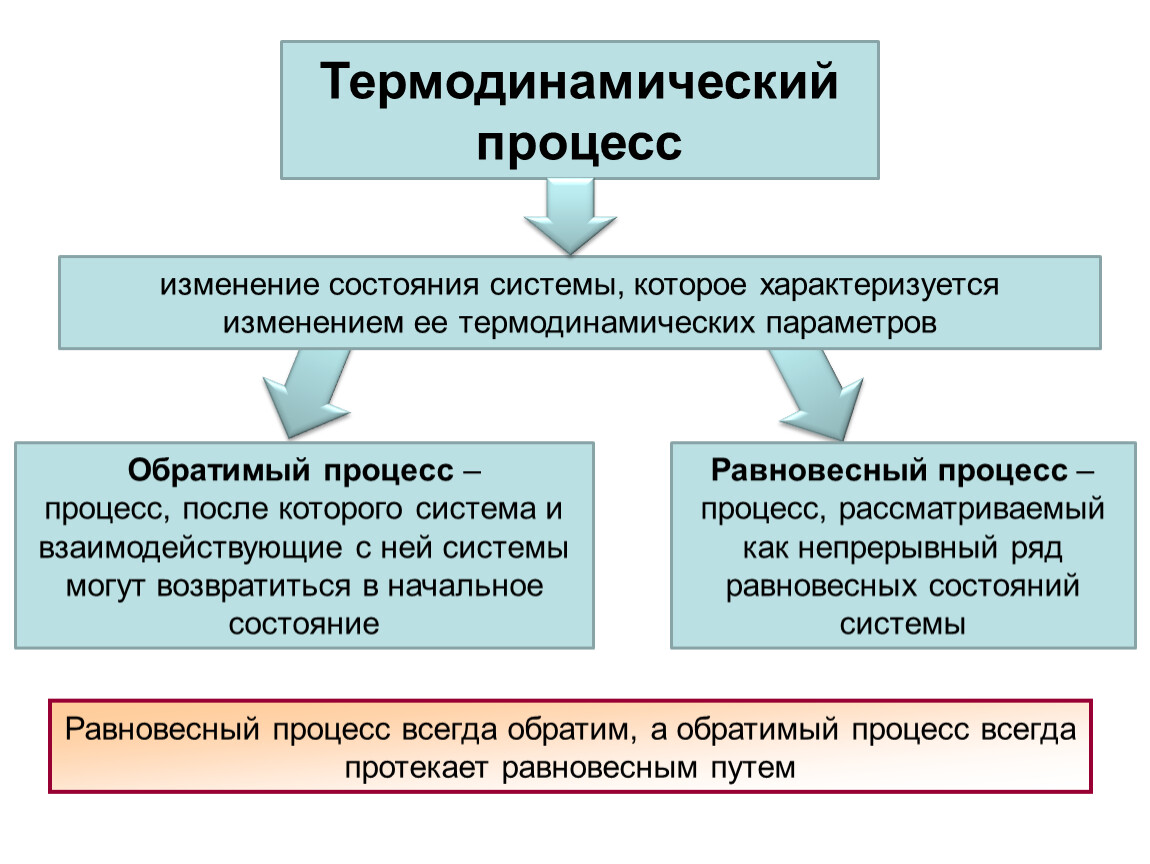 При этом он не оставляет никаких изменений ни в системе, ни в окружающей среде. В ходе обратимого процесса энтропия системы не увеличивается, и система находится в термодинамическом равновесии с окружающей средой.
При этом он не оставляет никаких изменений ни в системе, ни в окружающей среде. В ходе обратимого процесса энтропия системы не увеличивается, и система находится в термодинамическом равновесии с окружающей средой.
Необратимый процесс
В термодинамике необратимый процесс определяется как необратимый процесс, который не может вернуть как систему, так и окружающую среду в исходное состояние.
В ходе необратимого процесса энтропия системы возрастает .
Циклический процесс
Процесс, который в конечном итоге возвращает систему в исходное состояние, называется циклическим процессом . После цикла все свойства имеют то же значение, что и в начале. Для такого процесса конечное состояние такое же, как начальное состояние , поэтому изменение полной внутренней энергии должно быть равно нулю.
Следует отметить, что согласно второму закону термодинамики , не вся теплота, подведенная к циклу, может быть преобразована в равное количество работы. Должен иметь место отвод тепла . Тепловой КПД , η th любой тепловой машины как отношение работы, которую она совершает, W , к подводимой теплоте при высокой температуре, Q H . η th = W/Q H .
См. также: Обратимый процесс
См. также: Необратимый процесс
См. также: Циклический процессИзэнтропический процесс является частным случаем адиабатических процессов. Это обратимый адиабатический процесс. Изэнтропический процесс также можно назвать процессом с постоянной энтропией. Процесс, который в конечном итоге возвращает систему в исходное состояние, называется циклическим процессом.
Изэнтропический процесс
Изэнтропический процесс — это термодинамический процесс , в котором энтропия жидкости или газа остается постоянной. Это означает, что изоэнтропический процесс является частным случаем адиабатического процесса , в котором нет переноса тепла или вещества. Это обратимый адиабатический процесс . Изэнтропический процесс также можно назвать процессом с постоянной энтропией. В технике такой идеализированный процесс очень полезен для сравнения с реальными процессами.
Это означает, что изоэнтропический процесс является частным случаем адиабатического процесса , в котором нет переноса тепла или вещества. Это обратимый адиабатический процесс . Изэнтропический процесс также можно назвать процессом с постоянной энтропией. В технике такой идеализированный процесс очень полезен для сравнения с реальными процессами.
См. также: Изэнтропический процесс
Основные характеристики изэнтропического процесса
Таблица основных характеристик P-V диаграмма изоэнтропического расширения гелия (3 → 4) в газовой турбине.
Адиабатический процесс
Адиабатический процесс – это термодинамический процесс , в котором отсутствует теплопередача в систему или из нее (Q = 0). Систему можно считать идеально изолированной . В адиабатическом процессе энергия передается только в виде работы. Предположение об отсутствии теплопередачи очень важно, так как мы можем использовать адиабатическое приближение только в очень быстрые процессы . В этих быстрых процессах не хватает времени для передачи энергии в виде тепла в систему или из системы.
В этих быстрых процессах не хватает времени для передачи энергии в виде тепла в систему или из системы.
В реальных устройствах (таких как турбины, насосы и компрессоры) происходят потери тепла и потери в процессе сгорания. Тем не менее, эти потери обычно невелики по сравнению с общим потоком энергии, и мы можем аппроксимировать некоторые термодинамические процессы адиабатическим процессом.
См. также: Адиабатический процесс
Основные характеристики адиабатического процесса
Основные характеристики адиабатического процесса Изэнтропическое и адиабатическое расширение.
Изотермический процесс
Изотермический процесс — это термодинамический процесс , в котором температура системы остается постоянной (T = const). Передача тепла в систему или из системы обычно должна происходить с такой низкой скоростью, чтобы постоянно приспосабливаться к температуре резервуара посредством теплообмена. В каждом из этих состояний тепловое равновесие сохраняется.
В каждом из этих состояний тепловое равновесие сохраняется.
Случай n = 1 соответствует изотермическому (при постоянной температуре) процессу для идеального газа и политропному процессу. В отличие от адиабатического процесса , в котором n = κ и система не обменивается теплом с окружающей средой (Q = 0; ∆T≠0 90 094) , в изотермическом процесса внутренняя энергия не меняется (из-за ∆T=0) и, следовательно, ΔU = 0 (для идеальных газов) и Q ≠ 0. Адиабатический процесс не обязательно изотермический процесс, равно как и изотермический процесс не обязательно адиабатический.
См. также: Изотермический процесс
Основные характеристики изотермического процесса
Изотермический процесс – основные характеристики Закон Бойля-Мариотта. Для фиксированной массы газа при постоянной температуре объем обратно пропорционален давлению. Источник: grc.nasa.gov Политика НАСА в отношении авторских прав гласит, что «материалы НАСА не защищены авторским правом, если не указано иное».
Источник: grc.nasa.gov Политика НАСА в отношении авторских прав гласит, что «материалы НАСА не защищены авторским правом, если не указано иное».
Изобарический процесс
Изобарический процесс — это термодинамический процесс , в котором давление системы остается постоянным (p = const). Передача тепла в систему или из системы работает, но также изменяет внутреннюю энергию системы.
Поскольку происходят изменения внутренней энергии (dU) и изменения объема системы (∆V), инженеры часто используют энтальпию системы, которая определяется как:
H = U + pV
Во многих термодинамических анализах удобно использовать энтальпию вместо внутренней энергии, особенно в первом законе термодинамики .
В технике оба важных термодинамических цикла ( цикл Брайтона и цикл Ренкина ) основаны на двух изобарных процессах . Поэтому изучение этого процесса имеет решающее значение для электростанций.
Поэтому изучение этого процесса имеет решающее значение для электростанций.
См. также: Изобарический процесс
Основные характеристики изобарического процесса
Изотермический процесс – основные характеристики Для фиксированной массы газа при постоянном давлении объем прямо пропорционален температуре Кельвина. Источник: grc.nasa.gov Политика НАСА в отношении авторских прав гласит, что «материалы НАСА не защищены авторским правом, если не указано иное».
Изохорный процесс
Изохорный процесс — это термодинамический процесс, в котором объем замкнутой системы остается постоянным (V = const). Он описывает поведение газа внутри контейнера, который нельзя деформировать. Поскольку объем остается постоянным, передача тепла в систему или из нее не влияет на p∆V, а только изменяет внутренняя энергия системы (температура).
В технике двигателей внутреннего сгорания очень важны изохорные процессы для их термодинамических циклов (цикл Отто и Дизеля). Поэтому изучение этого процесса имеет решающее значение для автомобилестроения.
Поэтому изучение этого процесса имеет решающее значение для автомобилестроения.
См. также: Изохорный процесс
Основные характеристики изохорного процесса
Изохорный процесс – основные характеристики. Для фиксированной массы газа при постоянном объеме давление прямо пропорционально температуре по Кельвину.
Политропный процесс
Политропный процесс — это любой термодинамический процесс, который может быть выражен следующим уравнением:
Политропический процесс может описывать расширение и сжатие газа. , которые включают теплопередачу . Показатель степени n известен как индекс политропы , , и он может принимать любое значение от 0 до ∞, в зависимости от конкретного процесса.
См. также: Политропный процесс
Основные характеристики политропного процесса
Политропный процесс – основные характеристикиПолитропные процессы с различными индексами политропы.
Процесс дросселирования – изэнтальпический процесс
Процесс дросселирования – это термодинамический процесс , в котором энтальпия газа или среды остается постоянной (h = const) . Процесс дросселирования является одним из изоэнтальпийных процессов . В процессе дросселирования никакая работа не выполняется системой или над ней (dW = 0), и обычно теплопередача отсутствует ( адиабатическая ) из системы или в нее (dQ = 0). С другой стороны, процесс дросселирования не может быть изоэнтропическим. Это принципиально необратимый процесс . Характеристики процесса дросселирования:
- Без переноса работы
- Без переноса тепла
- Необратимый процесс
- Изентальпический процесс
Дросселирование влажного пара также связано с сохранением энтальпии . Но в этом случае снижение давления вызывает увеличение качества пара .
Но в этом случае снижение давления вызывает увеличение качества пара .
См. также: Процесс дросселирования
Ссылки:
Ядерная и реакторная физика:
- Дж. Р. Ламарш, Введение в теорию ядерных реакторов, 2-е изд., Аддисон-Уэсли, Рединг, Массачусетс (1983).
- Дж. Р. Ламарш, А. Дж. Баратта, Введение в ядерную технику, 3-е изд., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
- WM Stacey, Физика ядерных реакторов, John Wiley & Sons, 2001, ISBN: 0-471-39127-1.
- Гласстоун, Сесонске. Разработка ядерных реакторов: разработка реакторных систем, Springer; 4-е издание, 1994 г., ISBN: 978-0412985317
- WSC. Уильямс. Ядерная физика и физика элементарных частиц. Кларендон Пресс; 1 издание, 1991 г., ISBN: 978-0198520467
- Кеннет С. Крейн. Введение в ядерную физику, 3-е издание, Wiley, 1987, ISBN: 978-0471805533
- Г. Р. Кипин. Физика ядерной кинетики. Паб Эддисон-Уэсли.
 Ко; 1-е издание, 1965
Ко; 1-е издание, 1965 - Роберт Рид Берн, Введение в работу ядерных реакторов, 1988 г.
- Министерство энергетики, ядерной физики и теории реакторов США. Справочник по основам Министерства энергетики США, том 1 и 2. Январь 1993 г.
Advanced Reactor Physics:
- K. O. Ott, WA Bezella, Introductory Nuclear Reactor Static, American Nuclear Society, Revis редакционное издание (1989 г.), 1989 г., ISBN: 0-894-48033-2.
- К. О. Отт, Р. Дж. Нойхольд, Введение в динамику ядерных реакторов, Американское ядерное общество, 1985, ISBN: 0-894-48029-4.
- Д. Л. Хетрик, Динамика ядерных реакторов, Американское ядерное общество, 1993, ISBN: 0-894-48453-2.
- Э. Э. Льюис, В. Ф. Миллер, Вычислительные методы переноса нейтронов, Американское ядерное общество, 1993, ISBN: 0-894-48452-4.
См. выше:
Термодинамика
сообщите об этом объявлении
Термодинамические процессы — типы и уравнения
Мы знаем, что существуют различные методы, которые можно использовать для перевода термодинамической системы из ее начального состояния в конечное состояние. Мы поговорим об этих термодинамических процессах в этой статье. Сначала мы рассмотрим, что такое квазистатический процесс. Переменные состояния определяются только тогда, когда термодинамическая система находится в равновесии с окружающей средой, как объяснялось ранее. Квазистатический процесс — это процесс, при котором система постоянно находится в термодинамическом равновесии с окружающей средой.
Мы поговорим об этих термодинамических процессах в этой статье. Сначала мы рассмотрим, что такое квазистатический процесс. Переменные состояния определяются только тогда, когда термодинамическая система находится в равновесии с окружающей средой, как объяснялось ранее. Квазистатический процесс — это процесс, при котором система постоянно находится в термодинамическом равновесии с окружающей средой.
Как продукты в холодильнике остаются холодными и свежими? Вы когда-нибудь замечали, что даже когда внутри холодильника холодно, снаружи или сзади холодильника тепло? Здесь холодильник извлекает тепло из своего внутреннего пространства и передает его в окружающую среду. Вот почему задняя стенка холодильника теплая. Термодинамические процессы — это движение тепловой энергии внутри или между системами.
Термодинамическая система — это определенное пространство или макроскопическая область во Вселенной, состояние которой может быть выражено через давление, температуру и объем и в котором происходит один или несколько термодинамических процессов. Все внешнее по отношению к этой термодинамической системе представляет собой окружение и отделено от системы границей. Окружение, система и граница вместе составляют вселенную. Типы систем в термодинамике следующие:
Все внешнее по отношению к этой термодинамической системе представляет собой окружение и отделено от системы границей. Окружение, система и граница вместе составляют вселенную. Типы систем в термодинамике следующие:
Открытая система: она позволяет энергии и массе втекать и выходить из нее.
Закрытая система: Она позволяет передавать через свои границы только энергию (работу и тепло).
Изолированная система: Ни масса, ни энергия не могут взаимодействовать с ней.
Зимой потирание ладоней согревает. Это происходит из-за того, что прикосновение к нашим ладоням производит тепло. Тепло пара также используется в паровых двигателях для перемещения поршней, заставляющих вращаться колеса поезда. Но какова реальная процедура здесь? Это связано с явлением, известным как «термодинамика».
Изучение связи между теплотой, работой, температурой и энергией известно как термодинамика. Термодинамика занимается перемещением энергии из одного места в другое и из одной формы в другую в самом широком смысле. Существенная концепция состоит в том, что теплота — это разновидность энергии, которая соответствует определенному количеству механического труда.
Формально тепло не признавалось формой энергии примерно до 1798 года, когда граф Румфорд (сэр Бенджамин Томпсон), британский военный инженер, обнаружил, что при сверлении стволов пушек может производиться бесконечное количество тепла, и что количество выделяемое тепло пропорционально количеству работы, совершаемой при вращении тупого бурильного инструмента. Основой термодинамики является наблюдение Румфордом связи между произведенным теплом и выполненной работой. Исследования Карно были сосредоточены на ограничениях максимального количества работы, которую паровой двигатель может произвести, используя в качестве движущей силы высокотемпературный теплообмен. Рудольф Клаузиус, немецкий математик и физик, преобразовал эти идеи в первый и второй законы термодинамики в том же столетии.
Рудольф Клаузиус, немецкий математик и физик, преобразовал эти идеи в первый и второй законы термодинамики в том же столетии.
Типы термодинамических процессов
Состояние данной термодинамической системы может быть выражено различными параметрами, такими как давление (P), температура (T), объем (V) и внутренняя энергия (U). Если зафиксировать любые два параметра, скажем, давление (Р) и объем (V) фиксированной массы газа, то температура (Т) газа будет автоматически зафиксирована по уравнению PV = RT. Нельзя изменить T без изменения P и V.
Состояние системы можно изменить с помощью различных процессов. В термодинамике типы процессов включают:
Изобарический процесс, при котором давление (P) поддерживается постоянным (ΔP =0).
Изохорный процесс, при котором объем (V) поддерживается постоянным (ΔV = 0).

Изотермический процесс, при котором температура (T) поддерживается постоянной (ΔT =0).
Адиабатический процесс, при котором теплопередача равна нулю (Q=0).
Примечания по термодинамическому процессу обсуждались позже.
Работа в термодинамических процессах
Когда объем (V) системы изменяется, говорят, что произошла работа давление-объем. Термодинамический процесс, происходящий в замкнутой системе таким образом, что скорость изменения объема достаточно мала для того, чтобы давление (P) оставалось постоянным и однородным во всей системе, является квазистатическим процессом. В этом случае работа (Вт) представляется как:
δW = PdV, где δW — бесконечно малое приращение работы системой, а dV — бесконечно малое приращение объема.
Кроме того, W = \[\int\] PdV, где W — работа, совершаемая системой в течение всего обратимого процесса.
Изобарический процесс
Поскольку в этом процессе давление (P) постоянно, объем системы изменяется. Проделанная работа (W) может быть рассчитана как W = P (Vfinal — Vinital).
Если ΔV положительно (расширение), то работа положительна. При отрицательном ΔV (сжатие) работа отрицательна.
Изохорный процесс
Объем остается постоянным в изохорном процессе. Следовательно, система не совершает никакой работы (поскольку ΔV = 0, PΔV или W также равны нулю). Такой процесс, при котором не происходит изменения объема, может быть достигнут путем помещения термодинамической системы в закрытый контейнер, который не сжимается и не расширяется. Таким образом, из первого начала термодинамики (Q = ΔU + W) изменение внутренней энергии становится равным переданному теплу (ΔU = Q) для изохорного процесса.
Изотермический процесс
Температура системы остается постоянной при изотермическом процессе. Мы знаем,
Мы знаем,
W = \[\int\] PdV
Из газового закона,
PV = nRT
P = nRT/V. Используя значение P в уравнении работы:
Вт = nRT VB \[\int\]VA (dV/V)
W = nRT ln (VB/VA)
Если VB больше, чем VA, работа done будет положительным или отрицательным.
Поскольку внутренняя энергия зависит от температуры, ΔU = 0, поскольку температура постоянна, и, таким образом, из первого закона термодинамики (Q = ΔU + W) мы получаем Q = W.
Адиабатический процесс
В адиабатическом процессе теплообмена с системой не происходит (Q = 0). Его математическое представление:
PVƔ = K (константа).
Кроме того, W = \[\int\] PdV. Подставляя значение P в уравнение работы:
Вт = K Vf \[\int\]Vi (dV/VƔ)
Вт = K [(Vf1-Ɣ — Vi1-Ɣ)/ 1-Ɣ]
Поскольку Q = 0 для адиабатического процесса, из первого начала термодинамики (Q = ΔU + W) получим ΔU = -W.

 01.01. «Устройство автомобилей»
01.01. «Устройство автомобилей» Ко; 1-е издание, 1965
Ко; 1-е издание, 1965